植物黄酮调控JNK通路干预氧化应激相关疾病的研究进展
宋欣豫,李大鹏
(山东农业大学食品科学与工程学院, 山东泰安 271018)
c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)是由丝氨酸/苏氨酸蛋白激酶组成的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族的成员,是一类进化保守的激酶。MAPK在细胞增殖、分化、凋亡、神经元功能和应激反应中起主导作用。MAPK家族的成员还有ERKs和p38,每种激酶都存在多种亚型。
研究发现,JNK可被生长因子、细胞因子、应激等因素激活[1],磷酸化JNK(p-JNK)通过磷酸化下游靶点c-Jun、ATF-2、ELK1、NEAT等,导致基因表达程序的改变,在细胞调控中起关键作用[2]。JNK通路功能紊乱可导致多种疾病。此外,JNK对应激通路具有调控作用。p-JNK能够磷酸化c-Jun及ATF-2的氨基末端活性区域,促进细胞因子及蛋白表达[3]。应激条件下,JNK1和JNK2分别优先磷酸化c-Jun和ATF-2,使JNK转录的活性增强,诱导疾病的发生[4]。因此,抑制JNK可能在预防慢性疾病中非常重要。
氧化应激与多种疾病密切相关。饮食中的抗氧化剂(包括黄酮)被认为是氧化应激相关疾病的潜在保护剂。植物膳食中的水果、蔬菜及茶等是植物黄酮的主要饮食来源。植物黄酮具有抗氧化、抗炎和调节血管渗透等活性,对多种疾病的发生具有预防作用[5]。研究发现,植物黄酮常作为JNK调节剂用于预防糖尿病、缺血/再灌注损伤及神经退行性疾病等,本文就植物黄酮对JNK干预的最新研究进展进行了综述。
1 JNK及其编码基因
JNK有 3种基因亚型:JNK1、JNK2、JNK3,其中JNK1和JNK2可以在机体所有细胞中表达,而JNK3主要在神经组织和大脑中限制性表达[6]。JNK3的研究集中在其对中枢神经系统及阿尔茨海默病[7]等神经退行性疾病的调控作用。此外,JNK及其编码基因均能由促炎细胞因子、生长因子或应激信号等激活。
2 JNK信号通路的调控网络
MAPK通路由三级激酶组成:MAPK激酶激酶(MAPK kinase kinase,MAP3K)、MAPK 激酶(MAPK kinase,MAP2K)和MAPK。它们能够逐级磷酸化,将上游信号传递到下游效应器。JNK信号通路的MAP3K主要有:凋亡信号调节激酶(Apoptotic signalregulated kinases,ASK)、TGF-β激活的蛋白激酶(TGF-βactivated protein kinase,TAK)等[8]。JNK信号通路上游的MAP2K主要是MKK7和MKK4。MKK7的激活依赖于细胞因子的作用,而MKK4在环境应激作用下能够被激活[9]。MKK7和MKK4通过双重磷酸化Thr-Pro-Tyr基序来协同激活JNK,MKK7 靶向 Thr183,MKK4 靶向 Tyr185[10]。
作为一种重要的JNK效应器,转录激活因子-1(activator protein-1, AP-1)既可以作为含有两种Jun蛋白的同二聚体,也可以作为含有Jun蛋白和Fos蛋白的异二聚体[11]。JNK被激活后,能够使c-Jun的N端Ser63和Ser73残基发生磷酸化[12]。因此当c-Jun磷酸化增强时,AP-1的活性也会随之增加,进而诱导下游基因的转录[13]。另外,JNK也可以直接磷酸化其他下游靶蛋白进而调控细胞转录过程,如ATF家族的成员、Elk-1、Bcl-2、Bim等,从而调节细胞凋亡、代谢和DNA修复等生理过程[14]。JNK信号通路也受到不同的支架蛋白调控,如JIP1、JIP2、JIP3 等(图1)。
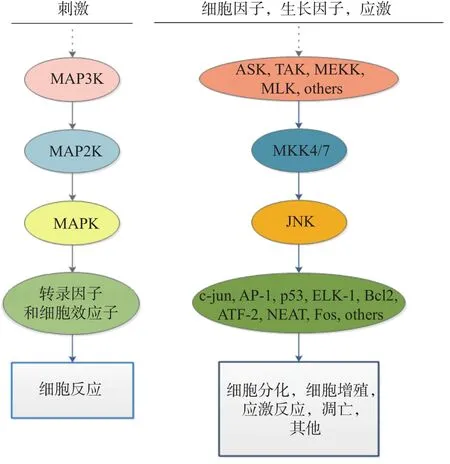
图1 MAPK信号级联示意图Fig.1 MAPK signal cascade diagram
3 JNK与氧化应激
活性氧 (reactive oxygen species,ROS)能够破坏DNA、蛋白质,从而使细胞氧化还原状态失衡。当抗氧化蛋白清除能力低于ROS的产生时,就会引发氧化应激,从而损伤细胞。ROS介导的JNK信号通路在应激反应中起关键作用。ROS能够使MAPK信号通路发生MAP3K→MAP2K→MAPKs三级级联反应,进而从细胞质进入到细胞核中,靶向作用于下游效应器。
ASK1是MAP3K的一种亚型,可被ROS、肿瘤坏死因子-α(TNF-α)和脂多糖等多种应激激活,其中ROS是ASK1最有效的激活剂[15]。硫氧还蛋白(thioredoxin,Trx)是一类控制细胞氧化还原状态的蛋白质[16]。Trx含有两个半胱氨酸残基。氧化状态下,半胱氨酸中的巯基氧化形成二硫键,因此在维持细胞内氧化还原平衡方面起着关键作用。Trx为ASK1的结合蛋白,通过与ASK1结合来抑制其活性。ROS氧化Trx使其与ASK1分离,并诱导ASK1的齐聚以及ASK1信号体的形成[17]。ASK1被激活,并诱导ASK1激酶结构域内的关键苏氨酸残基磷酸化,进而激活p38和JNK等下游靶蛋白[18]。
3.1 JNK与细胞凋亡
JNK在细胞凋亡中起关键作用。JNK调控细胞凋亡的方式有两种:外源性是由细胞表面死亡受体通过相应配体刺激而激活:JNK能够磷酸化c-Jun和ATF-2进而激活AP-1和Fas/FasL通路,Fas/FasL通过激活半胱氨酸蛋白酶 8(caspase 8)进而激活caspase 3,引起凋亡[19]。内源性激活途径是由Bcl-2家族蛋白介导的,使细胞色素c从线粒体释放,活化caspase 9,进而激活caspase 3,最终导致凋亡。JNK磷酸化后还可通过Bax依赖的MOMP诱导凋亡[20]。
3.2 JNK与自噬
JNK通过两种不同的机制调节自噬:一是通过磷酸化 Bcl-2/Bcl-xL促进 Beclin1-Bcl-2/Bcl-xL的分离。自噬调节因子Beclin 1具有上调自噬的作用,JNK1可使Bcl-2磷酸化,干扰其与自噬调节因子的结合[21]。作为对凋亡刺激的反应,Bcl2L11(也称为BIM)是一种仅含BH3的蛋白质,由MAPK8/JNK磷酸化,这种磷酸化通过与Beclin 1解离促进自噬,这种解离由DYNLL1(也称为LC8)促进[22]。另外,JNK可以上调损伤调节自噬因子(DRAM)的表达,DRAM通过产生自溶体来促进自噬体的累积[23]。最近的研究显示ROS是JNK-AP-1信号转导的激活因子,在JNK依赖性自噬调节中至关重要[24]。
4 氧化应激与疾病
过量的ROS会引起氧化应激,进而导致细胞和组织的氧化损伤,最终导致某些疾病的发生和发展,如糖尿病、缺血/再灌注损伤及神经退行性疾病等[25]。氧化应激通过诱导β细胞功能障碍和胰岛素抵抗而成为糖尿病的罪魁祸首,在糖尿病的发病机制和进展中起主要作用。以氧化应激为靶点的治疗策略在糖尿病及其并发症的治疗中具有很大的潜力。晚期糖基化终产物及受体(Advanced glycation end products-Receptor for advanced glycation endproducts,AGERAGE)激活导致氧化应激,该机制参与缺血/再灌注损伤的发病机理。神经退行性疾病如帕金森病(Parkinson’s disease,PD)中,它主要表现为黑质致密部中的多巴胺能神经元进行性丧失和大脑路易体α-突触核蛋白聚集体的积聚,可能是氧化应激损伤所致[26]。α-突触核蛋白的聚集被认为是帕金森病的关键因素[27]。因此,许多研究集中于通过降低氧化应激来改善这些疾病。
5 黄酮对JNK干预氧化应激相关疾病的调控
JNK参与糖尿病、缺血/再灌注损伤等多种疾病的发病机制。研究表明,植物黄酮具有干预JNK参与的氧化应激相关疾病的作用(表1)。因此,寻找有效干预JNK的植物黄酮对人类健康有重要意义。

表1 黄酮类化合物在干预JNK致病中的作用及机制Table 1 Role and mechanism of flavonoids in the intervention of JNK
5.1 糖尿病
糖尿病是一组以胰岛素抵抗和胰岛素分泌不足为特征,可导致多器官功能障碍的疾病。胰岛素抵抗、β细胞凋亡都与JNK紧密相关。在胰岛素抵抗中,自由基或促炎性细胞因子激活JNK信号转导通路[28],促进胰岛素底物受体IRS参与胰岛素抵抗。在β细胞中,JNK1/2通过ROS刺激磷酸化其下游靶点c-Jun,拮抗胰岛素基因的增强子来抑制基因转录,使胰岛素的合成量减少[29]。此外,通过活化JNK下游的促凋亡因子,释放细胞色素C诱导凋亡。因此,抑制JNK信号通路可以降低氧化应激对β细胞造成的高血糖毒性[30]。柚皮苷通过抑制JNK信号通路减轻高糖引起的糖尿病肾纤维化[31]。刘颖慧等[32]以HepG2细胞为研究对象,发现桑叶多糖和黄酮均有促进葡萄糖吸收的作用,通过减弱JNK,IRS-1基因和蛋白表达,增强PDX-1基因和蛋白表达,达到减缓胰岛素抵抗的目的。二氢杨梅素通过阻断JNK信号通路来减缓高糖引起的细胞凋亡[33]。综上,在氧化应激条件下,激活JNK信号通路导致糖尿病及并发症的发生,而植物黄酮可以通过调控JNK信号通路进行干预疾病。
5.2 缺血/再灌注损伤
在缺血一段时间内,脑和心脏的血管再通后灌注,会造成神经元损伤,称为缺血再灌注损伤。脑和心脏是在缺血/再灌注损伤中起关键作用的两个器官,其死亡率和发病率均居社会首位。脑缺血/再灌注损伤导致患者内皮细胞以及血脑屏障的损伤[34]。心肌缺血/再灌注与心肌细胞凋亡、心律失常有关[35]。在缺血/再灌注损伤中JNK家族功能紊乱[36]。山奈酚能抑制JNK途径减弱AGE-RAGE介导的氧化应激来减缓糖尿病大鼠心肌缺血-再灌注损伤[37]。槲皮素能够显著提高缺氧/复氧(hypoxia/reoxygenation,H/R)诱导的H9c2心肌细胞的存活率,可能是通过抑制JNK信号通路实现的,从而进一步消除凋亡相关蛋白的激活[38]。研究发现植物黄酮可以抑制H/R后细胞内ROS的产生,这表明植物黄酮具有抗氧化作用。除此之外,白藜芦醇也有抗氧化的作用。白藜芦醇通过下调p-JNK的表达,保护神经元免受脑缺血再灌注损伤[39]。花青素通过阻断JNK和p53信号通路来减轻局灶性脑缺血引起的神经元损伤[40]。以往的实验数据表明,氧化应激在缺血/再灌注损伤中起重要作用,摄入富含黄酮类的食物可以通过调节JNK途径减轻氧化应激来保护脑和心脏。
5.3 神经退行性疾病
MAPK在神经细胞的凋亡中起关键作用,JNK会被应激优先激活,从而刺激神经元细胞凋亡。植物黄酮具有神经保护作用,可改善认知能力、记忆能力和运动能力,在预防神经退行性疾病如帕金森病和阿尔茨海默病(Alzheimer disease,AD)等具有重要的应用价值。
AD是认知性功能障碍与记忆衰退为特征的神经退行性病变,从神经病理学的角度来看,其特征是细胞外形成β-淀粉样蛋白(amyloidβ-protein,Aβ)斑块和神经原纤维缠结以及细胞内高磷酸化tau蛋白的聚集[40]。PD是第二常见的神经退行性疾病。在α-突触核蛋白高表达的PD小鼠模型中,神经原纤维缠结的限制性分布与JNK磷酸化的水平增加相关[41]。
原花青素可以通过抑制ROS/JNK信号通路使神经元免受1-甲基-4-苯基-1,2,3,6-四氢吡啶处理诱导的损伤[42]。在镉诱导的神经元细胞中,川陈皮素通过抑制JNK信号通路减轻细胞凋亡[43]。Jian等[44]研究发现,原花青素能够显著降低鱼藤酮诱导的ROS生成并通过抑制JNK信号通路来减弱SH-SY5Y细胞凋亡。刺槐素通过阻断JNK的磷酸化减弱6-OHDA诱导的SH-SY5Y细胞凋亡[45]。花青素的神经保护特性与氧化应激的改善以及Aβ沉积的减少有关[46]。杨梅黄酮通过抑制MKK4和JNK的磷酸化,保护MES23.5细胞免受神经毒性药物1-甲基-4-苯基吡啶阳离子(1-methy-4-phenylpyridinium ion,MPP+)引起的损伤[47]。姜黄素通过抑制JNK的表达来改善AD大鼠的学习记忆能力[48]。芹菜素主要通过调节氧化还原失衡、保护线粒体功能、抑制JNK通路等机制发挥抗Aβ毒性作用[49]。综上,氧化应激与神经退行性疾病密切相关,ROS的过度累积会破坏生物分子,造成神经细胞功能损伤。植物黄酮通过抑制JNK信号通路来增强抗氧化防御系统。
5.4 慢性炎症性疾病
慢性炎症是氧化应激的重要表现,过度的氧化应激会促进炎性细胞因子的生成。MAPK信号转导通路与多种炎症反应有关。研究表明,JNK与包括败血症在内的各种炎症性疾病的发病机制有关[50]。JNK激活通过转录因子c-Jun促进炎症诱导的细胞功能障碍和多个器官中Caspases的激活。类黄酮抑制LPS诱导的炎性细胞因子产生的几种机制已被研究,其中阻断NF-κB和MAPK途径被认为是两种主要机制[51]。
漆黄素通过抑制类固醇受体共激活剂介导的JNK信号通路,减缓肾脏炎症进而抵抗LPS诱导的败血性急性肾损伤小鼠[52]。高良姜精通过减弱JNK诱导的炎症而显著减弱顺铂诱导的肾毒性[53]。Wang等[54]研究发现,在LPS诱导的WI-38肺成纤维细胞中,槲皮素通过使JNK通路失活,保护细胞免受炎性损伤。甘草甙抑制IL-1β诱导的类风湿性关节炎-成纤维样滑膜细胞中JNK的磷酸化,表明甘草甙可以减轻滑膜炎症,其分子机制可能与MAPK信号转导途径的异常激活有关[55]。原儿茶酸通过调节JNK信号传导、破骨细胞标记基因的表达,以及破坏c-Fos稳定性来抑制NF-κB配体的受体激活剂(receptor activator of NF-κB ligand,RANKL)诱导的破骨细胞分化和功能,结果表明原儿茶酸可用于治疗炎症性骨疾病[56]。在牛乳腺上皮细胞中,桑色素通过抑制JNK信号通路的激活来保护LPS诱导的炎症反应[57]。黄芩苷减轻LPS刺激的人肝L-02和THLE2细胞炎症可能是通过上调TUG1,抑制JNK途径,显示出抗炎活性[58]。在上皮细胞中,木犀草素以及其他黄酮类物质,如白杨素和山奈酚,通过抑制JNK阻断TNF-α触发ICAM-1的表达[59]。
研究表明,巨噬细胞的异常激活在包括败血症在内的许多炎性疾病中起有害作用[60]。槲皮素的糖苷衍生物槲皮素n-3-O-β-D-葡萄糖醛酸通过抑制JNK的磷酸化对LPS刺激的RAW264.7巨噬细胞中具有抗炎作用[61]。大量实验数据表明,氧化应激在慢性炎症性疾病中起关键作用,植物黄酮通过调控JNK途径减轻氧化应激发挥保护作用。
5.5 其他
研究表明,氧化应激还会导致白癜风黑色素细胞的变性。芹黄素通过抑制多巴胺诱导的JNK磷酸化,减轻ROS的积累,从而抑制黑素细胞的凋亡,可能具有治疗白癜风的潜力[62]。近些年来,食物过敏越来越普遍。食物过敏会导致机体功能紊乱。芸香柚皮苷通过阻滞JNK磷酸化来干预小鼠过敏性哮喘发作[63]。姜黄素通过抑制JNK而有效抑制凝血酶诱导的人牙龈成纤维细胞中结缔组织生长因子(connective tissue growth factor,CTGF/CCN2)的表达,说明姜黄素在牙龈过度生长的发展有抑制作用[64]。
6 结论与展望
JNK调控许多细胞过程,包括细胞周期、分化、凋亡及炎症反应,在多种疾病的发生过程中起关键作用,是调节细胞处于正常状态与疾病状态时的关键靶点。近些年来,JNK信号通路的研究取得了很大的进展,众多JNK的上游激酶、下游靶点及调节因子被发现,为进一步研究JNK信号通路奠定了基础。但是, JNK信号通路受多种因素的调控,呈现出保守性和复杂性,其参与疾病调控的分子机制仍需进一步阐明。
目前主要通过药物干预JNK从而对疾病达到预防与治疗的作用。然而,许多药物具有副作用,从植物中得到的天然化合物是一种更安全的选择。植物黄酮能够有效减缓氧化应激损伤,可以减轻由于自由基产生而导致的JNK磷酸化,进一步预防糖尿病等多种疾病的发生和发展。近年来,植物黄酮调控JNK信号通路的研究越来越多,为预防多种疾病的发生提供了干预策略。然而,由于黄酮分子结构的多样性,仍需对不同黄酮进行细致、准确的构效表征,以便更好地阐明其保护作用的分子机制。此外,植物黄酮在体内的代谢产物是否具有调控JNK的作用及其与人体内环境平衡相互作用的机制仍需进一步研究。

