瓶鼻海豚(Tursiops truncatus)及其近缘物种 牛(Bos taurus)TLR8基因免疫应答功能的探究
谷 龙,章纬菁,于芳芳,任文华
(南京师范大学生命科学学院,江苏 南京 210023)
鲸类的陆地祖先在大约5 600万年前从陆地进入海洋[1],面对和陆地不同的生态环境,鲸类从形态、生理到分子水平发生了一系列进化适应,例如为了应对海洋中多样且随着洋流迅速传播的病原体[2],鲸类的免疫功能发生了相应的变化. 鲸类既有和陆生哺乳动物同源的免疫器官,又有其独特的解剖结构如淋巴上皮喉部腺体等[3]. 在分子水平上,有研究发现主要组织相容性复合物(MHC)基因变异与鲸类对病原体侵袭的免疫能力有关[4];对印度太平洋驼背海豚(Sousachinensis)的白细胞转录组的分析也发现了大量可能在免疫耐受中起作用的相关基因[5]. 此外,一些关于Toll样受体(Toll-like receptor,TLRs)分子进化的研究证明,TLRs在鲸类中发生了正选择[6-9].
哺乳动物的免疫类型分为先天免疫和获得免疫两种系统,TLRs作为先天免疫系统的核心成分,处于抵御病原体的第一线. TLRs位于细胞膜表面或细胞内膜系统上,作为中间介导分子,识别病原体相关的分子模式(Pathogen-associated molecular patterns,PAMPs),并启动细胞内信号转导的级联反应,最终形成适应性免疫[10]. 哺乳动物有10~15种TLRs,每种都适应特定病原体的不同配体[11-12].TLR1、TLR2、TLR4、TLR5、TLR6、TLR10和TLR11位于细胞膜上,参与识别杆菌、鞭毛蛋白、真菌和衣原体等病原微生物,被称为非病毒性TLRs.TLR3、TLR7、TLR8和TLR9位于细胞内的细胞器膜上,比如内质网膜上,参与识别病原微生物的核酸物质,如单链或双链病毒RNA,属于病毒型TLRs[13]. 其中,TLR8的天然配体主要是单链病毒RNA(ssRNA)[12,14],也能被某些人工合成的激动剂如瑞奎莫特(Resiquimod,R848)、咪唑莫特(Imiquimod)等激活. 配体被TLR8识别后,通过髓样分化因子88(MyD88)信号通路激活下游转录因子(如 NF-κB 和c-Jun)[15-16],产生一系列的细胞免疫因子如IL-8、IL-12等[17],从而对病毒产生天然免疫.
TLRs作为Ⅰ型跨膜蛋白,均具有相似的结构,通常由胞外域、跨膜域和胞内域组成. 其中,胞外域主要包含数个富含亮氨酸重复序列(Leucine rich repeats,LRRs)结构域;胞内域为Toll-IL-1结构域(TIR结构域),参与信号转导;胞外域和胞内域之间通过单个跨膜螺旋结构域相连[18]. 徐等对鲸类包括TLR8在内的10种TLRs进行生物信息学分析,发现其胞外域具有大量正选择位点,并且绝大多数正选择位点发生了激进的氨基酸替代[19].
鲸类和陆生哺乳动物TLR8基因结构和功能的差异目前尚未见报道,本研究通过克隆测序鉴定了瓶鼻海豚和牛两个物种的TLR8基因序列,并对其氨基酸序列和蛋白质结构进行了生物信息学分析;此外通过克隆瓶鼻海豚和牛TLR8基因,转染人源胚肾细胞系HEK293细胞(该细胞自身不表达TLR8,通过人工激活剂R848刺激可以产生TLR8),检测其下游基因的表达差异,探讨鲸类适应海洋环境发生的免疫适应分子机制.
1 材料与方法
1.1 样品和主要试剂
瓶鼻海豚肌肉样本取自本课题组积累的中国沿海搁浅或意外捕获/杀死的死亡个体,牛肝脏样本采购自南京市栖霞区附近屠宰场. 动物材料处理的所有程序均经南京师范大学机构评审委员会批准. 用DNA/RNA样品保护剂(Takara)处理样品,液氮保存. 本实验使用HEK293细胞系购自美国ATCC公司.
RNA保护试剂RNAiso、Plus、PrimeScriptTMRT 试剂盒、DNA Marker、限制性内切酶、T4连接酶购自Takara公司;R848(Resiquimod)购自InvivoGen公司;Luciferase报告系统试剂盒、NF-κB-Luc质粒、pRL-TK质粒购自Promega公司;Lipofectamine 2000 购于Invitrogen公司;切胶纯化试剂盒、质粒提取试剂盒购自Axygen公司;胎牛血清、Opti-MEM培养基购自Gbico公司;SYBR Green Master(ROX)购自Roche公司;pcDNA3.1+质粒购自Thermo公司;NF-κB(P65)、β-actin、IL-8兔抗鼠一抗和羊抗兔二抗购自美国ImmunoWay 公司.
1.2 实验方法
1.2.1 瓶鼻海豚基因组DNA提取
瓶鼻海豚TLR8CDS处于一个外显子内,使用酚氯仿抽提法提取了瓶鼻海豚基因组DNA用于目的基因的扩增.
1.2.2 牛肝脏组织总RNA提取和RT-PCR获得cDNA
按照RNA提取试剂盒TRIzolReagent(Invitrogen公司)说明书进行牛新鲜肝脏样品总RNA提取,加入50 μL Rnase-free water溶解沉淀,产物浓度检测后-80 ℃保存.
根据PrimeScriptTMRT试剂盒(Takara公司)说明书逆转录RNA成cDNA,4 ℃保存.
1.2.3 瓶鼻海豚和牛TLR8基因克隆
GenBank中瓶鼻海豚和牛TLR8基因的收录号分别为XM_004317714、EF583902.1,据此序列使用引物设计软件Primer Premier 5和DNASTAR设计其开放阅读框的引物,在上下游引物的5′端分别添加限制性内切酶BamHⅠ和XhoⅠ酶切位点和保护碱基. 引物序列见表1 Primers for PCR部分.
分别以瓶鼻海豚基因组DNA和牛cDNA为模板扩增TLR8基因,简称为dTLR8和cTLR8. PCR产物测序.
1.2.4 TLR8蛋白结构预测分析
使用MEGA软件对瓶鼻海豚和牛的TLR8蛋白进行序列比对;使用SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;使用TMHMM Sever,v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜区;使用SMART网站(http://smart.embl-heidelberg.de/)预测TLR8功能域;使用 EZMOL(http://www.sbg.bio.ic.ac.uk/ezmol/)预测蛋白质的三维结构;使用Pymol软件对瓶鼻海豚和牛两种蛋白质的三维结构进行比对.
1.2.5TLR8重组质粒的构建和HEK293细胞转染
dTLR8和cTLR8基因全长片段分别与pcDNA3.1+质粒连接,转化感受态细胞DH5α,使用Axygen试剂盒进行质粒抽提.
培养细胞密度至合适时使用试剂Lipofectamine 2000进行转染,将Opti-MEM与Lipofectamine 2000或质粒等比例混合.
1.2.6 双荧光素酶报告系统检测NF-κB表达
将dTLR8-pcDNA3.1+质粒或cTLR8-pcDNA3.1+质粒与NF-κB启动子驱动的萤火虫荧光素酶报告质粒(NF-κB-Luc)及海肾荧光素酶报告质粒(pRL-TK)共转染至HEK293细胞,24 h后加入R848进行刺激(每孔1 μg/mL),培养一段时间后通过Dual-luciferase报告系统试剂盒(Promega公司)进行荧光强度的测定,从而获得NF-κB表达情况.
1.2.7 qRT-PCR检测IL-8表达情况
将dTLR8-pcDNA3.1+质粒与cTLR8-pcDNA3.1+质粒分别转染至HEK293细胞,24 h后加入R848进行刺激(每孔1 μg/mL),处理8 h后提取RNA并进行反转录,通过qRT-PCR检测TLR8及其下游免疫因子IL-8的mRNA表达水平. 引物序列见表1 Primers for qRT-PCR部分.

表1 引物序列Table 1 Primers sequences
实验进行3次生物学重复,且每次重复使用3个复孔.
1.2.8 Western blot检测NF-κB和IL-8
离心收集被R848刺激的转染TLR8-pcDNA3.1+的HEK293细胞,充分裂解,检测细胞上清总蛋白浓度,并调整为一致的终浓度. 12%分离胶SDS-PAGE电泳. 转移蛋白至PVDF膜上分别进行一抗二抗反应. 使用凝胶成像仪进行曝光显色.
1.2.9 数据处理
重复实验3次,t检验检测统计数值差异,显著差异用*表示(P<0.05),极显著差异用**来表示(P<0.01).
2 结果与讨论
2.1 瓶鼻海豚和牛TLR8基因克隆
根据GenBank中瓶鼻海豚和牛TLR8基因的收录号分别设计引物,以瓶鼻海豚基因组DNA和牛RNA逆转录成的cDNA为模板扩增TLR8基因,PCR产物检测如图1A、B第2泳道所示,产物序列长度约3 000 bp,经测序分别证实获得克隆目的片段分别为3 198 bp和3 102 bp,各含有完整的开放阅读框3 105 bp和 3 072 bp,测序结果通过NCBI网站BLAST比对证实分别为瓶鼻海豚和牛的TLR8基因.

A:牛TLR8 PCR产物和检验;B:瓶鼻海豚TLR8 PCR产物和检验 1:DNA Marker;2:TLR8 PCR产物;3:cTLR8-pcDNA3.1+/dTLR8-pcDNA3.1+构建后载体双酶切结果;4:空载pcDNA3.1+质粒双酶切结果.图1 TLR8 PCR产物和表达载体双酶切检验Fig.1 The test of PCR products and expression vectors of TLR8
2.2 瓶鼻海豚和牛TLR8蛋白结构预测
2.2.1 瓶鼻海豚和牛TLR8蛋白质序列比对
使用MEGA软件对瓶鼻海豚和牛TLR8的氨基酸序列进行比对,两个物种分别含有1 035和1 024个氨基酸残基(图2),且牛和瓶鼻海豚相比,氨基酸位点存在多处不同:牛TLR8蛋白质在第97~98位点检测到2个氨基酸的缺失,在第322~330位点检测到9个氨基酸的缺失. 同时,一级结构检测到3个与信号转导功能相关的高度保守的基序:Box1、Box2和Box3.

“*”表示瓶鼻海豚和牛TLR8相同的氨基酸位点;“.”表示不同的氨基酸位点;双下划线为信号肽;单下划线为跨膜区;方框依次为Box1、Box2和Box3.图2 瓶鼻海豚和牛TLR8蛋白序列比对结果Fig.2 Sequence comparison of Tursiops truncatus and Bos taurus TLR8
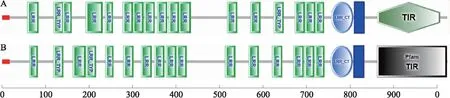
A:瓶鼻海豚TLR8蛋白质的结构域;B:牛TLR8蛋白质的结构域图3 瓶鼻海豚和牛TLR8蛋白质的结构域预测Fig.3 Prediction of domain of Tursiops truncatus and Bos taurus TLR8 protein
2.2.2 瓶鼻海豚和牛TLR8蛋白质的信号肽、跨膜区和结构域预测
信号肽(SP)是引导新合成蛋白质到膜中或跨膜转移的短肽链. 本研究使用信号肽预测工具SingaIP-5.0 sever在线对瓶鼻海豚和牛TLR8蛋白质的信号肽进行预测,结果发现两个物种的信号肽均为第1~17个氨基酸(图2).
使用蛋白质跨膜预测网站TMHMM Sever v.2.0对瓶鼻海豚和牛TLR8蛋白质的分析发现,瓶鼻海豚的跨膜区为第820~843个氨基酸,牛的跨膜区为第809~831个氨基酸. 瓶鼻海豚膜外区共820个氨基酸残基,牛与之相比有159个差异,占19.4%. 瓶鼻海豚膜内区共192个氨基酸残基,牛与之相比有7个差异,占3.6%(图2).
使用SMART在线服务预测瓶鼻海豚和牛TLR8蛋白质的结构域,结果显示瓶鼻海豚膜外区包括18个LRR(leucine-rich repeats)序列(图3A),其中瓶鼻海豚在120~143,632~655位点有2个LRR_TYR结构域(LRR_typical subfamily),在766~817有1个LRRCT(LRR C-terminal domain);牛有17个LRR序列(图3B),其中有2个分别位于118~141,193~216位点的LRR_TYR结构域,1个位于755~806位点的LRRCT结构域. 本研究发现,牛不仅比瓶鼻海豚缺少1个LRR序列(即瓶鼻海豚LRR3序列),并且两者后续LRR的位置和数量也有一定区别. 膜内区负责引导下游信号通路,较膜外域保守,且两个蛋白均预测到与白介素-1型受体同源的TIR(Toll/IL-1 receptor domain,TIR)结构域.
2.2.3 瓶鼻海豚和牛TLR8蛋白质的二级结构分析
利用在线分析软件SOPMA预测分析瓶鼻海豚和牛TLR8蛋白质所形成的二级结构,所得结果如图所示(图4). 瓶鼻海豚TLR8蛋白中分别有486个α螺旋(46.96%),142个β折叠(13.72%),47个β转角(4.54%)和360个无规则卷曲(34.78%);牛TLR8蛋白中分别有440个α螺旋(42.97%),150个β折叠(14.65%),54个β转角(5.27%)和380个无规则卷曲(37.11%). 在瓶鼻海豚和牛TLR8蛋白二级结构中,α螺旋数量差异达到了46个(占10.4%),β折叠、β转角和无规则卷曲数量没有显著差别,但是它们的α螺旋、β折叠、β转角和无规则卷曲位置存在差别.

图中彩色字母表示二级结构,蓝色 h 代表α螺旋,红色 e 代表β折叠,绿色 t 代表β转角,黄色 c 代表无规则卷曲. A:瓶鼻海豚TLR8蛋白质的二级结构;B:牛TLR8蛋白质的二级结构图4 瓶鼻海豚和牛TLR8蛋白质的二级结构预测Fig.4 Prediction of the secondary structure of Tursiops truncatus and Bos taurus TLR8 protein
2.2.4 瓶鼻海豚和牛TLR8蛋白质的三级结构分析
瓶鼻海豚和牛TLR8的3D结构预测显示(图5),瓶鼻海豚的α螺旋和β折叠的数量为18个和22个,牛的为18个和21个. 同时,两个物种的膜外域均为马蹄形结构,α螺旋凸向环形外侧,β折叠在内侧,瓶鼻海豚TLR8蛋白有8个大小不等的α螺旋和18个β折叠,牛有9个α螺旋和17个β折叠,两者存在1个α螺旋和β折叠的差异;膜内域均为类球形结构,α螺旋包裹在球形外侧,β折叠在内侧,瓶鼻海豚由10个α螺旋和4个β折叠通过loop连接而成,牛有9个α螺旋和4个β折叠,两者存在1个α螺旋的差异.
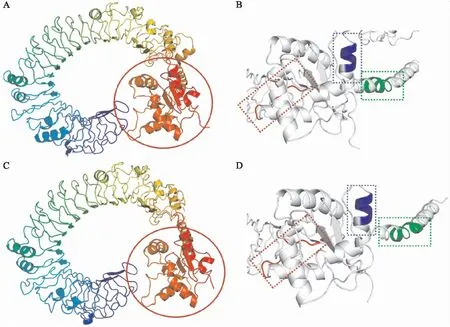
A:瓶鼻海豚TLR8的三维结构;B:瓶鼻海豚TLR8膜内区放大图;C:牛TLR8的三维结构;D:牛TLR8膜内区放大图 图中红色圈代表TLR8膜内区,绿色框代表Box1,红色框代表Box2,蓝色框代表Box3.图5 瓶鼻海豚和牛TLR8蛋白质的三维结构预测Fig.5 Three-dimensional structure prediction of Tursiops truncatus and Bos taurus TLR8 protein
2.3 瓶鼻海豚和牛TLR8重组质粒载体构建
双酶切扩增得到的瓶鼻海豚和牛TLR8基因,将其连接至双酶切后的pcDNA3.1+质粒,从而构建表达载体. 构建后的cTLR8-pcDNA3.1+/dTLR8-pcDNA3.1+载体双酶切验证结果见图1,A、B 3泳道均出现了两条带,一条带在3 000 bp附近,和TLR8PCR产物长度相当,另一条带在5 000 bp附近,长度与4泳道的空载质粒一致,表明质粒构建成功.
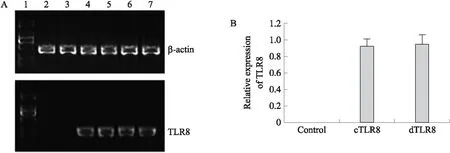
A:1:DNA Marker;2:不使用R848刺激的空载pcDNA3.1+;3:使用R848刺激的空载pcDNA3.1+;4:不使用R848刺激的cTLR8-pcDNA3.1+;5:使用R848刺激的cTLR8-pcDNA3.1+;6:不使用R848刺激的dTLR8-pcDNA3.1+;7:使用R848刺激的dTLR8-pcDNA3.1+;B:Control:空载pcDNA3.1+;cTLR8:转染了cTLR8-pcDNA3.1+表达载体的细胞;dTLR8:转染了dTLR8-pcDNA3.1+表达载体的细胞.图6 TLR8的初始表达和转染效率Fig.6 The expression and transfection efficiency of TLR8
2.4 TLR8的初始表达和转染效率的探究
本研究使用半定量PCR对细胞中TLR8表达情况进行了检测,结果如图6A所示,2、3泳道无条带说明野生型细胞不表达TLR8;4、5和6、7两条泳道的条带明暗程度无差异. 因此可以认为,R848刺激与否基本不影响TLR8的表达.
同时本研究使用qRT-PCR检测了转染pcDNA3.1+、cTLR8-pcDNA3.1+和dTLR8-pcDNA3.1+的细胞中TLR8mRNA的表达量. 结果如图6B所示,除空载质粒外,两种转染细胞TLR8的表达量大致相当. 因此可以认为,当其他条件相同时,cTLR8-pcDNA3.1+和dTLR8-pcDNA3.1+可以被视为具有相似的转染效率.
2.5 R848刺激HEK293细胞对TLR8下游基因NF-κB和IL-8表达水平的影响
为了探究R848刺激对TLR8激活下游通路的影响,本研究通过双荧光素酶报告实验检测了下游基因NF-κB的表达水平,结果如图7A所示:在未使用R848刺激时,转染cTLR8-pcDNA3.1+质粒、dTLR8-pcDNA3.1+质粒组和对照组相比,荧光值小幅度提升;在使用R848刺激后,对照组荧光值略有下降,而转染重组质粒组荧光值分别较空载质粒组提升至4倍和2.8倍左右,且较非刺激组也提升约至2.5倍和2倍左右.
此外,本研究通过qRT-PCR检测了下游基因IL-8的表达水平,结果如图7B所示:在未使用R848刺激时,三种转染组IL-8的表达量大致相当;在使用R848刺激后,对照组IL-8的表达量略有下降,转染重组质粒组较未刺激IL-8的表达量显著提升:转染cTLR8-pcDNA3.1+质粒组刺激后表达量较未刺激提升至约4倍左右,转染dTLR8-pcDNA3.1+质粒组刺激后表达量较未刺激提升至约1.6倍左右,且数据差异极显著(**,P<0.01). 由此可见,两组转染组细胞均能有效提升R848刺激后IL-8的表达量,且转染了牛TLR8细胞的表达量提升更为显著.

Control:空载pcDNA3.1+;cTLR8:cTLR8-pcDNA3.1+载体的转染细胞;dTLR8:dTLR8-pcDNA3.1+载体的转染细胞;白色为未加R848组,黑色为加R848组.图7 R848刺激对TLR8下游基因NF-κB和IL-8表达水平的影响Fig.7 The effect of R848 stimulation on the expression of NF-κB and IL-8 downstream of TLR8

Ctrl:未加R848组;R848:加R848组;cTLR8-pcDNA3.1+:转染了cTLR8-pcDNA3.1+表达载体的细胞;dTLR8-pcDNA3.1+:转染了dTLR8-pcDNA3.1+表达载体的细胞.图8 转染牛/瓶鼻海豚TLR8的HEK293细胞刺激后下游蛋白的相对表达量Fig.8 The relative expression of downstream proteins of the HEK293 transfected with Bos taurus/Tursiops truncatus TLR8 after stimulation
2.6 Western blot检测R848刺激对TLR8下游通路NF-κB和IL-8蛋白的影响
本研究使用R848对转染细胞进行刺激,提取细胞内蛋白后使用Western blot检测对照组和实验组中TLR8、NF-κB和IL-8的含量变化. 结果如图8所示,在受到R848刺激后,转染了牛或瓶鼻海豚TLR8基因的一组较对照组相比,其下游基因NF-κB和IL-8的表达量有了较为明显的上升.同时,与瓶鼻海豚TLR8转染组相比,牛TLR8转染组刺激后表达量的增加更为显著. 由此可见,R848对于HEK293细胞的刺激能在一定程度上增加TLR8及其下游基因NF-κB和IL-8的表达量.
3 结论
一般研究认为,TLRs基因家族高度保守,基因中任一氨基酸位点的替代、缺失都可能影响其功能,从而失去对某些病原微生物的免疫应答[20]. Mukherjee等[21]和Barreiro等[22]的研究均表明TLRs在进化中发生了纯化选择,然而最近的一些生物信息学分析发现鲸类TLR4在由陆地向海洋迁移的过程中发生了适应性进化[23],也在鲸类TLR8中检测到了位于胞外结构域的正选择信号[19]. 本研究对瓶鼻海豚与牛TLR8基因的蛋白结构分析发现,两个物种胞内域的TIR结构域高度相似,因为其主要负责细胞内的信号传递,相对保守[24];相比之下,胞外域表现出更明显的分化,存在一系列的氨基酸替换、插入和缺失位点. 这可能是由于胞外域参与识别不同病原微生物的PAMP[25],而鲸类在二次入水过程中面临的病原体差异相应的介导了胞外域LRRs的进化[18]. 在本实验中,发现牛和瓶鼻海豚相比,第三个LRR序列的位置有一定差异. LRR3能够帮助TLR8识别富含AU的特异性配体ORN[26],其在灵长目中高度保守,在牛和啮齿目等物种中检测到相似的氨基酸插入和缺失. 和啮齿目相反,牛LRR3的变异不影响ORN直接识别、活化TLR8通路[26]. 然而,瓶鼻海豚与牛TLR8的氨基酸和LRR3的差异对免疫功能的影响有待进一步实验验证.
TLR8基因作为Toll样受体家族成员,参与先天免疫的应答. Zhou和 Hackstein等关于人TLR8基因的研究发现,R848的刺激能够活化TLR7/8的MyD88信号通路,促进合成下游细胞因子,引起免疫应答[27-28]. 此外,有研究发现R848的刺激也能够激活猪、牛等哺乳动物的TLR8基因[29]. 但是,R848的单独刺激却无法激活大鼠等啮齿目的TLR8基因[29-31]. 对于鲸类这种二次入水的哺乳动物,TLR8基因的免疫应答功能尚未见报道. 本研究选用瓶鼻海豚代表鲸类,选用牛代表鲸类的陆生近缘哺乳动物,在细胞和蛋白水平上检测TLR8下游通路NF-κB和IL-8的表达情况. 结果显示,转染了牛和瓶鼻海豚TLR8基因的两组细胞较对照组相比,其下游蛋白NF-κB和IL-8的表达量有了较为明显的上升. 因此,本研究认为瓶鼻海豚TLR8基因能够通过激活下游信号通路,促进合成NF-κB和IL-8等细胞因子,进而引起细胞免疫应答. 此外,牛R848刺激组表达量的提升比瓶鼻海豚组的提升更为显著. Liu等[29]使用R848分别刺激转染了数种陆生哺乳动物TLR8基因的细胞,结果显示和牛相比,刺激后人、猪和绵羊TLR8的下游蛋白NF-κB的表达量均显著提升,而猫、马的表达量则和牛相似. 因此,本研究认为瓶鼻海豚TLR8基因对R848的敏感性可能低于包括牛在内的大部分陆生哺乳动物.
鲸类从陆地重返海洋后,面临着截然不同的生活环境,如温度、盐碱度、病原体和渗透压等,给鲸类带来了巨大的挑战[32-33]. 海洋中的病毒数量达到了数十亿每升,病毒种类也极其多样,但其中大部分为噬菌体或植物病毒等较难引起鲸类免疫应答反应的病原体[34-38]. 此外,海洋哺乳动物的种类和数量相较于陆生哺乳动物而言要少的多,这在一定程度上限制了部分病原微生物的传播范围和传播速度. 以上各种原因,导致鲸类TLR8基因在海洋环境中发生了适应性进化,从而影响了其蛋白结构和免疫应答功能. Tian[9]等的研究发现,瓶鼻海豚和牛的TLR4对陆地细菌的反应存在物种特异性,且牛的TLR4反应更强烈,这和本研究的结论相似. 综上所述,和牛或其他陆生哺乳动物相比,瓶鼻海豚TLR8基因对R848的敏感性较低,推测可能是海洋和陆地生态系统之间连通和传播方式的差异导致了海洋和陆生哺乳动物TLR8基因的差异进化,这也符合 Nakajima[24]等提出的宿主-病原体共进化的“军备竞赛”理论.

