携载Ce6核壳纳米粒的双模态成像及光热治疗研究
卢佳慧,朱熹,黄天濠,刘雅文,倪晨,庄银苹,时梅林,胡俊峰
乳腺癌是女性最常见且致死率高的恶性肿瘤之一,发病具有年轻化的趋势,起病隐匿的特征使得部分患者确诊时已是癌症中晚期,错过了最佳的手术保乳时机。为了更好地控制病情的进展,早期诊断和及时治疗对乳腺癌患者具有重要的临床意义[1,2]。分子影像对病变的检测具有极高的敏感性,可在分子或细胞层面检测到肿瘤的发生和发展。目前,能否构建出新型分子探针,实现在细胞层面上对乳腺癌发生发展的可视化检测,并对早期治疗进行指导,是当前分子影像学在乳腺癌的诊疗中亟待解决的热点问题[3]。活体MRI不受组织深度的影响,可以较好地观察组织器官的内部结构,适用于绝大多数肿瘤的成像。活体荧光成像由于荧光穿透深度有限,主要应用于表浅性肿瘤的成像。光热治疗则是凭借光热转换剂可在近红外激光下吸收能量并转换为热能的性能,通过提高局部温度来杀伤癌细胞的一种肿瘤治疗策略,具有侵入性小、选择性高以及可控性强的优点[4]。但其穿透深度不足,因此主要适用于表浅肿瘤(如乳腺癌,黑色素瘤等)的早期治疗。乳腺癌属于表浅性肿瘤,在实现活体荧光成像及光热治疗上具有独特的优势。
本研究拟构建一种新型诊疗纳米粒子--介孔二氧化硅(mesoporous silicon,MSN)-聚多巴胺(polydopamine,PDA)核壳纳米粒子(MSN-Ce6@PDA-Gd nanoparticles,MSN-Ce6@PDA-Gd NPs),以实现乳腺癌的分子影像及光热治疗。此新型纳米粒子所借助的核壳纳米载体介孔二氧化硅-聚多巴胺具有生物相容性好、负载能力强的优点,既可稳定递送荧光成像剂二氢卟吩e6(chlorine e6,Ce6),亦具有能进行磁共振T1WI的钆离子(Gd),并凭借聚多巴胺具有光吸收和热转换的性能。本研究中对此新型诊疗纳米粒子在体内、外行磁共振-荧光双模态成像的潜能以及介导光热治疗乳腺癌的效能进行了探讨。
材料与方法
1.实验材料
主要试剂中十六烷基三甲基溴化铵(cetyltrimethylammoniumchloride,CTAC)、氯化钠、三乙胺、环己烷、正硅酸四乙酯和甲醇,均购于国药集团化学试剂有限公司(中国);二氢卟吩e6购于Frontiersci公司(美国);盐酸多巴胺购于Aladdin公司;3-氨基丙基三乙氧基硅烷和氯化钆(GdCl3·6H2O)购于Sigma-Aldrich公司(美国)。
试验设备和材料:德国Sigma 3-30KS离心机;美国DMI3000B透射电子显微镜;英国Nano ZS90马尔文粒径分析仪;UH4150紫外可见分光光度计;德国Leica倒置荧光显微镜;美国Biotek酶标仪;GE Discovery 750W 3.0T磁共振仪和GE AW4.6后处理工作站;PSU-Ⅲ型激光器;美国Fotric红外热成像仪;美国Bio-Rad荧光成像系统。
实验动物:雌性健康无特定病原体级昆明小鼠6只(鼠龄6周)以及雌性BALA/C裸鼠6只(鼠龄6周),均购于徐州医科大学动物实验中心。动物实验均严格按照徐州医科大学实验动物伦理道德管理委员会的规定进行。
2.药物制备和性能检测
氨基化介孔二氧化硅(aminated mesoporous silicon,MSN-NH2)的制备参考Dai等[5]的方法并进行了改良,具体步骤:(1)将26 mL纯水、20 mL百分比浓度为25%的CTAC及250 μL三乙胺溶液倒入圆底烧瓶中,置于70℃水浴中反应1 h,再加入20 mL环己烷与正硅酸乙酯的混合液后继续反应24 h后,使用百分比浓度为1%的氯化钠-无水甲醇溶液进行脱模板,得到介孔二氧化硅。(2)采用甲苯回流法进一步制备氨基化MSN。称取150 mg MSN粉末置于烧瓶中,并加入10 mL无水甲苯,待水浴温度达到70℃后,加入15 μL的3-氨基丙基三乙氧基硅烷,在氮气氛围下继续反应4 h。收集所得混合液进行离心洗涤,并冷冻干燥以备用。
MSN-Ce6@PDA-Gd NPs的制备:将1.0 mL Ce6溶液(3.0 g/L)分别加入不同质量(3.0、4.5、6.0、7.5和9.0 mg)的MSN-NH2中,室温下搅拌一夜,所得混合液进行充分的离心洗涤,直至上清液接近无色,再向沉淀中加入2.5 mL盐酸多巴胺溶液(10.0 g/L,Tris-HCl缓冲液)搅拌6 h,随后加入2.5 mL GdCl3·6H2O溶液(10.0 g/L)继续搅拌4 h。最后将此混合液进行3次高速离心洗涤(离心半径65 mm,20 min,14100 rpm),即可得到MSN-Ce6@PDA-Gd NPs。全程避光操作。
使用透射电子显微镜及Nano ZS90仪器测量所制备纳米材料的形貌、粒径和表面电位;使用紫外可见分光光度计检测MSN与Ce6不同配比的上清液的吸收光谱,以计算Ce6的包封率和负载量;使用荧光发射光谱检验所制备MSN-Ce6的荧光强度;使用红外热成像仪监测MSN-Ce6@PDA-Gd NPs在808nm激光照射下的升温情况;使用酶标仪检测各种处理下MSN的吸光度。
3.细胞毒性实验
采用细胞增殖及细胞毒性检测(cell proliferation and cytotoxicity test,MTT)分析此纳米诊疗剂对小鼠胚胎成纤维细胞(NIH-3T3)和人乳腺癌细胞(MDA-MB-231)活性的影响。以5×103个细胞/孔的密度接种于96孔板,培养至细胞生长面积达到80%左右,然后分别加入含不同浓度(0.0、12.5、25.0、50.0、100.0、150.0和200.0 mg/L)MSN-Ce6@PDA-Gd NPs溶液的新鲜培养基(每组设置6个复孔,使每孔最终体积为100 μL)孵育24 h。使用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗3遍后,每孔加入100 μL新鲜培养液以及20 μL噻唑蓝MTT溶液(5.0 g/L),孵育4 h后弃上清。每孔再加入100 μL二甲亚砜溶液,并放入恒温摇床振荡15 min。最后使用多功能酶标仪检测490 nm波长处各孔的吸光度,并计算相对细胞存活率。
4.MRI和荧光成像性能离体检测
MRI性能检测:配置含不同Gd浓度(0、0.0106、0.0408、0.3260、0.4091、0.5168和0.9438 mmol/L)的MSN-Ce6@PDA-Gd NPs水溶液,每种浓度的溶液各取500 μL注于0.5 mL的离心管中,以纯水为对照组,使用3.0T MR扫描仪进行扫描,通过采集T1弛豫时间并计算T1弛豫率,来观察其MRI性能。为进一步检测此纳米材料与细胞结合后的T1WI效果,将人乳腺癌细胞MDA-MB-231以1×105个细胞/孔的种植密度接种于6孔板内,然后放于37℃细胞培养箱中进行培养,待细胞生长面积达到80%左右,弃去培养基并对6孔板内的细胞使用PBS洗涤两次,然后吸出PBS,再向6孔板内分别加入2 mL不同浓度MSN-Ce6@PDA-Gd NPs溶液(0.0、50.0、100.0和200.0 mg/L)与细胞孵育3 h,对照组加入相同体积的PBS与细胞孵育3 h。使用胰酶将贴壁的人乳腺癌细胞MDA-MB-231进行消化,并将得到的悬浮细胞收集至离心管内,经离心(离心半径76 cm,5 min,3000 rpm)后使细胞沉积于管底,经细胞摄入的MSN-Ce6@PDA-Gd NPs也会沉入管底,向每个离心管内加入等体积的PBS后行MRI冠状面扫描。扫描参数:TR 425 ms,TE 14.0 ms;视野18 cm×18 cm,层厚3.0 cm。
荧光成像性能检测:以4×104个细胞/孔的密度接种在6孔板的盖玻片上,过夜孵育使细胞贴壁,随后向含有细胞的6孔板内分别加入含不同Ce6浓度MSN-Ce6@PDA-Gd NPs(0,4,8,16 mg/L)的培养基,并共同孵育4h。依次进行PBS漂洗、4%多聚甲醛固定细胞、细胞核染料4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)复染以及再次PBS漂洗等步骤。最后使用倒置荧光显微镜进行成像(×20)。Ce6的激发波长为400 nm,发射波长为665 nm,DAPI的激发波长为358 nm,发射波长为461 nm。
5.光热性能和光热治疗效果检测
配置不同浓度(0.0、50.0、100.0、150.0和200.0 mg/L)的MSN-Ce6@PDA-Gd NPs溶液,吸取1.0 mL于石英比色皿中,使用808 nm激光以1.5W/cm2的强度照射10 min,在红外热成像仪监测下每30 s记录一次温度值,并绘制升温曲线。
为了进一步探究此纳米材料对人乳腺癌细胞的光热治疗效果,以5×103个细胞/孔的密度接种MDA-MB-231细胞于96孔板内,培养至细胞生长面积达到80%左右,向96孔板内加入不同浓度(0.0、12.5、25.0、50.0、100.0、150.0和200.0 mg/L)MSN-Ce6@PDA-Gd NPs溶液后孵育4 h。换液后非激光组直接放入恒温培养箱,激光组采用808 nm以1.5W/cm2的强度照射3 min后放入恒温培养箱,后续步骤同细胞毒性实验。最后,使用多功能酶标仪检测490 nm波长处各孔的吸光度,计算相对细胞存活率以评估光热治疗(photothermal therapy,PTT)的疗效。
6.体内生物相容性分析
选取雌性健康无特定病原体级的昆明小鼠6只,鼠龄6周,体质量(32±2) g。对照组(n=3)不进行处理,实验组(n=3)注射MSN-Ce6@PDA-Gd NPs溶液。根据昆明小鼠血容量为体重的6%~7%计算,其血容量约为2.0 mL。为保证纳米材料在小鼠血液循环中能保持200 mg/L的浓度,因此经昆明小鼠尾静脉注射MSN-Ce6@PDA-Gd NPs的剂量为20 mg/kg。在注射后第21天经解剖获得小鼠的心、肝、脾、肺和肾脏标本,经过固定后使用苏木精-伊红染色法制作病理切片,在显微镜下观察各器官的组织结构。
7.体内代谢途径及半衰期
将MSN-Ce6@PDA-Gd NPs(20 mg/kg,200 μL)经尾静脉注射入3只乳腺癌荷瘤裸鼠体内,在注射后的不同时间点(0、2、6和12 h)采集裸鼠的全身磁共振图像,观察此纳米材料的代谢途径。MRI检查扫描参数:冠状面GRE T1WI,TR 11.2 ms,TE 3 ms,TI 28.0 ms,层厚1.0 mm,层间距0.5 mm。此外,在注射后不同时间点(0.25、0.50、1.00、2.00、4.00、6.00和12.00 h)对荷瘤裸鼠经尾静脉取血,将血液与浓硝酸以体积比1/10的比例进行充分混合,采用电感耦合等离子体质谱仪检测的方法ICP-MS法对血液样品中钆离子的含量进行检测,计算Gd在体内的半衰期。
8.在体MRI及荧光成像性能
将人乳腺癌细胞(MDA-MB-231)悬液注射到BALB/C雌性裸鼠的右侧腋背部皮下软组织内,待乳腺癌皮下移植瘤长出,即成功建立荷瘤裸鼠模型。取生长状态良好、肿瘤大小接近的两只荷瘤裸鼠。在注射MSN-Ce6@PDA-Gd NPs(剂量20 mg/kg)前、后的四个时间点(0)分别对荷瘤裸鼠的肿瘤区域进行MRI和荧光成像,观察肿瘤的成像情况。MRI扫描参数:冠状面GRE T1WI,TR 11.2 ms,TE 3 ms,TI 28.0 ms,层厚1.0 mm,层间距0.5 mm。荧光成像时每帧图片的曝光时间为白光50 ms、绿光150 ms。
9.在体光热治疗效能
将建立成功(荷瘤裸鼠腋下肿瘤生长至直径约5 mm)的6只荷瘤裸鼠模型随机分为2组,每组3个样本。对实验组和对照组荷瘤裸鼠分别经尾静脉注射MSN-Ce6@PDA-Gd NPs(20 mg/kg)和200 μL生理盐水。待肿瘤体积达到50 mm3时对实验组荷瘤裸鼠进行治疗。经尾静脉注射MSN-Ce6@PDA-Gd NPs后2 h进行激光照射(波长808 nm,强度1.5W/cm2,时间10 min),每三天治疗一次,治疗期为两周,在治疗前和治疗结束后两个时间点使用相机和磁共振扫描仪进行检查。对照组的荷瘤裸鼠不进行治疗。
10.统计学分析
使用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1.理化性能表征
透射电镜图显示MSN-NH2具有明显的介孔结构,且孔径和大小均一。MSN-Ce6@PDA-Gd NPs亦呈圆形,介孔结构模糊,表面较为光滑(图1a),提示材料合成成功。Zeta电位监测结果显示MSN-NH2的Zeta电位值为正值,而经过制备的MSN-Ce6@PDA-Gd NPs的Zeta电位值已成功变为负值,测量值为(-16.03±0.12) mV(图1b)。经马尔文粒径检测结果,MSN-NH2和MSN-Ce6@PDA-Gd NPs的水合粒径分别为(122.03±0.21)和(142.10±0.29) nm(图1c)。根据离心所得上清液的紫外吸收光谱测量结果,发现MSN-NH2与Ce6的质量比为2.5时,Ce6的包封率(53.58%)和负载量(17.65%)较好(图1d),因此最终选择该配比制备纳米材料来进行后续的实验。

图1 MSN-Ce6@PDA-Gd NPs的表征。a)MSN-Ce6@PDA-Gd NPs和MSN-NH2(左下)的透射电镜图;b)MSN-NH2和MSN-Ce6@PDA-Gd NPs的电位图;c)MSN-NH2和MSN-Ce6@PDA-Gd NPs的粒径-光强度分布曲线;d)不同质量比的MSN-NH2与Ce6混合液离心所得上清液的紫外吸收光谱图,显示不同质量比得到的产物在404、505和660nm的吸光度峰值均不同。 图2 两种类型肿瘤细胞与不同浓度MSN-Ce6@PDA-Gd NPs溶液共同孵育后细胞毒性实验结果,在0~200mg/L的浓度范围内细胞存活率均在90%以上。
2.细胞毒性实验
MTT实验结果显示,小鼠胚胎成纤维细胞NIH-3T3及人乳腺癌细胞MDA-MB-231与不同浓度(0.0、12.5、25.0、50.0、100.0、150.0和200.0 mg/L)的MSN-Ce6@PDA-Gd NPs溶液孵育后,细胞存活率均在90%以上(图2),总体差异均无统计学意义(FNIH-3T3=2.317,P>0.05;FMDA-MB-231=2.344,P>0.05)。
3.MRI和荧光成像性能
MRI性能检测:在MR T1WI上,PBS对照组在T1WI上呈低信号;实验组中,随着纳米材料中Gd浓度的升高(0、0.0106、0.0408、0.3260、0.4091、0.5168和0.9438 mmol/L),在T1WI上信号呈逐渐增高的趋势,在相应的T1值伪彩图上表现为由绿色逐渐变为蓝色,提示T1值逐渐减小(图3a);对应的T1弛豫时间测量结果依次为(2115.83±0.60)、(232.24±1.01)、(203.57±0.46)、(175.53±0.46)、(113.97±0.33)、(89.10±0.16)和(69.07±0.35) ms。相关性分析结果见图3b,显示Gd浓度与T1值的倒数呈良好的线性正相关关系(R2=0.9984)。不同浓度的纳米诊疗剂与人乳腺癌细胞MDA-MB-231结合后经离心而沉积于EP管底部,在冠状面T1WI上可见随着纳米诊疗剂浓度的增加(0~200 mg/L),离心管底部的信号强度逐渐增高,在T1-rainbow伪彩图上离心管底部的颜色由蓝色过度到绿色、最后至红色(图3c),表明沉积细胞的T1值逐渐减小。结果表明MSN-Ce6@PDA-Gd NPs具有良好的T1加权成像能力。

图3 MRI性能检测结果。a) 不同Gd浓度MSN-Ce6@PDA-Gd NPs的MR T1WI图像及T1-mapping伪彩图; b) Gd浓度与1/T1值的相关性分析点线图,显示两者间呈良好的线性相关关系; c) 不同浓度MSN-Ce6@PDA-Gd NPs溶液与MDA-MB-231细胞孵育后置入离心管内后的T1WI图像及T1-rainbow伪彩图,显示随着纳米材料的浓度增加,在T1WI上信号强度逐渐增加,而T1值逐渐减小(在T1-rainbow伪彩图上的颜色依次为蓝色-绿色-红色)。
荧光成像性能表征:采用倒置荧光显微镜观察MDA-MB-231细胞与纳米诊疗剂的结合情况,由于DAPI是一种能与DNA强力结合的荧光染料,与细胞中的DNA结合后显示为蓝色荧光,因此DAPI通道中显示的蓝色荧光为细胞核区域;由于Ce6的可在荧光激发下显示为红色荧光,因此Ce6通道中显示的红色荧光反映了MSN-Ce6@PDA-Gd NPs在细胞内的分布;Merge通道中显示的是蓝色荧光和红色荧光的融合,可观察MSN-Ce6@PDA-Gd NPs在细胞内的分布情况。本研究中发现PBS组中仅观察到蓝色荧光,无红色荧光;以PBS为对照组,将细胞悬液加入含不同Ce6浓度(4、8和16 mg/L)的MSN-Ce6@PDA-GdNPs溶液(依次简称为NP-4、NP-8和NP-16组)的培养基中孵育4 h后,细胞悬液中则观察到明显的红色荧光,且随着Ce6浓度的增加在显微镜图像上的荧光亮度逐渐提高(图4)。使用Image J软件进行单个细胞平均荧光强度的半定量分析,结果显示NP-4、NP-8和NP-16这3组的单个细胞平均荧光强度值分别为54.47±1.14、65.35±0.99和103.87±1.07,3组间的差异有统计学意义(F=4298.203,P<0.001);NP-4和NP-8组分别与NP-16组比较,差异均有统计学意义(t=44.679,P<0.001;t=37.294,P<0.001)。上述结果表明人乳腺癌细胞(MDA-MB-231)对MSN-Ce6@PDA-Gd NPs的摄入具有浓度依赖性,当其内Ce6的浓度为16 mg/L时乳腺癌细胞具有较好的荧光显像效果。
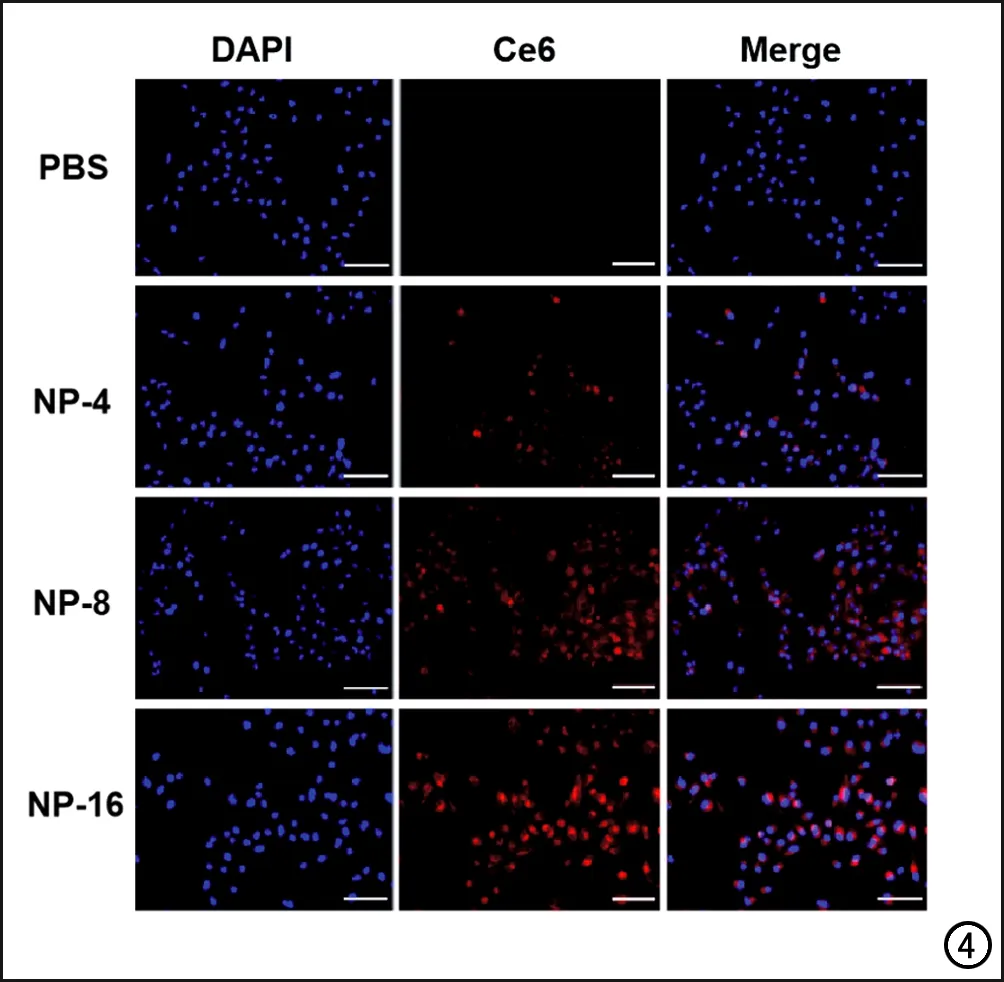
图4 倒置荧光显微镜检测MDA-MB-231细胞对纳米诊疗剂的摄取情况(标尺长度代表100nm,×20)。含有PBS溶液及含有不同Ce6浓度(4、8、16mg/L)MSN-Ce6@PDA-Gd NPs溶液的培养基与人乳腺癌细胞(MDA-MB-231细胞)共同孵育后,荧光显微镜下DAPI通道可见细胞核区域呈蓝色荧光;Ce6通道可观察到,相较于对照组(PBS组),实验组随着Ce6浓度浓度的增加(NP-4、NP-8和NP-16),红色荧光的亮度逐渐增强;Merge通道可见红色与蓝色区域不重叠,表明MSN-Ce6@PDA-Gd NPs不进入细胞核。
4.光热性能和光热治疗效果
本实验结果显示,随着激光照射时间的增加,MSN-Ce6@PDA-Gd NPs溶液的温度逐渐升高并趋于平衡(图5a)。在808 nm激光辐照(1.5W/cm2,)10 min后,150 mg/L组溶液温度可达到43.7℃,200 mg/L组溶液温度可高达51.5℃。细胞光热治疗作用的实验结果显示:在激光辐照组中,当纳米材料的浓度为0.0、12.5、25.0、50.0、100.0、150.0和200.0 mg/时,细胞存活率分别为100.83%±4.68%、95.51%±2.30%、92.07%±1.15%、89.18%±1.08%、68.74%±0.57%、43.83%±2.22%和23.07%±1.41%,总体差异有统计学意义(F=793.216,P<0.001)。无激光辐照组中各浓度(0~200 mg/L)的纳米材料以及激光辐照组中纳米材料的浓度为0~50 mg/L时,细胞存活率较高;而在激光辐照组中当纳米材料的浓度达100~200 mg/L时,细胞存活率显著降低(图5b)。
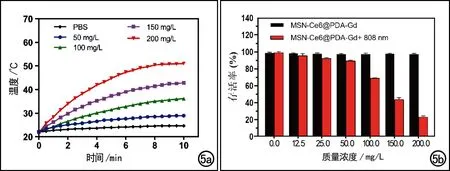
图5 MSN-Ce6@PDA-Gd NPs的光热效能。a)PBS溶液以及不同浓度MSN-Ce6@PDA-Gd NPs溶液在激光照射下(808 nm,1.5W/cm2,10 min)的升温曲线;b)不同浓度MSN-Ce6@PDA-Gd NPs溶液在有或无激光处理后的细胞存活率条形图。
5.纳米材料在体内的生物相容性
21天后的苏木精-伊红染色后的组织切片结果显示,与空白对照组比较,MSN-Ce6@PDA-Gd NPs组的昆明小鼠体内脏器(心、肝、肾脏、肺和脾)无明显异常(图6)。表明该核壳纳米诊疗剂具有良好的体内生物相容性。

图6 各脏器的组织病理图(×400,HE)。图a~e依次为对照组中小鼠的心、肝、肾脏、肺和脾脏标本的病理图,图f~j依次为实验组在注射MSN-Ce6@PDA-Gd NPs溶液21天时小鼠的心、肝、肾脏、肺和脾脏标本的病理图。两组小鼠的心肌组织均显示肌纤维正常分布,细胞横纹清晰,间质细胞正常,胞核完整,无炎症细胞浸润现象;两组小鼠的肝脏组织均显示肝细胞索间界限清晰,胞浆界限明显,肝细胞以中央静脉为中心向周围放射状排列;两组小鼠的肾脏组织均显示胞核完整,细胞核清晰可见,胞质和胞浆对比鲜明;两组小鼠的脾脏细胞结构均显示清晰,红髓和白髓界限较明显。
6.体内代谢途径及半衰期
荷瘤裸鼠在注射MSN-Ce6@PDA-Gd NPs后,增强早期在MR T1WI上即可见肝脏有较明显强化,随着时间推移,强化程度逐渐减低,12 h后肝脏信号强度恢复至注射前(图7)。提示MSN-Ce6@PDA-Gd NPs通过肝脏进行排泄。此外,以荷瘤裸鼠注射MSN-Ce6@PDA-Gd NPs后的取血时间为横坐标,以电感耦合等离子体质谱仪测得的血液样品中的Gd浓度为纵坐标进行绘图及计算,获得其代谢曲线(图8),结果显示此纳米材料中Gd的血液半衰期约为2.03 h。
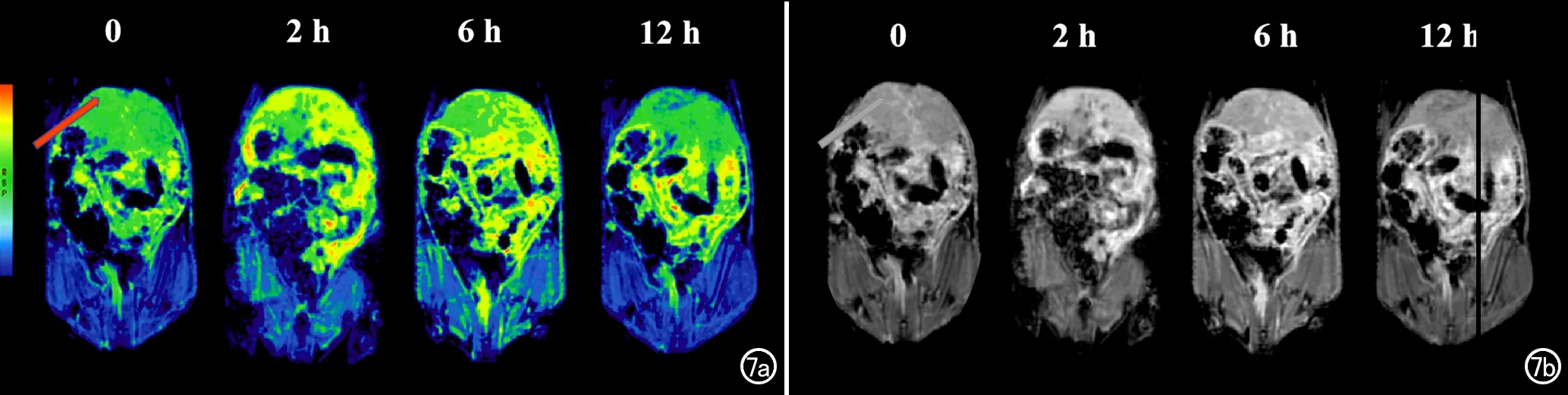
图7 荷瘤裸鼠在注射MSN-Ce6@PDA-Gd NPs溶液前、后4个时间点的MRI图像。a)T1- rainbow伪彩图显示肝脏(箭)在0 h时呈绿色。注射后2 h黄色区域增加,6h时黄色区域较前减少,12 h时恢复至绿色,由于rainbow伪彩图上的颜色蓝色-绿色-黄色-红色代表T1值逐渐由高到低,因此结果表明肝脏区域的T1值先减小,6 h后增加,再至12 h恢复至接近初始水平;b)T1WI显示注射后2 h肝脏区域的信号强度增高,6 h时肝脏的信号强度减弱,在12 h时肝脏的信号强度恢复至与0 h时接近。
7.在体磁共振及荧光成像性能
在获得较好的体外成像效果后,我们进一步评估了MSN-Ce6@PDA-Gd NPs活体成像效果。荷瘤裸鼠的在体MRI和荧光成像检查显示,注射此纳米诊疗剂后肿瘤区域有明显强化(图9a)和明显的荧光强化(图9b)。在体成像结果表明MSN-Ce6@PDA-Gd NPs可实现对乳腺癌病灶的在体MR和荧光双模态成像。

图8 血液内Gd离子浓度-时间曲线,Gd离子浓度在体内的半衰期为2.03±0.31 。 图9 荷瘤裸鼠在体MRI及荧光成像。a)MR T1WI显示注射纳米诊疗剂后肿瘤组织有明显强化(箭);b)荧光成像图(显示注射纳米诊疗剂后肿瘤组织有明显荧光强化(箭)。 图10 MSN-Ce6@PDA-Gd NPs的光热治疗性能检测。图a~d为对照组(注射生理盐水)图像,图e~h为实验组(注射MSN-Ce6@PDA-Gd NPs)图像。a)治疗前对照组裸鼠照片;b)激光辐照治疗结束后对照组裸鼠照片,显示皮下肿瘤(箭)较前明显增大;c)治疗前对照组裸鼠MR T1WI;d)激光辐照治疗后对照组裸鼠T1WI,显示肿瘤(箭)较治疗前明显增大;e)治疗前实验组裸鼠照片;f)治疗后实验组裸鼠照片,显示皮下肿瘤(箭)较前明显减小;g)治疗前实验组裸鼠MR T1WI;h)激光辐照治疗后实验组裸鼠T1WI,显示瘤体(箭)较前明显减小。
8.在体光热治疗效能
在治疗前及激光辐照治疗两周后进行在体光热治疗效能的评估。裸鼠照片及MR图像显示,对照组中裸鼠皮下的肿瘤组织明显大于未治疗时(图10a);而注射MSN-Ce6@PDA-Gd NPs结合808 nm激光组裸鼠的肿瘤在治疗后小于治疗前的大小,且该组瘤体的大小明显小于对照组(图10b)。本组结果表明了MSN-Ce6@PDA-Gd NPs+808 nm激光能实现有效的乳腺癌在体光热治疗。
讨 论
分子影像中MRI和荧光成像双模态成像技术兼具MRI的空间分辨率高、不受组织深度影响以及荧光成像的时间分辨率高、可实时成像的优点,可作为乳腺癌早期诊断的有效手段[6-7]。第二代光敏剂二氢卟吩e6(chlorine e6,Ce6)具有光稳定性好,成像性能佳的优点,其激发光为红色荧光,可有效区别生物体的黄绿色背景荧光,是一种性能优异的荧光成像剂[8]。但强疏水性使Ce6易发生团聚,进而将显著影响其在肿瘤细胞中的摄取[9]。本研究中采用负载潜能高的介孔二氧化硅为载体,并与亲水性能良好的聚多巴胺涂层联合使用,以提高对疏水性光敏剂Ce6的负载性能。值得一提的是,本研究所使用的聚多巴胺涂层,是金属离子(如钆离子﹑锰离子和铁离子)的强配位体,故具有成为MRI对比剂的潜能[10],还具备近红外光吸收和光热转换能力,是一种有效的光热治疗剂。因此,本研究中所构建出的多功能纳米体系可具有磁共振和荧光成像能力及光热治疗效能。
人乳腺癌细胞MDA-MB-231属于高转移性恶性乳腺癌细胞系,呈贴壁生长,其形态为上皮细胞样,是研究乳腺癌转移的经典模型细胞系[11]。因此,本研究中使用该细胞系用于后续的研究。细胞毒性结果显示,当MSN-Ce6@PDA-Gd NPs的浓度为0~200 mg/L时,小鼠胚胎成纤维细胞NIH-3T3和人乳腺癌细胞MDA-MB-231的相对存活率均维持在90%以上。相较于Dong等[12]制备的锰配位聚多巴胺溶液的细胞存活浓度范围(0~80 mg/L),以及Yang等[13]制备的介孔硅装载二氢卟吩e6的细胞存活浓度范围(0~200 mg/L),本研究中制备的MSN-Ce6@PDA-Gd NPs的细胞毒性较低。此外,与空白对照组比较,此纳米材料经昆明小鼠尾静脉注射后21天的病理切片可观察到,所有被检器官均无明显的器质性病变﹑炎症和其它异常。
本次研究中对MSN-Ce6@PDA-Gd NPs的磁共振成像和荧光成像性能进行了分析,结果显示此纳米材料在体外具有明显的磁共振成像效果,纵向弛豫率为9.845 mM-1s-1,是临床上常规使用的MRI对比剂钆喷酸葡胺的纵向弛豫率(4.49 mM-1s-1)的2.36倍[14]。在细胞层面,未经此纳米材料处理的肿瘤细胞未见明显增强表现,而随着与肿瘤细胞共同孵育的MSN-Ce6@PDA-Gd NPs溶液的浓度逐渐增高(50.0、100.0和200.0 mg/L),肿瘤细胞沉积物在磁共振T1WI上信号强度逐渐增高。为了解较低浓度的纳米诊疗剂可否实现细胞荧光成像,我们在研究中将含有不同Ce6浓度(0、4、8和16 mg/L)的MSN-Ce6@PDA-Gd NPs溶液与人乳腺癌细胞MDA-MB-231一起孵育,发现随着浓度的增加,孵育细胞表现出逐渐增强的红色荧光,16 mg/mL浓度组的细胞荧光强度可实现较好的荧光成像效果。根据负载量计算,Ce6的浓度为4、8和16 mg/L时对应的MSN-Ce6@PDA-Gd NPs的浓度分别为22.66、45.33和90.65 mg/L。由此可见,浓度为90.65 mg/L的MSN-Ce6@PDA-Gd NPs溶液对乳腺癌细胞即可具有良好的荧光成像能力。对乳腺癌荷瘤裸鼠的在体MRI和荧光成像结果显示,MSN-Ce6@PDA-Gd NPs可实现对乳腺癌的双模态成像。此外,MSN-Ce6@PDA-Gd NPs中的Gd离子在荷瘤裸鼠血液内的半衰期约为2.03 h,与临床常用的磁共振对比剂钆喷酸葡胺相比,半衰期明显增加,为实现光热治疗作用提供了基础[15-16]。
本研究中还发现,MSN-Ce6@PDA-Gd NPs表现出良好的升温效果。将1.0 mL的MSN-Ce6@PDA-Gd NPs溶液(200 mg/L)经尾静脉注入荷瘤裸鼠体内,注射2 h后对肿瘤组织使用808 nm激光辐照(1.5W/cm2)10 min,肿瘤组织的局部温度可升高至51.5℃,显著高于光热消融肿瘤的温度标准(43℃)。此外,经该浓度的纳米材料处理的乳腺癌细胞MDA-MB-231,相较于无激光辐照组,激光辐照组中的细胞存活率更低。乳腺癌荷瘤裸鼠的在体实验结果也表明MSN-Ce6@PDA-Gd NPs可实现有效的肿瘤治疗效果。
综上所述,本研究成功构建了基于介孔硅-聚多巴胺的核壳结构的纳米诊疗剂MSN-Ce6@PDA-Gd NPs,其具有磁共振和荧光双模态成像效果及光热治疗乳腺癌的效用,为实现乳腺癌的诊疗提供了新思路。
(利益冲突:所有作者均声明不存在利益冲突)。

