线粒体功能与肌少症的诊断
高玮男,李 杨,周昊函,胡晓青,王金成*
(1.吉林大学第二医院 骨科,吉林 长春130041;2.吉林大学基础医学院 a.生理学系;b.病理生理学系)
人类的衰老是一个复杂的生理过程,时间推移以及环境作用下引起的分子、细胞和机体结构与功能的随机改变。衰老过程中肌细胞中的肌纤维核和肌原纤维条纹消失,肌纤维数量减少,线粒体数量减少,肌球蛋白ATP酶活力下降等生理生化指标发生变化,临床上表现为肌力减退,骨骼肌总重量减少等,这些现象是进行性肌肉衰老的主要表征。因此,人们提出了肌肉衰老(muscle aging)这一医学新概念。
肌肉减少症(sarcopenia),简称肌少症[1]。老年原发性肌少症是导致跌倒、骨折、肢体残疾和死亡等事件发生的一个主要原因。虽然,已经发现肌少症伴随着骨骼肌结构、组成和生物学进程等骨骼肌功能的多方面损害,但是由于目前关于骨骼肌功能评价技术上的限制,还是以骨骼肌肌量,肌力和运动机能作为评价肌少症的主要依据,因此仍然需要我们从不同角度进一步研究肌少症的发病机制,从而研发出有助于诊断、治疗及预后判断等新的指标。
1 肌少症发病机制
目前认为,肌少症发病主要与炎症,运动过少,低蛋白摄入及加龄等因素有关[2-3]。比如:循环炎症因子IL-6等随着年龄的增长其水平会明显升高[4]。此外,性激素等促细胞合成代谢因子的减少以及长期的糖皮质激素治疗也会导致肌少症[5]。氧化应激、泛素蛋白酶体和自噬等分解细胞代谢系统的过度活化可能与非运动导致的肌少症的发生和发展有关[6]。此外,遗传因素、营养失调及神经元退变等也是导致肌少症的另外一些原因[7-8]。衰老肌肉的解剖和形态学改变见表1。
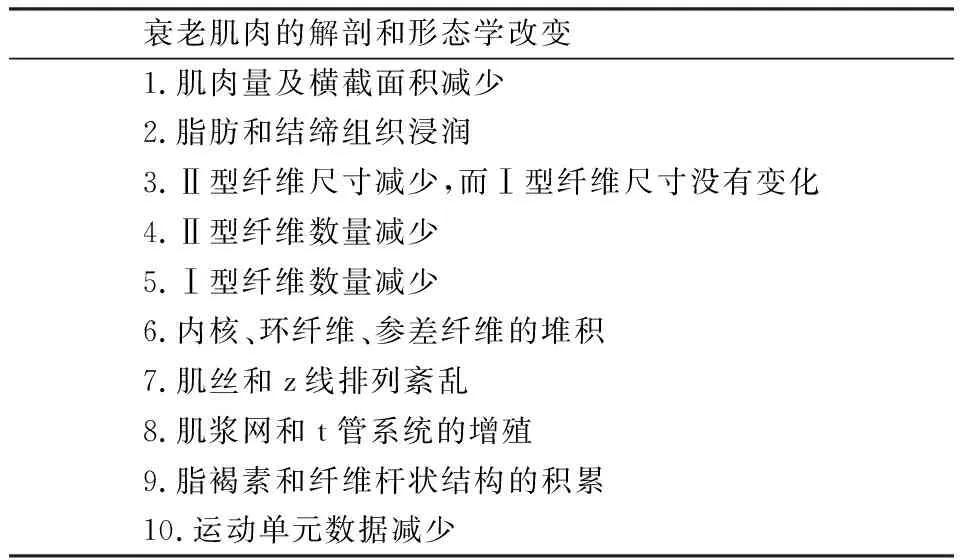
表1 衰老肌肉的解剖和形态学改变[9]
2 线粒体在肌少症发病中的角色
目前认为,肌细胞线粒体功能和结构紊乱在肌少症发病中发挥重要角色。骨骼肌具有高度集成的
线粒体系统,该系统通过控制线粒体生物合成来感知和协调身体活动、细胞外信号或胞内其他组分的变化[10]。
2.1 线粒体生物合成与肌少症
研究显示,老年人线粒体能量最大生成率下降与骨骼肌疲劳性增加呈显著负相关,且衰老肌肉线粒体含量显著下降,因此由能量缺乏导致的蛋白质合成下降是引起肌肉萎缩的主要原因之一[11]。研究发现过表达PGC1α上调了小鼠肌肉细胞线粒体生物合成,同时增加了Ⅰ型和Ⅱa型等氧化型肌纤维数量,增强了肌肉的抗疲劳性[12]。在老年动物[13]和老年人[14]的肌肉中也发现PGC1α的表达降低,提示增加肌肉中PGC1α介导的线粒体生物合成和蛋白质代谢,可为靶向治疗肌少症提供可能。
2.2 线粒体动力学与肌少症
线粒体动力学失调会导致衰老以及多种相关疾病的发生。为适应身体的需求,线粒体融合及分裂等形态学变化过程是确保线粒体功能的必要条件之一[15]。已有实验证明在衰老导致的肌少症发生过程中,肌肉细胞线粒体融合蛋白的表达降低,并且导致线粒体功能障碍,最终导致肌肉萎缩[16]。特异性敲除骨骼肌细胞融合蛋白或过表达肌细胞分裂蛋白,均可发现鼠肌肉细胞萎缩[17]。
2.3 线粒体自噬与肌少症
最近研究已经发现几种线粒体自噬关键基因的表达与年龄负相关[18]。通过肌肉特异性敲除Atg5/7来抑制自噬,会加剧与年龄相关的神经肌肉接头的退化[19],激活或抑制线粒体自噬相关基因均可不同程度上引起肌细胞损伤和肌肉萎缩。另外抑制PINK1和Parkin等线粒体自噬起始基因也会诱导线粒体功能障碍导致肌肉功能退变。
2.4 线粒体蛋白稳态与肌少症
线粒体蛋白稳态系统是维持线粒体功能抵抗轻度损伤的第一道防线[20]。包括肌少症在内的年龄相关的退行性疾病与蛋白质未折叠、错误折叠等密切相关[21]。蛋白质合成相关应激会激活细胞整合应激反应(ISR)[22],通过活化CHOP等细胞激酶调控蛋白翻译。有报道指出,在骨骼肌中mTOR信号能调控线粒体应激诱导的ISR[23];然而mTOR复合体调节CHOP/ATF4的表达机制尚不清楚。通过深入研究可能会从这些复杂的应激反应中发现新的肌少症诊断、治疗及预后判断的指标。
3 肌细胞融合的肌肉修复机制
肌肉纤维损伤时可激活卫星细胞,导致其分裂、增殖,形成“成肌细胞”,成肌细胞通过相互融合与多核肌管融合,扩大肌肉纤维,参与肌细胞结构和功能的修复。成肌细胞融合受特定信号通路调控,通过对肌细胞融合介导的肌肉修复机制的深入探讨,将会为开展肌少症诊断、治疗与功能判定提供新的切入点。
3.1 Ca2+-NFATc2信号通路
研究表明,成肌细胞融合受到钙依赖性信号传导的调节,并改变了细胞膜外形和细胞骨架的构建[24]。细胞内钙离子含量增加导致丝/苏氨酸钙调磷酸酶活化,磷酸化NFATc2使其入核调节基因转录[25]。NFATc2通过调节IL-4生成调控成肌细胞融合[26]。此外NFATc2还可通过调节成肌细胞融合必需的肌铁蛋白调控融合进程[27]。
3.2 NF-κb信号通路
研究表明,经典NF-κb信号传导会抑制肌原性分化,非经典NF-κB信号传导促进成肌细胞融合[28]。研究发现低血清孵育时cIAP1缺陷型小鼠成肌细胞融合能力更强,但成肌细胞生长抑制且分化标记物表达抑制[28]。这归因于cIAP1缺失同时激活了导致经典和非经典NF-κB通路,前者抑制成肌细胞分化,后者促进成肌细胞融合。因此需要深入探究明确NF-κB信号在骨骼肌发育和受损纤维再生中的作用。
3.3 Wnt信号通路
Wnt信号对于胚胎肌肉发育和产后肌生成都是必不可少的[29]。研究发现,仅用Wnt1进行转染就足以刺激成肌细胞的融合[30]。也有报道称,用另一种Wnt配体Wnt3a处理可增强C2C12成肌细胞融合[31],进一步表明经典Wnt信号传导可促进培养的成肌细胞融合。此外,非典型的Wnt信号在响应肌肉损伤时可被激活,并抑制成肌细胞融合[32]。
3.4 其他信号通路
成肌细胞融合还涉及许多其他信号分子的激活。激活Smad4蛋白发挥功能的经典TGF-β信号可抑制C2C12成肌细胞的增殖和融合[33],外源性FGF6蛋白治疗可部分挽救Smad4缺陷型原代成肌细胞的融合缺陷[34]。Dahlman发现在发育过程中,间质成纤维细胞中一氧化氮合酶的含量增加依赖NF-κB信号通路,从而刺激成肌细胞融合和肌肉肥大[35]。
4 总结
成肌细胞融合是一个高度复杂的网络,涉及细胞内外多重信号通路的协调。未来的研究应侧重于明确激活成肌细胞融合信号转导的胞外刺激物,鉴定下游调控融合相关的靶基因,以及各种肌肉变性疾病中相关途径的活化是否受到干扰。通过深入研究肌细胞线粒体的作用及其机制,尤其是结合成肌细胞融合信号通路调控因子表达,及其产物对细胞融合和细胞骨架重排调节分子的作用机制,可为肌少症的诊断、治疗、康复训练及功能评价等提供新的理论与实验依据。

