基于p54的非洲猪瘟抗体胶体金检测方法建立
戴建华,王豪伟,张紫菡
(江苏农牧科技职业学院,泰州 225300)
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的猪的一种烈性、高度接触性传染病,对全世界养殖业造成了严重威胁[1-2]。2018年8月起,疫情从沈阳暴发,并不断扩散、蔓延至全国,给全国造成了巨大经济损失,严重影响了养猪业的健康发展。及时的检测可有效降低经济损失。目前ASF的检测,主要有基因检测、病原检测和抗体检测[3]。其中前两者对急性型ASF的敏感性较高,是ASFV早期感染检测的金标准,但需要在特定实验室、特定条件下开展,不适用于现场应用[4-6]。ASFV感染猪的抗体效价可以反映受感染动物的生存时间,而且抗体检测法相比前两种检测方法,也更加方便、廉价、快速,可用于大规模流行病学调查和无症状感染猪的筛查。
ASFV是线性双股DNA病毒,基因组长为170~193 kb,可编码包括p72、p54、p12等在内的50多种病毒结构蛋白,这些蛋白大都与病毒吸附、毒力、细胞凋亡及免疫应答相关[7-9]。p54蛋白是研究较多的蛋白之一:Kollnberger等[10]率先使用康复猪筛选到p54等14种蛋白可以产生抗体反应蛋白;曹琛福等[11]用原核表达的p54蛋白作为包被原建立了竞争ELISA检测方法;Tesfagaber等[12]建立了基于p54单克隆抗体的竞争性酶联免疫吸附试验(competitive enzyme-linred immunosorbent assay,cELISA);Reis等[13]发现p54等12种蛋白能引发强的IgG应答,使用p54蛋白检测既能检测到IgG反应又能检测到IgM;Gallardo等[14]用原核系统表达的p54、pK205R、pB602L、pA104R这四种蛋白建立了ELISA抗体检测方法,研究发现与OIE推荐的方法相比较,前三者检测效果更好;张鑫宇等[15]建立了基于p54的抗体胶体金试纸检测方法。尽管如此,但目前尚无靶标为p54的商品化ASFV抗体检测试剂盒或试剂条。
胶体金免疫层析技术是近年来一项快速发展的诊断技术,更适用于临床的快速应用,已有逐渐取代ELISA等血清学检测方法的趋势[16-18]。本研究拟利用重新构建和表达的p54原核表达蛋白,建立非洲猪瘟抗体检测免疫胶体金试纸条,用于ASFV血清学诊断、流行病学调查和生猪国际贸易检疫检验。
1 材料与方法
1.1 材料限制性内切酶NdeⅠ、XhoⅠ、LguⅠ、T4 DNA连接酶、DNA marker、蛋白marker购自赛默飞世尔科技(中国)有限公司;DH5α、BL21(DE3)感受态细胞、胶回收试剂盒、SDS-PAGE电泳试剂盒购自江苏康为世纪生物科技股份有限公司;猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)及猪圆环病毒2型(PCV-2)抗体阳性血清均由中国兽医药品监察所提供;羊抗猪IgG-HRP购自北京索莱宝科技有限公司;Ni-NTA Argarose购自美国QIAGEN生物公司;pET30a载体为本实验室保存。
1.2 p54基因设计与合成根据已发表的ASFV p54的基因序列(GenBank登录号:FJ174390),通过SignalP 4.1 Server软件分析检索成熟肽基因,序列见图1,全长399 bp。委托生工生物工程(上海)股份有限公司分别合成带终止子TAG或不带终止子的成熟肽基因,并在5'端和3'端分别引入NdeⅠ、XhoⅠ酶切位点。合成后质粒载体命名为pUC57-p54、pUC57-p54-his。
图1 ASFV p54成熟肽基因序列表Fig. 1 ASFV P54 mature peptide gene sequence
1.3 p54的亚克隆用限制内切酶NdeⅠ、XhoⅠ双酶切pUC57-p54或pUC57-p54-his,回收含成熟肽的基因片段,在T4连接酶的作用下与pET30a载体的双酶切纯化产物连接过夜,转化至E.coliDH5α感受态细胞中,在含卡那霉素抗性的培养基中培养,用LguⅠ、XhoⅠ双酶切鉴定获得的重组表达载体pET30a-p54、pET30a-p54-his。
1.4 重组蛋白p54(-his)的表达将重组表达载体pET30a-p54、pET30a-p54-his分别转化至E.coliBL21(DE3)感受态细胞中,在含卡那霉素抗性的培养基中37℃倒置培养24 h后挑取单菌落扩大培养,取扩大培养液按1∶100比例重新接种1000 mL卡那霉素抗性的2×YT培养液,37℃摇床培养至OD600为0.8时加入终溶度0.4 mmol/L的IPTG,诱导表达4 h后4℃条件下离心收集菌体,超声裂解后离心,分别取上清液及沉淀进行SDS-PAGE电泳分离,考马斯亮蓝染色,观察重组蛋白p54、p54-his表达情况。设pET30a为空白对照。
1.5 重组蛋白的纯化大量收集表达重组蛋白p54-his的菌液,PBS离心洗涤2次后超声破碎,收集上清液,参照QIAGEN的Ni-NTA Argarose使用说明进行p54-his蛋白的纯化,离子交换层析法纯化蛋白p54,SDS-PAGE电泳分离,考马斯亮蓝染色,观察分析纯化结果。
1.6 免疫血清的制备选取60日龄ASFV抗体阴性的健康猪,以纯化得到的重组蛋白p54、p54-his为抗原,分别按90 μg/kg进行免疫。首免时,蛋白与等量的弗氏佐剂充分乳化后肌肉注射;15 d后用弗氏不完全佐剂乳化后肌肉注射,共2次;15 d后不加佐剂仅用重组蛋白进行加强免疫;加强免疫后7 d,前腔静脉采血并分离血清。以5 μg/mL重组蛋白p54-his、p54包被96孔板作为检测原,免疫血清连续10倍稀释,羊抗猪IgG-HRP为二抗,进行ELISA检测。同时设未免血清作阴性对照。
1.7 金颗粒的制备取50 mL胶体金,用0.1 mol/L K2CO3调pH至8.5,搅拌条件下逐滴加入纯化的重组蛋白p54-his,至浓度0.3 mg/mL,充分混匀之后,静置30 min,缓慢加入6 mL 10%BSA,充分混匀,静置30 min。然后在4℃条件下高速离心35 min,弃上清液,用0.02 mol/L硼酸钠溶液重悬沉淀,重复离心1次,弃上清液,用0.01 mol/L硼酸钠溶液重悬沉淀至原体积1/10。
1.8 试纸条制备用0.01 mol/L、pH7.4的PBS液配制含1%BSA、5%蔗糖、1%Tween-20的金标结合垫处理液,将玻璃纤维膜放置于其中浸泡30 min后烘干备用。用BioDot XYZ3000试纸条三维喷点平台系统将胶体金标记的p54抗原点喷在玻璃纤维上,干燥后作金标垫。将SPA点喷于硝酸纤维素膜上以制作检测线(T线),点喷p54多克隆抗体以制作质控线(C线),摸索最佳剂量后干燥备用。按常规方法,将喷有检测线和质控线的硝酸纤维素膜粘贴在中央,分别将吸水纸和胶金垫粘贴于硝酸纤维素膜的上方和下方,两者之间重叠2 mm,再在胶金垫的下方粘贴玻璃纤维作为样本垫,组装成胶体金免疫层析试纸。
1.9 试纸条灵敏度检测分别取纯化的100、80、60、40、20、10 ng/mL重组蛋白p54-his 滴加于样品垫上,静置5~10 min时读取检测结果。通过质控线和检测线显色情况判断试纸条的检测效率。
1.10 检测方法及结果判断取p54-his免疫后猪的血清和未免猪血清,CSFV、PRV、PRRSV、PPV及PCV-2阳性血清分别滴加1~2滴于样品垫上,静置5~10 min时读取检测结果。通过质控线和检测线显色情况判断试纸条的检测效率。
2 结果
2.1 p54亚克隆结果将含有终止子、不含终止子的p54基因分别插入pET30a载体,LguⅠ、XhoⅠ双酶切重组质粒,鉴定结果如图2。重组载体能分别切出的条带,而pET30a空载体只切出2400 bp和3000 bp条带(图1)。将鉴定过正确的质粒命名为pET30a-p54、pET30a-p54-his。

图2 pET30a-p54-his载体酶切鉴定图Fig.2 Digestion identification pET30a-p54-his
2.2 重组蛋白p54(-his)的表达将鉴定正确的重组表达载体pET30a-p54、pET30a-p54-his分别经IPTG 37℃诱导表达4 h后,收集菌体并超声裂解,0.4 mmol/L对上清液和沉淀分别进行SDS-PAGE电泳分离。结果如图3。在裂解产物的上清液中15.8 kDa处可见预期大小的条带(图3),表明重组蛋白p54、p54-his均能可溶性表达。

图3 pET30a-p54、pET30a-p54-his表达产物的SDSPAGE分析Fig.3 SDS-PAGE analysis of pET30a-p54 and pET30ap54-his expression products
2.3 重组蛋白p54-his纯化结果Ni柱纯化法制备的p54-his蛋白以及离子交换层析法获得的p54蛋白的SDS-PAGE结果如图4所示,蛋白纯度可达98%以上。

图4 pET30a-p54-his表达纯化产物的SDS-PAGE分析Fig.4 SDS-PAGE analysis of purified product of pET30a-p54-his
2.4 免疫血清效价测定纯化重组蛋白p54、p54-his分别4次免疫ASFV抗体阴性健康猪后,ELISA法检测结果显示,两种蛋白免疫产生的抗血清效价均为10-6。
2.5 试纸条制备与检测将胶体金标记的p54抗原置于金标垫,以1 mg/mL SPA为捕捉抗原,0.5 mg/mL p54多克隆抗体为检测抗体,制作成胶体金免疫层析试纸。取不同浓度重组蛋白p54-his 滴加于样品垫上,结果如表1。40 ng/mL的重组蛋白能被检出,而20 ng/mL及以下的蛋白则不能检出。
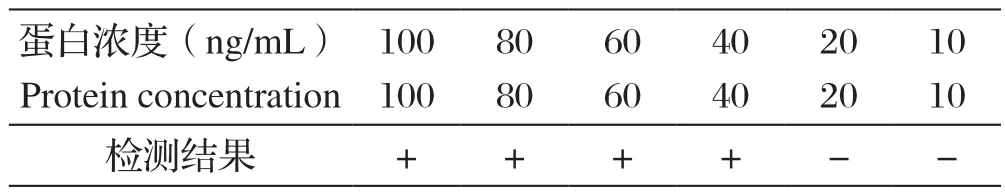
表1 试纸条灵敏度检测结果Table1 The sensitivity test of strip
2.6 特异性检测将p54-his免疫后的猪血清、猪的其他常见病毒血清以及未免血清滴加于样品垫上,静置5-10 min时读取检测结果,以C先和T线均显示出紫红色条带判为阳性,以只在C线出现紫红色条带判为阴性。结果如表2所示,仅p54-his免疫后血清样本的检测结果呈阳性,以“+”表示,其他均为阴性,以“-”表示。

表2 试纸条特异性检测结果Table2 The specificity test of strip
3 讨论
胶体金检测法是近年来发展迅速的一项诊断技术,因为其在检测时所需设备简单、方便携带、灵敏度高、特异性强、易于观察结果等优点而被广泛应用。由于优质的金颗粒抗原、捕获抗原及高效的抗体是胶体金试纸能否成功制备的关键因素,因此我们选取能激发猪产生抗体时间较早,且抗体滴度高的结构蛋白p54[13]作为靶蛋白,分别以p54抗原制作金标垫、SPA为检测线、p54多克隆抗体为质控线,制作胶体金免疫层析试纸,结果表明,制备的免疫层析试纸可以特异性识别p54抗体阳性血清,检测灵敏性比张鑫宇等[15]制备的试纸条至少提高了60 ng/mL,可进一步作为临床推广应用的备选试纸。
His标签的融合蛋白一般情况下不会影响蛋白的分泌、折叠与功能,但会产生少量的抗his抗体,也就是从严格意义上说,含his或不含his的蛋白是两个不同的蛋白。目前,含his标签的亚单位疫苗已被用于猪的免疫,临床采集的血清往往含有his抗体,因此,为了避免因his抗体产生的假阳性检测结果,我们用无his标签的p54蛋白用于试纸条的制备,具有理论创新性,而且从检测结果看,具有特异性。另一方面,我们实现了有、无终止子的p54蛋白的可溶性表达,这样在避开了与病毒直接接触的情况下实现了免疫效果的评价,无生物安全风险;而且,解决了因本实验室无阳性血清这一重要生物材料而无法实现试纸条效率评估的难题。这一策略可为今后其他生物来源有限的疫病研究提供参考。

