臭氧微气泡处理有机废水的效果与机制
杜明辉,王勇,高群丽,张耀宗,孙晓明
(1 中国环境科学研究院国家环境保护生态工业重点实验室,北京 100012;2 华北理工大学建筑工程学院,河北 唐山 063000)
石化、纺织、造纸、制药等行业废水是典型的难降解有机废水[1-4],其中酚类、环烷酸类和多环芳烃类等污染物不但难被生物降解而且具有生物毒性,很难用常规水处理工艺去除[5]。臭氧氧化技术是一种无二次污染的清洁型有机废水处理技术,但在工程应用中存在臭氧传质效率差等问题,导致臭氧利用率低、耗费大量资源和能源[6]。微气泡直径通常小于50μm,与常规曝气气泡相比具有比表面积大、上升速度慢等特性[7],在水体净化[8]、浮选[9]、水产养殖[10]等领域都有较多应用和研究。将臭氧微气泡释放到废水中可有效强化传质,在降解污染物的同时减少臭氧使用量和反应时间,降低投资和运行成本,是提升臭氧氧化效率的有效方式[8]。
本研究以苯酚配置模拟有机废水,通过臭氧微气泡与曝气头所产生的常规气泡分别进行臭氧氧化,并且对比了在氧化有机物过程中的气泡形态和氧化效果。之后,基于两种曝气方式在有机物降解过程中的差异,从臭氧传质与分解特性和自由基生成的角度进一步研究,最后结合经典模型对气泡直径和界面压力之间的关系进行了理论分析,以期为臭氧微气泡在有机废水处理的实际应用提供参考和理论基础。
1 实验材料与方法
1.1 实验材料
臭氧由北京同林生产的3S-T5型臭氧发生器制备,以纯氧(99.99%)为气源;实验用苯酚以及叔丁醇(TBA)为分析纯,国药集团化学试剂有限公司;实验用水为去离子水。
1.2 不同气泡的制备
微气泡采用加压溶气法制备(图1),在吸程3m、封堵压力0.8MPa 的隔膜泵作用下,臭氧与反应器中的回流水被压入一个体积为500mL 的溶压罐内形成气液混合物,气液混合物通过微气泡释气头在反应器底部释放,释放头具有文丘里管结构,过流断面的变化导致气液混合物所受压力改变,较大的气泡在向外的压力作用下碎化为微气泡。

图1 加压溶气法制备微气泡
常规气泡通过钛合金耐臭氧曝气头在反应器底部进行曝气产生,本实验中先后使用了孔径为1μm 和100μm 的曝气头,为了方便描述,后文中将两种曝气头简称为1μm曝气头和100μm曝气头。
1.3 实验装置
实验装置如图2所示,臭氧通过浓度检测器后进入微气泡发生器,产生的微气泡通入反应器底部释放,反应器设计为密闭的有机玻璃容器,直径10cm、高80cm、有效容积6L。反应后的尾气通过干燥器(硅酸盐)去除水分以消除对后续臭氧浓度检测的影响,最后经臭氧破坏器后排出。实验过程中通过气体流量计检测进气及尾气流量,通过气体调节阀控制流量。
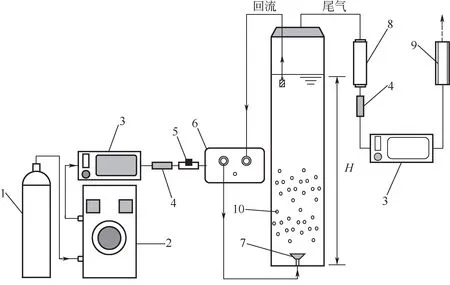
图2 实验装置
1.4 检测方法
通过数码显微镜(拜斯特)对臭氧微气泡进行拍摄并使用Nano Measurer 1.2 软件对图片进行分析;采用COD快速测定仪(5B-3B,连华科技)测定化学需氧量(COD)浓度;采用液相臭氧测量计(英国百灵达)测定液相臭氧浓度[11];采用臭氧浓度检测器(3S-J5000,北京同林)测定气相臭氧浓度;采用紫外-可见分光光度计(UV-8000,上海元析)对水样进行紫外光谱扫描[12]。
1.5 实验步骤
1.5.1 微气泡与常规气泡对COD降解效果的影响
在反应器中加入COD 初始浓度为51.2mg/L(苯酚浓度约为20mg/L)模拟有机废水5L,控制进气O3浓度为120mg/L、流量为75mL/min。分别采用微气泡发生器、1μm 和100μm 曝气头在反应器底部同一位置曝气120min,测定实验过程中的COD、尾气臭氧浓度、紫外-可见吸收光谱。之后,控制臭氧浓度为120mg/L,分别使用微气泡发生器和1μm 曝气头在臭氧流量为25mL/min、50mL/min、75mL/min、100mL/min条件下曝气120min,测定不同曝气方式和曝气量下COD随时间变化情况。
1.5.2 臭氧微气泡传质特性实验
控制进气O3浓度为120mg/L,流量为75mL/min,在反应器中通入5L 去离子水,分别使用微气泡发生器和1μm 曝气头进行曝气,测定实验过程中的液相臭氧浓度,观察到液相臭氧浓度不再变化后停止曝气,静置30min测定液相臭氧浓度随时间变化情况。同时,当停止曝气时两实验中初始液相臭氧浓度的不同会引起分解速率的不同,故另外采用1μm 曝气头在反应器内进行曝气,在曝气过程中调整臭氧曝气流量,制备与微气泡实验中平衡浓度相同的臭氧水作为对比实验。
1.5.3 自由基屏蔽实验
叔丁醇(TBA)能够捕获自由基,是常用的自由基屏蔽剂,故可采用猝灭法探究体系中自由基在污染物降解过程中的作用[13]。配制初始COD 浓度51.2mg/L 的有机废水5L,加入0.05mol TBA(反应器中叔丁醇浓度为1mmol/L)混合均匀后移至反应器中,分别采用微气泡和1μm 曝气头对废水处理60min,测定反应过程COD浓度。
1.6 COD去除反应速率常数计算
臭氧氧化有机污染物,COD 到达最大去除率之前,按照拟一级动力学方程计算动力学反应速率常数,见式(1)。

式中,c为t时刻COD浓度,mg/L;k为反应速率常数[14],min-1;t为反应时间,min。
将式(1)进行积分,将边界条件t=0、c=c0代入可得式(2)。

式中,c0为COD初始质量浓度,mg/L。
1.7 臭氧传质系数与分解系数计算
臭氧由气相向液相传质过程中,液相臭氧浓度与时间t变化关系符合拟一级反应动力学,即式(3)。
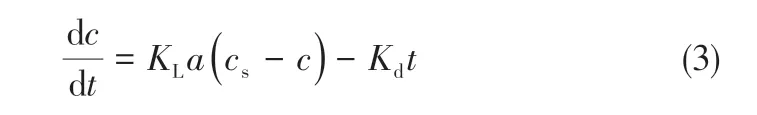
式中,KLa为臭氧传质系数,min-1;cs为反应条件下水中达到饱和平衡时液相臭氧度,mg/L;c为t时刻水中液相臭氧浓度,mg/L;Kd为臭氧分解系数,min-1。
将边界条件t=0、c=0代入式中并积分得式(4)。

停止曝气后,臭氧分解速率为式(5)。

将边界条件t=0、c=cs代入并积分得式(6)。

通过ln[cs/(cs-c)]与t的直线关系的斜率得到(KLa+Kd),通过ln(cs/c)与t的直线关系的斜率得到Kd[12]。
综上,多媒体作为一种有效的辅助性教学手段,将其应用到高中生物课堂中,可以营造一个相对轻松、和谐的课堂环境,让学生摆脱传统的课堂教学,从而激发学生的学习兴趣,让学生主动参与到课堂教学中来,进而提高课堂教学实效。作为教师,在创设多媒体教学环境中,要紧扣教学内容,确保教学情境的针对性,进而更好地服务教学,引导学生高效学习。
2 结果与讨论
2.1 臭氧微气泡形态
实验中采用1μm曝气头和100μm曝气头产生的常规气泡直径约1mm和5mm,1μm曝气头产生的气泡数量明显多于100μm 曝气头[图3(a)]。另一方面,与曝气头所产生的气泡不同,单个臭氧微气泡无法通过肉眼观察到,臭氧经微气泡发生器释放后生成的微气泡可以迅速充满反应器内部,溶液呈现乳白色,无明显上升趋势,整体随水流作不规则运动。采用Nano Measurer 1.2软件对显微镜下微气泡形态[图3(b)]进行测量和分析统计[图3(c)][15],可以看到,微气泡直径主要分布在5~40μm,其中直径为15~20μm的微气泡数量最多,占总量的38%,有报道称,通过加压气液混合物在文丘里结构释放得到微气泡的过程中,气泡碎化作用发生在流体截面扩张阶段,湍流耗散率沿径向分布造成了气泡粒径的不均匀[16]。图像中微气泡平均直径为20.37μm,具有远大于常规气泡的气液接触面积,同时根据斯托克斯方程[式(7)]计算[17]。

图3 微气泡表征结果

式中,μ为动力黏度,N·s/m2;ρ为流体密度,kg/m3;d为气泡直径,m;V为气泡上升速度,m/s。
理想状况下,臭氧微气泡平均上升速度为225.91μm/s,具备较长的气液接触时间,有利于臭氧利用率和氧化效率的提升。除此之外,基于微气泡直径数值而引起的微气泡其他特性将在后文2.3.3节进一步探讨。
2.2 臭氧微气泡降解有机废水效果
2.2.1 臭氧微气泡对COD的去除效果
分别采用微气泡、1μm和100μm曝气头处理有机废水,实验过程中COD去除率随时间变化情况如图4(a)所示,臭氧微气泡对COD 去除率在40min 达到了89%,随后趋于平稳,而1μm和100μm曝气头对应的COD去除率分别为69%和38%。根据拟一级动力学方程分别对处理过程中COD达到最大去除率之前的数据进行拟合[图4(b)]可知,虽然微气泡与1μm、100μm 曝气头产生气泡的方式以及气泡粒径具有差异,但在氧化过程中均符合拟一级反应动力学规律,拟合相关系数分别为0.9953、0.9914、0.9931,相关性良好。其中,臭氧微气泡降 解 速 率 系 数(0.0513min-1) 是1μm 曝 气 头(0.0322min-1) 的1.59 倍, 是100μm 曝 气 头(0.0142min-1)的3.61 倍,可见,在使用臭氧处理污染物的过程中,相较于常规曝气方式,臭氧微气泡可以显著提升有机物降解速率。

图4 COD去除率随时间变化情况
2.2.2 COD/O3和臭氧利用率
根据进气臭氧浓度、尾气臭氧浓度、COD 之间关系分别检测和计算不同曝气方式下COD/O3以及臭氧利用率,其中COD/O3计算方法见式(8)。

式中,[COD]0为初始COD 值,mg/L;[COD]t为t时刻COD值,mg/L;t为反应时间,min;[O3]为反应中通入的臭氧量,mg。

式中,η为臭氧利用率,%;c0为臭氧进气浓度,mg/NL;ct为t时刻逸散臭氧浓度,mg/NL;t为反应时间,min。
实验结果如图5所示,当反应进行10min时,3种曝气方式中的COD/O3均处于最大值,其中,微气泡COD/O3为0.8934,高 于1μm 曝 气 头0.6258 和100μm 曝气头0.3678,随着反应进行3 种曝气方式COD/O3均呈现下降趋势,微气泡达到COD 最大去除率时(40min)COD/O3为0.626,均高于其他两种曝气方式[图5(a)],这说明在臭氧投加量相同的情况下微气泡单位O3可以去除更多的COD。另一方面,在微气泡实验中m未达到COD 最大去除率之前,臭氧利用率达到99.19%以上,高于1μm 曝气头的86.23%和100μm 曝气头的53.42%[图5(b)],当COD去除率达到最大后,臭氧利用率开始升高,但是也显著低于1μm曝气头和100μm曝气头,这一现象说明臭氧微气泡降解污染物时,具有较高的臭氧利用率,同时可缓解或消除过剩臭氧逸散。

图5 不同曝气方式COD/O3和臭氧利用率随时间变化情况
2.2.3 曝气量对臭氧微气泡氧化效果影响
控制臭氧流量为100mL/min、 75mL/min、50mL/min、25mL/min,分别采用微气泡和1μm 曝气头进行曝气,废水COD 随时间变化情况拟一级动力学拟合结果如图6所示。可以看到,使用1μm曝气头进行曝气过程中[图6(a)],臭氧曝气流量为25mL/min、50mL/min、75mL/min 和100mL/min时,COD 氧化反应速率常数分别为0.0038min-1、0.0111min-1、0.0322min-1和0.0563min-1,表明采用常规曝气头进行臭氧曝气时,随着曝气量增加,氧化反应速率也随之提高。在使用微气泡降解有机废水的过程中[图6(b)],当曝气流量为25mL/min、50mL/min 和75mL/min 时,氧化反应速率常数分别为0.0068min-1、0.0295min-1和0.0513min-1,随曝气量增加,有机物降解速率逐渐提高,与常规曝气一致,但同等气量下微气泡反应速率常数均显著高于常规曝气;与常规曝气不同的是,当微气泡气量继续增加至100mL/min 时, 反应速率常数为0.059min-1,与流量为75mL/min 时并未产生显著提升,表明臭氧微气泡处理废水过程存在最适气液混合比,当气量过量时,微气泡生成和反应机制遭到破坏,导致污染物降解速率无法继续提升。
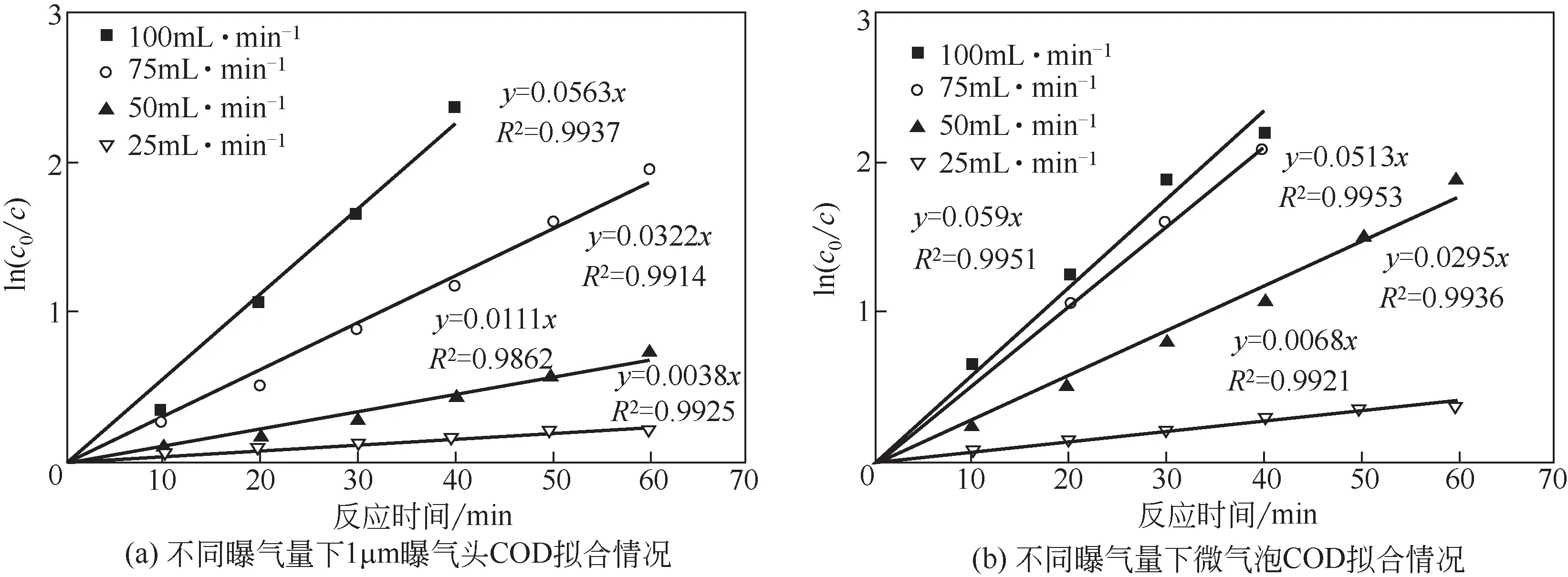
图6 废水COD随时间变化情况拟一级动力学拟合结果
2.3 臭氧微气泡高效氧化有机物机理
2.3.1 臭氧传质与分解
臭氧微气泡传质特性实验中,液相臭氧浓度随时间的变化情况结果如图7所示,基于1.6节的描述,臭氧在向水中进行传质的同时也发生分解反应,当传质速率与分解速率达到平衡时,液相臭氧浓度保持不变。在本实验中,曝气进行20min和35min时,微气泡和1μm 曝气头的实验中液相臭氧浓度为10.4mg/L 和12.4mg/L,达到平衡浓度[图7(a)],与之前的一些关于微气泡的研究不同的是[12],采用曝气头进行曝气所达到的平衡浓度并不一定低于微气泡的平衡浓度。进一步采用1.6节中介绍的方法对液相臭氧浓度和反应时间进行拟合可知[图7(b)],微气泡中液相臭氧浓度随时间变化速率常数为0.1363min-1,而1μm 曝气头对应常数为0.0768m-1,此时的速率常数为传质系数与分解系数之差;在停止曝气后,此时臭氧分子只发生分解反应,液相臭氧浓度逐渐降低,拟合后可知[图7(c)],在停止曝气后的30min内,1μm曝气头、臭氧水分解系数分别稳定在0.0275min-1、0.0248min-1,说明初始液相臭氧浓度越高,臭氧分子在水中分解速率越快,但是这种影响并不显著;而在微气泡体系中,液相臭氧浓度呈现明显的阶段性变化,在停止曝气后0~15min 内分解系数为0.0702min-1,远高于1μm 曝气头和臭氧水对应的分解系数,停止曝气15min后,微气泡体系臭氧分解系数降至0.0276min-1,与1μm 曝气头、臭氧水相当。通过观察发现,微气泡体系停止曝气后,微气泡在10~15min内逐渐消散,这表明微气泡的存在促进了臭氧分子的分解反应。计算微气泡(以停止曝气后0~15min 内收集数据计算分解系数)、1μm 曝气头的臭氧传质系数可知,微气泡、1μm 曝气头的传质系数分别为0.2065min-1和0.1016min-1,在相同臭氧曝气量下,微气泡的传质系数和分解系数是1μm 曝气头的2.03倍和2.83倍。综上,臭氧微气泡传质效率显著高于常规气泡,但是同时也具有更高的分解效率,而微气泡的存在是臭氧分子快速分解的主要原因。微气泡对臭氧分子分解的促进作用在下文探讨。

图7 液相臭氧浓度随时间的变化情况
2.3.2 臭氧微气泡降解有机废水产物
臭氧微气泡降解有机废水过程中紫外-可见吸收光谱变化如图8所示。使用苯酚模拟的有机废水在220nm和270nm处存在两个明显紫外吸收峰,其中270nm处吸收峰为B带吸收峰,通常被认为是苯酚的特征吸收峰[18]。反应10min以后,在200~350nm处有明显吸收带,表明有苯环以及共轭体系存在,其中240~290nm吸光带较原水提升明显,表明苯酚发生了邻位开环反应生成了诸如邻苯二酚、对苯二酚、间苯二酚以及苯醌等中间产物,在40min后,250~400nm吸光带大幅减弱,渐渐趋于0,说明溶液中苯环结构及其他共轭键被破坏,反应最终在200~220nm处有吸光带而在其他位置无吸光带,表明反应最终产物为小分子饱和烃及羧酸[19]。

图8 臭氧微气泡氧化反应过程紫外-可见吸收光谱
2.3.3 自由基的产生
臭氧微气泡自由基抑制实验结果如图9 所示,当模拟有机废水中未加入TBA时,反应开始40min后微气泡处理的废水COD 去除率可达89%;加入TBA 之后,COD 去除速率降低至12%;而在1μm曝气头实验中,加入叔丁醇后COD 去除率只出现了略微的降低,这说明常规气泡主要依靠臭氧与污染物发生直接氧化作用对污染物进行降解,而臭氧微气泡则是以自由基(·OH)为主导的间接氧化作用实现对污染物的氧化[20]。基于Wang 等[21]在微气泡的气液传质试验中得到的结论,可以认为臭氧微气泡中·OH 的生成很可能是由于气泡的界面变化而引起的,微气泡界面具有逐渐收缩的特性,气泡界面收缩速率逐渐增大导致附近OH-和H+的聚集,zeta电位的绝对值迅速增大,形成了极端的反应条件,破坏了O3的分子结构,促进了·OH 的产生,这一观点也在多项关于臭氧微气泡相关研究中得到了一定程度上的证明[12,22-23]。反应过程如式(10)所示,结合2.3.1节中臭氧分子快速分解的现象可知,微气泡的存在是臭氧转化为·OH的重要因素。
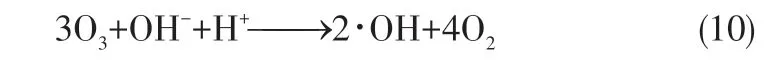

图9 不同曝气方式下叔丁醇对COD去除率影响
2.3.4 基于界面压力的臭氧微气泡高效氧化理论探讨
气泡直径与气-液界面之间的压力可以用Yong-Laplace方程[式(11)]表示。

式中,p为界面所受压力,Pa;p1为液体对界面产生的压力,Pa;δ为液体表面张力系数,N/m;d为气泡直径,m。
在理想状态下,可以认为气-液界面之间的压力为液体对界面的压力与气泡表面向内张力(4δ/d)的和,基于2.1 节中的研究,实验中的臭氧微气泡直径分布在5~40μm之间,δ取20℃时水的表面张力系数0.0728N/m,实验中气泡所处高度在0~0.8m之间不断变化的,近似地认为p1是水在0.8m 高度所产生的压力,为0.0784atm(1atm=101.3kPa)。将微气泡直径代入式(9)后从臭氧微气泡直径与所受压力的关系中可以看到(图10),本实验所观察到的微气泡气-液界面之间压力最高可以达到0.58240atm(实线部分),而此时的界面压力并不是不变的,当由液体张力引起的压力大于气泡内部向外的压力时,气泡倾向于继续收缩,收缩行为进而导致界面压力不断升高。与此不同的是,当气泡直径较大时(超过50μm),可以清楚地观察到,气泡表面张力趋近于0,水产生的压力起主要作用,收缩效应消失,这一区别导致了普通气泡和微气泡性质出现差异。
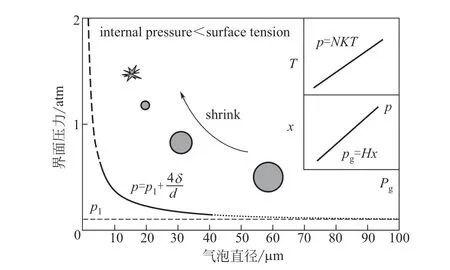
图10 臭氧微气泡中界面压力对于传质与氧化作用影响的理论分析
收缩效应对于气泡传质具有极大影响,基于亨特定律所提出的气体分压与溶解度之间的关系见式(12)。

式中,pg为气体分压,Pa;H为亨特常数,kmol/(m3·Pa);x为气体摩尔分数溶解度,kmol/m3。
虽然亨特定律只是一种近似的规律,不能对非理想气体进行有效反应,但是可以看到,随着气泡内部压力的升高,臭氧的溶解度也呈现一定的正相关性,这或许可以在一定程度上解释臭氧微气泡快速传质的现象。与此同时,根据理想气体方程[式(13)]。

式中,p为气体界面压力,Pa;N为气体摩尔密度,mol/m3;K为玻耳兹曼常数,J/K;T为绝对温度,K。
在气泡内部逐渐升高的过程中除了引发气体更高的溶解度变化外,气体内部的热量也随气泡收缩而增大。而这种温度的升高对于臭氧分子的变化和污染物降解效果的影响有待继续研究。
3 结论
(1)处理有机废水过程中的微气泡粒径在5~40μm 之间,平均粒径为20.37μm;粒径为15~20μm 的气泡数量最多,占比为38%,分别是孔径1μm 曝气头和100μm 曝气头产生气泡的1/49.09 和1/245.46。
(2)臭氧浓度为120mg/L、流量为75mL/min,采用臭氧微气泡处理初始浓度为51.2mg/L的有机废水,40min后COD去除率达到89%,氧化反应速率分别是1μm 曝气头的1.59 倍,是100μm 曝气头的3.61 倍,COD/O3为0.626,臭氧利用率达到了99.19%以上,反应后,大部分有机物被氧化,共轭体系被完全破坏,最终产物为小分子烃和羧酸。
(3)臭氧流量为75mL/min 时,微气泡的传质系数为0.2065,是1μm 曝气头的2.03 倍;微气泡可促进臭氧分子分解,分解系数达到0.0702,是1μm 曝气头的2.83 倍,微气泡消散后,臭氧分解系数降为0.0276,与常规气泡相当;臭氧微气泡促进了自由基的生成,屏蔽自由基后,40min时COD去除率下降了77%;实验中所采用的微气泡界面压力可达0.5824atm,这导致了臭氧微气泡与直径较大的气泡产生性质上的差异。

