黑松露多糖提取工艺优化及体外抗氧化活性分析
国琦,梁双敏,葛长荣,肖智超*
(1.云南农业大学云南省畜产品加工工程技术研究中心,云南昆明 650201)(2.云南农业大学食品科学技术学院,云南昆明 650201)
黑松露(Tuber sinense),中国地区别名又叫做块菌、无娘果等,属子囊菌门,西洋块菌科,西洋块菌属[1-2]。是一种生长在地表下且能与松科、榛科、壳斗科、桦木科等树木共生的野生食用菌[3]。其子囊果呈不规则的半球形或块状,其表面以黑褐色或暗色为主并呈现出明显的疣突,成熟的黑松露切面白褐相间,如同大理石纹样[4]。黑松露的生长条件十分严格,光照、水分、土壤pH、微生物等因素对其生长有影响[5-6]。黑松露风味独特,营养价值丰富,含有人体所需的多种营养物质,如多糖、蛋白质、氨基酸、多不饱和脂肪酸、维生素和微量元素等,与鱼子酱和鹅肝一起被称为世界三大美食[7-8]。欧洲和亚洲是黑松露的主要产地[9-10],根据DNA 数据和地理分布分析,亚洲块菌物种群包括6 个物种:中国块菌(Tuber sinense)、台湾块菌T.formosanum、易贡块菌T.yigongense、长刺块菌T.longispinosum、喜马拉雅块菌T.himalayense和印度块菌T.indicum[11-13]。近年来,食用菌多糖的免疫活性、抗氧化、降血糖、抗肿瘤和降血脂等生物活性被逐渐证实,但目前针对黑松露的研究主要集中于其化学成分,提取纯化等基础研究,对于黑松露多糖的单糖组成、单糖结构、生物活性(抗菌、抗肿瘤等)及其作用机制的研究较少[14-16],这成为制约黑松露资源深度开发利用的瓶颈。
因此,本研究选取云南黑松露,采用超声波辅助水提醇沉法提取黑松露多糖,采用响应曲面法优化提取工艺。并对纯化后黑松露多糖的单糖组成、摩尔比等结构特征进行研究,还通过DPPH、ABTB、金属螯合力和还原力测定等方法评价黑松露多糖的体外抗氧化活性,为黑松露多糖活性的深入研究及其开发利用提供一定的理论依据。
1 材料与方法
1.1 主要材料与试剂
黑松露购于易门县山里香食品有限公司;DEAE-Sepharose 快速流动柱,美国GE Healthcare 公司;无水乙醇,湖北西陇化工有限公司;葡萄糖、苯酚,天津市风船化学试剂科技有限公司;浓硫酸,开封东大化工公司;氯化钠,国药化学试剂公司;氯仿,天津市元立化工有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-氮联-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、抗坏血酸(Vc)、菲啰嗪-钠盐、乙二胺四乙酸二钠盐(EDTA-2Na),上海源叶生物科技有限公司;16 种单糖标准品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸、氨基半乳糖盐酸盐、盐酸氨基葡萄糖、N-乙酰-D 氨基葡萄糖、古罗糖醛酸、甘露糖醛酸),上海博睿糖生物技术有限公司;三氟乙酸,比利时ACROS公司;50%氢氧化钠溶液,美国Alfa Aesar公司;醋酸钠,美国ThermoFisher 公司;其它均为分析纯试剂。
1.2 仪器与设备
DFY-400D 摇摆式高速粉碎机,温岭市林大机械有限公司;BSA224S 数显电子天平,北京赛多利斯仪器系统有限公司;A360 紫外分光光度计,上海美普达仪器有限公司;EU-K1-20TQ 超纯水仪,南京欧铠环境科技有限公司;LGJ-10N 真空冷冻干燥机,北京亚星仪科发展有限公司;H2-16RK 台式高速离心机,湖南可成仪器设备有限公司;SCQ-9201B 超声波清洗器,上海声彦超声仪器有限公司;ULT1386-3-V41 超低温冰箱,赛默飞仪器有限公司;HH-8 数显恒温水浴锅,国华电器有限公司;RE-57 旋转蒸发器,上海亚荣生化仪器厂;ELX800 酶标仪,美国BIO-TEK 公司;ICS5000 离子色谱仪,美国ThermoFisher 公司;101-1BS 电热恒温鼓风干燥箱、UGC-24M 氮吹仪,力辰科技。
1.3 试验方法
1.3.1 黑松露粗多糖的制备
以黑松露为原料,在45 ℃下对其子实体进行干燥粉碎,设计料液比(10~50,V/m)、提取温度(55~95 ℃)和提取时间(0.5~2.5 h)。称取黑松露固体粉末5 g,按料液比加入超纯水,将溶解后的溶液放入超声波提取仪中超声20 min,将超声后的溶液放入90 ℃恒温水浴锅中水浴2 h。6500 r/min 离心20 min,保留上清液,重复提取两次。抽滤后收集上清液,真空浓缩至约60 mL,按照1:3 的比例加入3 倍体积的无水乙醇,充分搅拌,以致产生沉淀物或絮状物。置于4 ℃冰箱中静置24 h,4000 r/min 离心15 min,收集沉淀物。沉淀物加超纯水复溶得到黑松露多糖溶液。将冷冻后的松露多糖置于真空冷冻干燥机中冻干成粉末状后密封储存于-20 ℃冰箱,即为黑松露粗多糖提取物。以葡萄糖为标准,采用苯酚-硫酸法测定黑松露粗多糖的含量[17]。黑松露粗多糖得率(%)计算如下:

1.3.2 优化实验设计
对单因素实验数据进行分析,采用Box-Behnken法优化提取工艺。提取温度(A)、料液比(B)、提取时间(C)和多糖提取率是因变量[18]。自变量的因素和水平如表1 所示。
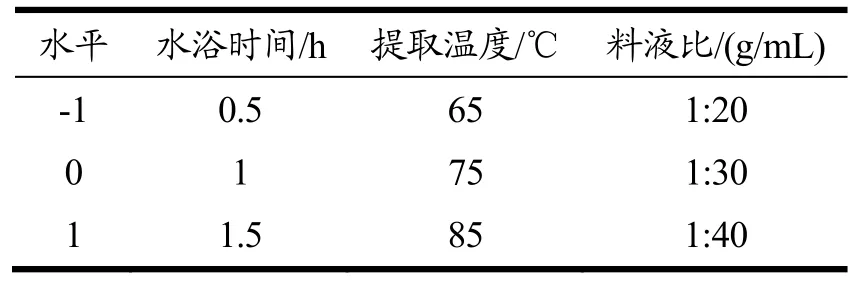
表1 响应面试验因素水平表Table 1 Responsesurface experimental factor level table
1.3.3 黑松露粗多糖的纯化
采用Sevage 法脱去黑松露粗多糖中的蛋白质,将脱去蛋白质的溶液进行旋转浓缩,浓缩后透析,收集样品,冷冻干燥,得到除去杂质的黑松露粗多糖。将粗多糖溶于去离子水中,40 mL 溶液置于DEAE-Sepharose 快速流动柱(4.6 cm×50 cm)上,依次用蒸馏水、0.1、0.3、0.5 mol/L NaCl 溶液洗脱。流速为2 mL/min,自动收集洗脱液(10.0 mL/管)。以葡萄糖为标准,苯酚-硫酸法测定多糖含量。依据洗脱峰型,收集同一峰洗脱液,浓缩,透析,冻干,从而获得四个多糖组分[19-20]。
1.3.4 黑松露多糖初步结构分析
取16 种单糖标准品配成约10 mg/mL 标准溶液。取各单糖标准溶液精密配置0.1、0.5、1、5、10、20、50 mg/L 梯度浓度作为标准品。根据绝对定量方法,测定不同单糖质量,根据单糖摩尔质量计算出摩尔比。
用离子色谱仪(ICS 5000,美国赛默飞世尔公司)分析纯化后黑松露多糖三个组分的单糖组成。5 mg 样品在120 ℃下用10 mL的2 M TFA在安瓿中分解5 h。用氮气干燥酸水解液,加入5 mL 水涡旋混匀,吸取100 μL 于900 μL 去离子水中稀释,12000 r/min 离心5 min,水解样品溶液与10 mg/mL 标准单糖混合物注入色谱系统。色谱柱:DionexCarbopacTMPA20 (3×150);流动相A相为H2O,B相为250 mol/L NaOHC:50 mol/L NaOH 和500 mol/L NaOAC;流速为0.3 mL/min;进样量为5 μL,柱温为30 ℃[21]。
1.3.5 黑松露多糖的体外抗氧化活性测定
1.3.5.1 DPPH 自由基清除活性
DPPH 自由基清除活性的测定方法参照Wang 等[22]进行稍加修改。通过乙醇溶解制备0.2 mmol/L DPPH 溶液,并在试验日使用。将2 mL DPPH 溶液与2 mL 样品溶液(0.25~4 mg/mL)混合并摇匀。然后将混合物在室温下黑暗中保持30 min。使用抗坏血酸作为对照。最后用紫外-可见分光光度计测定了样品在517 nm 处的吸光度。自由基清除能力由以下公式确定:

式中:
A0——对照试验的吸光度值(无水乙醇代替样品);
Ai——样品试验的吸光度值;
Aj——样品干扰试验的吸光度值(无水乙醇代替DPPH 溶液)。
1.3.5.2 ABTS 自由基清除活性
ABTS自由基清除黑松露多糖的实验是根据Zeng等[23]方法进行的,并做了一些修改。通过将5 mL K2S2O8溶液(7mm ABTS+)与5 mL过硫酸钾溶液(2.45 mm)在黑暗条件下反应12 h 制备ABTS+,并在当天使用。用蒸馏水将ABTS+溶液稀释至734 nm 处的吸光度为0.70±0.02。将0.4 mL 不同浓度的样品溶液(0.25~4 mg/mL)和3 mL ABTS+溶液剧烈混合。以抗坏血酸为对照。在室温黑暗条件下反应30 min 后,于732 nm 处测量吸光度。ABTS 自由基阳离子清除活性通过以下方程式计算:

式中:
A0——对照试验的吸光度值(用蒸馏水代替样品);
Ai——样品试验的吸光度值;
Aj——样品干扰试验的吸光度(用蒸馏水代替ABTS 溶液)。
1.3.5.3 金属螯合能力的测定
多糖的金属螯合能力测定根据先前报道的方法进行少许修改[24]。将1.0 mL 样品(0.25~4 mg/mL)与0.1 mL 2.0 mM 氯化亚铁、0.2 mL 5.0 mM 菲啰嗪溶液和3.7 mL 蒸馏水混合。以EDTA-2Na 为对照。混合反应10 min 后,在560 nm 处测定吸光度。金属螯合能力由以下方程式计算:

式中:
A0——对照试验(用蒸馏水代替样品)的吸光度值;
Ai——样品试验的吸光度值;
Aj——样品干扰试验(用蒸馏水代替氯化铁溶液)的吸光度值。
1.3.5.4 还原力的测定
不同黑松露多糖组分还原力的测定采用先前研究[17]中所述的方法进行少许修改。1 mL 样品(0.25~4 mg/mL)与2.5 mL 磷酸盐缓冲液(0.2 mol/L,pH 6.6)和2.5 mL 0.1% K3Fe(CN)6(0.1%,m/V)混合。将混合物在50 ℃下培养20 min,然后添加2.5 mL 三氯乙酸溶液(10%,m/V),2.5 mL FeCl3(0.1%,m/V),在700 nm 处测量吸光度。还原力测定通过以下公式计算:
还原力=Ai-Aj
式中:
Ai——样品实验的吸光度值,
Aj——样品干扰实验的吸光度(用蒸馏水代替FeCl3溶液)。
1.3.6 统计分析
所有样品均进行 3 次平行测定。利用Design-Expert 8.0.6中的Box-Behnken建立实验模型进行试验,试验数据以Excel 2020 进行数据初步整理,采用OriginPro 8.6 软件进行数据统计分析。
2 结果与讨论
2.1 单因素实验分析
2.1.1 提取时间对黑松露粗多糖提取率的影响
当提取温度为75 ℃,料液比为1:30 g/mL 时,研究其不同提取时间0.5、1、1.5、2、2.5 h 对黑松露粗多糖提取率的影响。由图1 可知,黑松露粗多糖在0~1 h时提取率呈上升趋势,在1~2.5 h时总体呈下降趋势。虽然在2 h 粗多糖得率有上升趋势,但是与1 h 相比趋势不够明显。时菲菲等[25]制备多糖的最适提取时间为2.3 h,多糖得率在15.66%。提取过程中超出最适提取时间时,其他非多糖成分会随着提取时间的延长而溶出,多糖也会因过度水解而导致得率下降。本文黑松露多糖在2 h 有上升趋势的原因可能是随着提取时间的延长,非多糖物质溶解出来,使得黑松露粗多糖的得率提高[26]。因此,1 h 为黑松露粗多糖最佳提取时间,提取率达到最高为10.45%。

图1 提取时间对黑松露粗多糖提取率的影响Fig.1 Effect of extraction time on the yield ofcrude polysaccharide fromTuber sinense
2.1.2 提取温度对黑松露粗多糖得率的影响
温度是影响提取率的一个重要因素,因此在提取时间为1 h,料液比为1:30 g/mL 时,分别研究了55、65、75、85 和95 ℃对黑松露粗多糖提取率的影响。由图2 可知,粗多糖提取率随着温度的升高而增大,当温度达到75 ℃时,得率达到最高为11.5%,而后随着温度的升高而下降。闫舒雅等[27]提取鸡腿菇菌丝体多糖最适提取温度为80 ℃,其提取率为7.80%。与本文研究的提取温度相近,提取过程中温度不宜过高,温度过高会导致多糖部分水解,使粗多糖得率下降[28]。因此,本文的最佳提取温度为75 ℃。
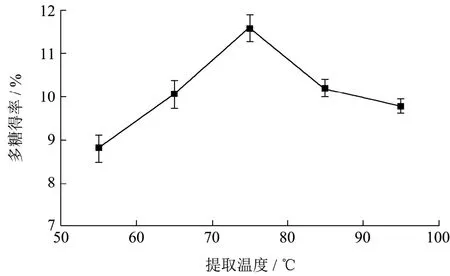
图2 提取温度对黑松露粗多糖提取率的影响Fig.2 Effect of extraction temperature on the yield of crude polysaccharide from Tuber sinense
2.1.3 料液比对黑松露粗多糖提取率的影响
不同料液比也会影响黑松露粗多糖提取率。设定料液比为:1:10、1:20、1:30、1:40 和1:50 g/mL),提取时间和温度为1 h 和75 ℃。不同料液比对黑松露粗多糖提取率的影响如图3 所示,当料液比从10 g/mL增加到30 g/mL 时,提取率明显提高到10.88%,当料液比达到1:30 g/mL 时,最大值为10.88%。然而,当料液比持续增加到30 g/mL 和50 g/mL 时,曲线开始缓慢下降。葛俊宏等[29]提取人参多糖,最佳的料液比为1:30 g/mL,最高得率为9.87%。人参多糖料液比超过1:30 g/mL 时,多糖得率却出现了下降的趋势,与本文多糖得率趋势相近。当料液比过大时,溶剂体积越大,提取后在高温下浓缩需要很长的时间,导致黑松露粗多糖的分子结构被破坏[30]。因此,本文最佳料液比为1:30 g/mL。

图3 料液比对黑松露粗多糖提取率的影响Fig.3 Effect of material liquid ratio on the yield of crude polysaccharide from Tuber sinense
2.2 黑松露粗多糖提取条件的优化
根据单因素试验结果,以提取时间、提取温度和料液比3 个因素为自变量,以黑松露粗多糖得率为响应值,建立试验模型,确定17 组试验。试验设计和结果见表2。

表2 响应面分析的试验设计和结果Table 2 Experimental design and results for response surface analysis
2.2.1 模型建立及显著性检验
根据多元回归分析的结果,黑松露多糖的得率(R )由以下二次函数求得型号:Y=11.64+0.14A+0.44B+0.075C-0.56AB+0.21AC-0.035 BC-1.02A2-1.59B2-0.85C2。响应面二次模型的方差分析(ANOVA)如表3 所示。

表3 二次回归模型方差分析Table 3 Variance analysis of the developed quadratic regression model
回归模型的统计显著性用F检验和p值检验,如方差分析表3 所示,高F值(12.21)和低p值(p=0.0017<0.01)表明该模型具有高度的统计学意义。缺乏拟合的F值和p值分别为5.01 和0.08。p值>0.05 表明,与纯误差相比,拟合不足不显著,这意味模型方程足以预测这些变化[31]。同时,测定系数(R2)、校正决定系数(R2adj)和变异系数(C.V)分别为94.01%、86.31%和4.59%。这表明该模型在试验误差方面存在可接受范围,是预测黑松露得率的可靠模型[32]。根据该模型,影响黑松露粗多糖提取率的因素为B(料液比)>A(提取温度)>C(提取时间)。
2.2.2 黑松露粗多糖响应面交互作用影响结果
通过对响应面图和等高线图的分析,进一步探讨了三者之间的相互作用对黑松露粗多糖提取率的影响[33]。由料液比与提取温度等高线图的疏密程度可以看出,表明料液比对云南黑松露提取率的影响要大于提取温度,二者交互作用显著(图4a)。而料液比与提取时间和提取时间与提取温度的等高线图呈现圆形,表明二者交互不显著(图4c、4e),与方差分析结果一致。如图4b、4d 和4f 所示,它们的响应面上的峰值也同时存在于它们的最小椭圆中,表明在所选范围内存在极值。三维响应面图和等高线图如图4a~4f 所示,最佳提取条件为:提取时间1.02 h,提取温度75.36 ℃,料液比1:31.33 g/mL,多糖得率最高为11.86%。与其它食用菌多糖提取率相比,采用超声辅助提取的块菌多糖提取率为7.17%[34],采用水浴提取杏鲍菇和长根菇多糖,得率分别为5.4%和5.85%[35-36]。因此,本研究所采用的方法能显著提高多糖的提取率。
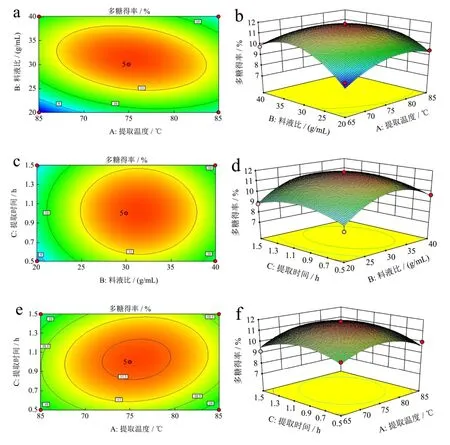
图4 料液比和提取温度(a,b)、提取时间和料液比(c,d)、提取时间和提取温度(e,f)对多糖得率的响应面图和等值线图Fig.4 Response surface plot and contour plot of material liquid ratio and extraction temperature (a,b),extraction time and material liquid ratio (c,d),extraction time and extraction temperature (e,f) on the yield of polysaccharides
2.2.3 云南黑松露粗多糖提取试验的验证
根据对试验数据以及得到模型的整理分析,得出最大响应值为11.86%,通过软件对响应面结果进行优化分析,得出黑松露粗多糖提取的最佳条件为:水浴温度为75.36 ℃,料液比为1:31.32 g/mL,提取时间为1.02 h。为了验证该条件的可靠性,需完成三次平行验证试验,将水浴温度修改为75 ℃,提取时间修改为1 h,料液比修改为1:31 g/mL,三次试验得到的平均得率为11.79%,与理论预测值的相对误差为0.07%。通过验证试验得到的数据与响应面设计的预测值相差不大,说明该模型可靠,可信度较高,适用于黑松露粗多糖提取工艺的优化。
2.3 黑松露粗多糖的纯化
采用Sevag 法脱去黑松露粗多糖中的蛋白质,浓缩后透析,得到除去杂质的黑松露粗多糖,最后测定多糖的蛋白含量为2.23%,说明黑松露粗多糖经过前处理,蛋白质基本上已经除去。黑松露粗多糖多酚含量为0.49%,表明黑松露粗多糖几乎不含多酚不会对后续抗氧化实验产生干扰。如图5 所示,根据DEAE-Sepharose快速流动柱的洗脱曲线,得到四个峰(TSP-1、TSP-2、TSP-3 和TSP-4)。对四个组分收集、浓缩、透析、冻干后,进行多糖活性试验(TSP-4 含量最低的组分除外)。

图5 黑松露粗多糖经DEAE-Sepharose 快速流动柱的梯度洗脱曲线Fig.5 Stepwise elution curve of crude TSP on DEAE sepharose fast flow column
2.4 黑松露多糖单糖组成分析
黑松露多糖离子色谱图如图6 所示。将多糖样品的离子色谱图谱与混合单糖标准品的离子色谱图谱比对确定样品的单糖组成;分别记录各组成单糖的峰面积,由面积归一法计算各单糖组成摩尔比[37]。结果表明,TSP-1 的单糖组成为盐酸氨基半乳糖、葡萄糖和甘露糖,比例为2.8:77.1:20(图6b);TSP-2 为鼠李糖、盐酸氨基葡萄糖、半乳糖、葡萄糖和甘露糖,比例为18.7:1.5:2:40.6:37.3(图6c);TSP-3 为鼠李糖、盐酸氨基葡萄糖、葡萄糖、甘露糖、葡萄糖醛酸和半乳糖的比例为13:3.5:58.4:21.1:2.7:1.2(图6d)。TSP-1、TSP-2和TSP-3 的主要成分均为葡萄糖。TSP-2 和TSP-3 中含有盐酸氨基葡萄糖,TSP-3 中只含有葡萄糖醛酸。


图6 16 种标准单糖(a)和TSP-1(b)、TSP-2(c)、TSP-3(d)组分单糖的离子色谱图Fig.6 The ion chromatograms of 16 standard monosaccharides(a) and component monosaccharides released from TSP-1 (b),TSP-2 (c) and TSP-3 (d)
2.5 黑松露多糖的体外抗氧化活性
2.5.1 不同组分黑松露多糖对DPPH 自由基清除活性的影响
研究了不同浓度的Vc、Crude TSP、TSP-1、TSP-2和TSP-3 对DPPH 自由基的清除活性,结果如图7 所示,TSP-3 在0~4 mg/mL 浓度下对DPPH 自由基有明显的清除作用,且呈浓度依赖性。与TSP-1 和TSP-3多糖相比,Crude TSP 和TSP-2 具有显著的清除活性。在4.0 mg/mL 浓度下,Crude TSP、TSP-1、TSP-2、TSP-3 和Vc 对DPPH 自由基的清除率分别为73.93%、36.67%、73.60%、54.10%和95.07%。对DPPH 自由基的清除能力依次为Vc>Crude TSP>TSP-2>TSP-3> TSP-1。李银莉等[38]研究表明纯化前后马齿苋多糖对DPPH 自由基的最大清除率分别为69.73%和64.54%,纯化前多糖对DPPH 自由基的清除率大于纯化后的多糖,原因可能是粗多糖中多酚等其他抗氧化物也对DPPH 自由基起到一定清除作用,所以黑松露多糖粗提物对DPPH 自由基具有良好的清除能力[39]。

图7 CrudeTSP,TSP-1,TSP-2 和TSP-3 的DPPH 自由基清除活性Fig.7 Seavenging activity of crudeTSP,TSP-1,TSP-2 and TSP-3 on DPPH radical
2.5.2 不同组分黑松露多糖对ABTS 自由基清除活性的影响
ABTS 氧化后形成稳定的蓝绿色ABTS+自由基,在734 nm 处有特征吸收峰[40]。加入黑松露多糖样品后,蓝绿色逐渐褪色或消失,吸光度值逐渐降低,从而判断其抗氧化活性。从图8 可以看出,浓度范围为0~4 mg/mL,样品和阳性对照(Vc)的清除率随浓度的增加而增加。当浓度为4 mg/mL 时,Crude TSP、TSP-1、TSP-2、TSP-3 和Vc 的清除率分别为60.47%、36.20%、41.87%、52.73%和94.87%。ABTS 的清除能力为Vc>crudeTSP>TSP-3>TSP-2>TSP-1。王晴等[41]人研究复合真菌多糖的DPPH与ABTS 自由基清除作用均在70%以上,其它研究表明,多糖对ABTS 自由基的清除能力与DPPH 自由基的清除能力具有一致性[42]。在本实验中,Crude TSP、TSP-1 和TSP-3 的ABTS表现出与DPPH 自由基清除能力相似的趋势。

图8 CrudeTSP,TSP-1,TSP-2 和TSP-3 的ABTS 自由基清除活性Fig.8 Scavenging activity of crude TSP,TSP-1,TSP-2 and TSP-3 on ABTS radical
2.5.3 不同组分黑松露多糖对金属螯合能力的影响
人体呼吸作用、一系列酶活性、氧转运和氧化还原反应都与铁离子有关。同时,铁离子非常活跃,可以促进许多重要分子的氧化[43]。因此,可通过测量其黑松露多糖里的自由基螯合Fe2+络合物,阻止·OH 的产生来反映其抗氧化能力(图9)。Crude TSP、TSP-1、TSP-2 和TSP-3 的金属螯合能力与EDTA-2Na 有一定差距,但仍有一定的金属螯合能力。在4 mg/mL 浓度下,Crude TSP 具有良好的金属螯合能力(61.63%),其次是TSP-2、TSP-3 和TSP-1(52.50%、43.17%和27.00%)。抗氧化剂的金属螯合能力与其官能团-OH、-SH、-COOH、C=O、-S-、-O-有关。Crude TSP、TSP-2和TSP-3 可能含有较多的官能团,但其具体作用机制有待进一步研究[44]。

图9 CrudeTSP,TSP-1,TSP-2 和TSP-3 的金属离子鳌合力Fig.9 Metalion chelating ability of crude TSP,TSP-1,TSP-2 and TSP-3
2.5.4 不同组分黑松露多糖对还原力测定的影响
天然产物的还原力也是评价其抗氧化活性的指标之一。不同组分黑松露多糖的还原能力如图10 所示,吸光度越高,还原能力越强。总的来说,在确定的浓度范围内,TSP-3 的还原能力随着浓度的增加而增强,但TSP-3的还原能力明显高于其他样品。在4.0 mg/mL浓度下,Crude TSP、TSP-1、TSP-2 和TSP-3 的吸光度分别为0.39、0.34、0.28 和0.56。本文测定黑松露多糖的还原力与吴金松等人[45]研究信阳毛尖茶末多糖的还原力趋势相似,其最大吸光值为0.536。

图10 CrudeTSP,TSP-1,TSP-2 和TSP-3 的还原能力Fig.10 Reducing power of crude TSP,TSP-1,TSP-2 and TSP-3
3 结论
采用超声波辅助水浴醇沉法提取黑松露粗多糖,为确定黑松露粗多糖的最佳提取工艺,在单因素实验的基础上,采用Box-Behnken 法设计了三因素三水平,以粗多糖的提取率为响应值进行响应面分析。提取率为11.79%。以DEAE-Sepharose 快流动柱为基础,得到了TSP-1、TSP-2 和TSP-3 三种主要组分。离子色谱显示TSP-1 由盐酸氨基半乳糖、葡萄糖和甘露糖组成。TSP-3 中含有鼠李糖、盐酸氨基葡萄糖、葡萄糖、甘露糖、葡萄糖醛酸和半乳糖,而TSP-2 中不含葡萄糖醛酸。Crude TSP、TSP-1、TSP-2 和TSP-3 具有较强的清除DPPH 自由基、ABTS 自由基的清除能力,有一定的金属螯合能力与还原能力。Crude TSP 的抗氧化活性最好,这可能与粗多糖中其它抗氧化剂的含量有关。其中TSP-3 还原力优于粗多糖,推测纯化后含量最高的TSP-3 含有一定量的盐酸氨基葡萄糖与葡萄糖醛酸,可以与产生·OH 等自由基所必需的金属离子络合,使羟自由基的产生受到抑制,还原力增强。同时,TSP-2 和TSP-3 的抗氧化活性均优于TSP-1。本研究为进一步对黑松露多糖的分离纯化、结构鉴定、功能活性深入研究奠定了基础,也为黑松露相关食品和药物的开发与应用提供了理论依据。

