CeF3 改性2LiNH2-MgH2-0.1LiBH4 材料的储氢性能
王媛媛,孙焕军,吴宇浩,刘海镇,李寿权,葛红卫,王新华
(1.浙江大学材料科学与工程学院/硅材料国家重点实验室,浙江杭州 310027;2.广西大学物理科学技术学院,广西南宁 530004)
1 前 言
人类的生存和发展离不开能源。如今应用广泛的化石燃料已引起了严重的环境污染,且将近枯竭。氢能是可再生、无污染的重要二次能源,而氢的储存是氢能在实际应用环节中的瓶颈之一[1-2]。近年来,由Li、Na、Mg、N、B等摩尔质量较小的元素组成的化合物及其复合物,如Mg H2、LiBH4、LiNH2-Mg H2等,由于其较高的质量储氢密度在固态储氢领域中得到了广泛的研究[3,6]。2002年,陈萍等[7]首次提出了金属氢化物和金属氨基化合物作为储氢材料的概念,他们发现LiNH2-Li H 的混合物在200 ℃以下能够释放约6.3 wt%的氢气,但是该体系放氢平衡压力达到1 bar所需的温度高达280 ℃[7-8]。为了改善其放氢动力学和热力学性能,Luo等[9]将该体系中的Li部分替换成了电负性更高的Mg,构成了2LiNH2-Mg H2储氢体系。通过范特霍夫方程可以计算得到,该体系放氢平衡压力达到1 bar所需的温度约为90 ℃,并且其理论储氢容量可以达到5.6 wt%,循环性能也较为优异。
由于Li-Mg-N-H 体系的动力学壁垒较高,导致在实际放氢过程中,其起始放氢温度高达130℃,并且在200 ℃以上才能快速地吸放氢[10]。近年来,在Li-Mg-N-H 系储氢材料的催化改性中,碱金属化合物、金属硼氢化物以及过渡金属化合物等[11-13]催化剂具有较为优异的效果。Lewis等[14]将LiBH4引入到2LiNH2-Mg H2体系中,发现LiNH2和LiBH4反应生成Li4(BH4)(NH2)3,该产物会发生融化并且会和Mg H2在低温下生成晶种Li2MgN2H2。这种“自催化”反应极大地降低了体系的放氢温度。Hu等[15]将LiBH4的摩尔比降低到0.1,发现相对于Li-Mg-N-H体系,该体系放氢平台压力达到1 bar所需要的温度降低了20~70 ℃。过渡金属及其衍生物,如Fe Ti[16]、ZrCo[17]和LaNi5[18],在2LiNH2-Mg H2-0.1LiBH4体系中可以阻碍放氢过程中的晶粒长大,同时作为催化剂也可以降低体系的放氢活化能。
金属铈及其化合物作为一种催化剂,被广泛应用于多相反应中,这源于其多价态的特性。在储氢材料领域中,CeF3作为催化剂可以有效地降低LiNH2-Li H、LiBH4、Mg H2等储氢材料体系的放氢温度和放氢活化能[19-21]。 本课题组在 2LiNH2-Mg H2-0.1LiBH4体系(以下简称Li MgBNH 体系)的基础上引入了CeF3,研究发现添加6 wt% CeF3改性效果最佳。因此,本研究以CeF3添加量为6 wt% 的Li MgBNH 作为进一步的研究对象,研究了CeF3对LiMgBNH 体系储氢性能的改性作用及其机理。
2 实 验
2.1 试剂与仪器
实验所需的药品:LiNH2(Acros Organics,95%),LiBH4(Alfa Aesar,95%),Mg(Aladdin,99.5%),CeF3。
采用QM-3SP4型行星式球磨机制备储氢材料;采用实验室自制的Sieverts型吸放氢测试装置测定储氢材料的吸放氢性能;采用X'Pert Pro型X 射线衍射仪(XRD)和Tensor 27型红外光谱分析仪(FTIR)确定样品的物相结构;采用STA 449F5 型的热分析仪(TG-DSC)对样品放氢过程中的热效应进行分析。实验过程中的所有操作都在密封环境下或在水和氧含量低于1.00 mg·L-1的手套箱中进行。
2.2 实验方法
Mg H2是由镁粉先在350 ℃、5 MPa氢压下保温12 h,随后在400 r/min的转速、20∶1的球料比下球磨2 h,如此重复7次制备得到。储氢材料是将LiNH2、Mg H2和LiBH4以2∶1∶0.1的摩尔比混合,同时加入6 wt%的CeF3,并以400 r/min的转速、60∶1的球料比下球磨36 h制备得到。为了防止球磨过程过热导致组分分解,球磨时运行12 min,暂停6 min。每次称取约200 mg的样品,在0.01 bar的氢压下,从室温以2 ℃/min的升温速率升温至350 ℃,从而获得随温放氢曲线。恒温吸放氢测试时,分别在0.01 bar 和10 MPa氢压下,以10 ℃/min的升温速率快速升温至指定的温度,并保温6 h。
3 结果与讨论
图1是Li MgBNH-6wt%CeF3样品在2 ℃/min的升温速率下测得的随温放氢曲线和氢信号(m/z=2)质谱(MS)曲线。从图1可见,添加CeF3的样品起始放氢温度约为100 ℃,比未添加样品降低了10 ℃。在温度低于180 ℃时,CeF3的添加改性效果比较明显,在相同温度下样品的放氢量显著增加,达到相同放氢量所需要的温度明显降低。但是,当温度超过180 ℃后,CeF3的作用效果已经不明显。添加CeF3的样品在同一温度下的放氢量比未添加CeF3样品放氢量有略微下降,这是由于CeF3本身不放氢,从而降低了体系的总放氢容量。添加CeF3的样品在220 ℃下可以放出约4.2 wt%的氢气,在220 ℃之后开始缓慢地放出氢气,并且在300 ℃下放氢总量达到约4.9 wt%。由图1(b)可见,未添加CeF3的样品在升温过程中一共有两个放氢峰,峰值温度分别为169 ℃和206 ℃,而添加CeF3之后,原来的两个放氢峰裂解为三个放氢峰,其峰值温度分别为146、175和211℃,其中第一个放氢峰的峰值温度比未添加CeF3的样品降低了23 ℃。这表明CeF3的加入显著降低了LiMgBNH 的放氢温度。
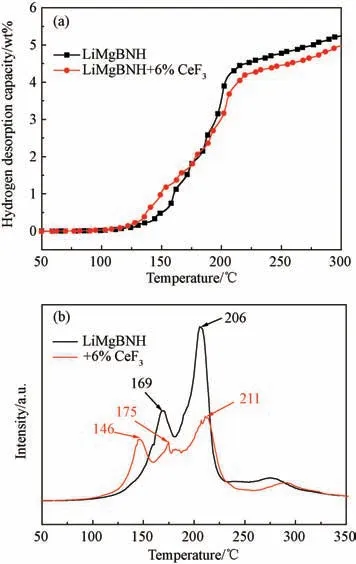
图1 样品LiMgBNH-6wt%CeF3 的随温放氢曲线(a)和氢信号质谱曲线(b)(升温速率为2 ℃/min)Fig.1 (a)TPD and(b)MS curves of LiMgBNH-6wt%CeF3
将LiMgBNH-6wt%CeF3样品快速升温至140、160和180 ℃并保温6 h,测定样品恒温放氢动力学性能,结果如图2所示。在放氢温度为180 ℃时,添加6 wt%CeF3的样品的线性放氢区域放氢速度是未添加CeF3的1.8倍,90 min内可放出约3.0 wt%的氢气,在6 h内可以放出约4.0 wt%的氢气。降低放氢温度到160 ℃时,样品放氢速度随温度降低有所降低,但是,添加CeF3的样品放氢速率与未添加CeF3样品放氢速率的差别显著增大,前者的线性放氢速率为0.155 wt% H2/min,是后者放氢速度的约2.5 倍。当继续降低放氢温度到140 ℃时,添加CeF3的样品的线性放氢区域放氢速率约为0.047wt% H2/min,是未添加CeF3样品的3.1 倍,但是当放氢时间超过150 min后,两者放氢速率大致相同。由此可见,CeF3对LiMgBNH 体系的放氢性能的改性作用在低温下更加显著。这一结果与图1结果吻合。
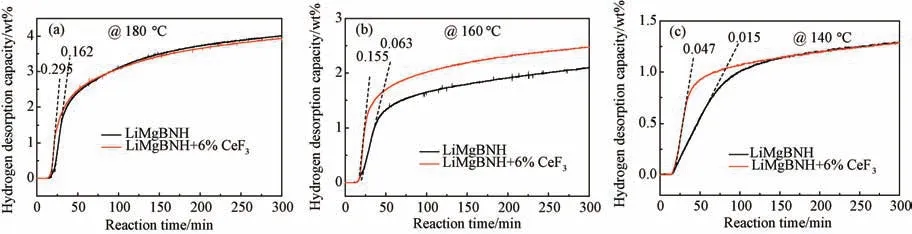
图2 LiMgBNH-6wt%CeF3 在140、160、180 ℃下的恒温放氢曲线Fig.2 Isothermal dehydrogenation curves of Li MgBNH-6wt%CeF3 at 140,160 and 180 ℃
图3 为添加CeF3和未添加CeF3的LiMgBNH样品在升温速率为2 ℃/min下的DSC 曲线。由图可见,未添加CeF3的LiMgBNH 样品在124 ℃附近出现了一个放热峰,该峰是由于LiBH4与LiNH2反应放热产生的[22]。同时,该样品在153 ℃和200 ℃附近出现了两个吸热峰,这两个吸热峰分别对应于图2中的两个放氢峰。而在LiMgBNH-6wt% CeF3样品的DSC曲线中没有出现放热峰,在138 ℃左右出现了一个吸热峰,并且在160~240℃区域内出现了一个较宽的吸热峰(峰值温度为204 ℃),与图2中放氢峰对比可知,这个宽峰中应该包括了两个放氢峰。这也说明了CeF3会阻碍LiBH4与LiNH2之间的反应,从而降低体系的放氢温度。
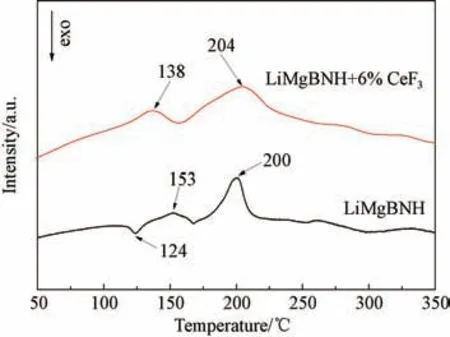
图3 LiMgBNH-6wt%CeF3 在升温速率为2 ℃/min条件下的DSC曲线Fig.3 DSC curves of LiMgBNH-6 wt%CeF3 at a heating rate of 2 ℃/min
图4是LiMgBNH-6wt% CeF3放氢后的样品在200 ℃、10 MPa氢压下的恒温吸氢曲线。在200 ℃下,添加CeF3的样品在线性吸氢区域的吸氢速率为1.0 wt% H2/min,是未添加CeF3的2 倍,这说明CeF3对于LiMgBNH 体系的吸氢性能也有显著改善作用。另外,两者的吸氢容量都能在30 min 内达到4.0 wt% 左右,可见该体系具有优异的可逆吸放氢性能。
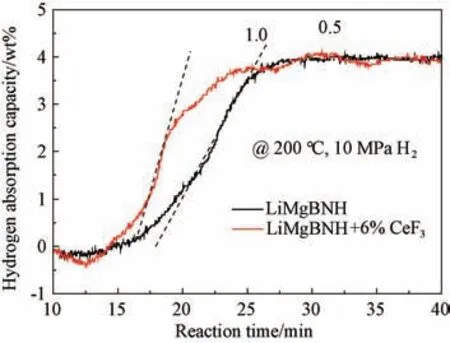
图4 样品LiMgBNH-6wt%CeF3 在200 ℃、10 MPa H 2 下吸氢曲线Fig.4 Isothermal hydrogenation curves of LiMgBNH-6 wt%CeF3 sample under 200 ℃and 10 MPa H 2
对LiMgBNH-6wt%CeF3进行吸放氢循环性能测试,其中放氢条件为180℃和0.01 bar,吸氢条件为220℃和10 MPa氢压,5次吸放氢循环曲线如图5所示。第一次放氢曲线在放氢初始阶段的放氢速率较快,但是在当放出1.8 wt%的氢气之后,放氢速率开始减慢。有研究表明,2LiNH2-Mg H2体系需要进行一次吸放氢来活化,一次循环后,它将转变为Mg(NH2)2-2LiH,再参与到可逆吸放氢中[23]。当第三次放氢时,放氢速率最快,随后的放氢中循环速率有较为缓慢的衰减,但是几乎都在200 min内放出了约4.0 wt%的氢气,并且在初始放氢的20 min内可放出全部放氢量的90%。随着循环次数的增加,样品吸氢曲线基本保持稳定,30 min内吸氢量可达到4.0 wt%。这说明添加CeF3的LiMgBNH 体系吸放氢循环性能较佳。
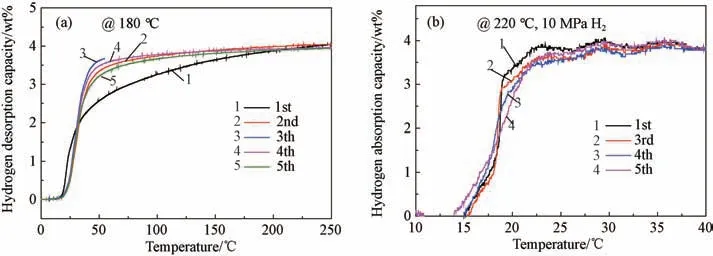
图5 LiMgBNH-6wt%CeF3 样品在180 ℃下的放氢曲线(a)和在220 ℃、10 MPa H 2 下的吸氢曲线(b)Fig.5 (a)The dehydrogenation curves at 180 ℃of LiMgBNH-6 wt%CeF3 and(b)the hydrogenation curves at 220 ℃and 10 MPa H 2
为了分析CeF3对Li MgBNH 体系吸放氢过程的作用机理,对球磨LiMgBNH-6wt% CeF3样品和在140 ℃、180 ℃、210 ℃、350 ℃下放氢后的样品进行FTIR 和XRD 分析,结果分别如图6和图7所示。从FTIR图谱(图6)发现,球磨样品与140 ℃放氢后的产物在3311和3257 cm-1处存在LiNH2的N-H 键吸收峰,另外,后者在3150~3180 cm-1附近存在一个宽峰,为放氢后生成产物的N-H 键吸收峰。并且,两者在2200 ~2400 cm-1之间都存在LiBH4的B-H 键的吸收峰,这说明LiBH4还没有或者只是少量地与其他组分产生了反应。由XRD 图谱(图7)可见,两者仅存在LiNH2和Mg H2的明显的衍射峰。当放氢温度为180 ℃时,FTIR 图谱显示在3301/3243、3194/3161和3176 cm-1处分别存在Li4(BH4)(NH2)3、Li2Mg2(NH)3和Li2Mg(NH)2的N-H 键的吸收峰,并且在3150 cm-1处存在一个较为微弱的未知相的吸收峰。结合XRD 图谱分析可以得出,在180 ℃下放氢后的产物主要为中间产物Li2Mg2(NH)3[19]和少量的Li2Mg(NH)2。有研究报道Li4(BH4)(NH2)3是LiBH4与LiNH2反应生成的产物,该产物会在LiNH2和Mg H2的放氢过程中充当催化剂以削弱NH 键的键能[11],但是在140 ℃时并没有检测到Li4(BH4)(NH2)3,这也说明CeF3会阻碍LiBH4与LiNH2之间的反应。继续升温至210 ℃,FTIR 图谱中Li2Mg2(NH)3的吸收峰被3301/3176 cm-1处的Li2Mg(NH)2吸收峰取代。但是当加热到350 ℃,只有在3167 cm-1处出现了Li2NH 的吸收峰,并没有任何B-H 键的吸收峰。结合XRD 图谱分析说明当温度达到350℃时,Li4(BH4)(NH2)3和大量Li2Mg(NH)2发生了分解。综上所述,在低于180 ℃的温度范围内CeF3对LiMgBNH 体系放氢性能改善作用显著,当温度高于180 ℃时,由于Li4(BH4)(NH2)3的生成,对LiMgBNH 体系放氢性能的改善作用占主导作用。
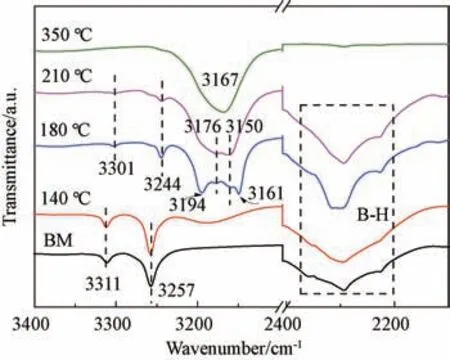
图6 Li MgBNH-6wt%CeF3 样品在不同温度下放氢后的FTIR 图谱Fig.6 FTIR curves of LiMgBNH-6wt%CeF3 after dehydrogenation at different temperatures
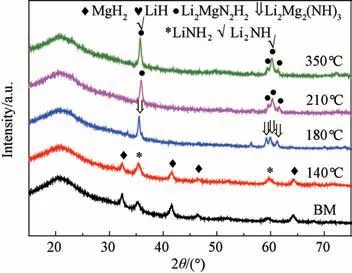
图7 LiMgBNH-6wt%CeF3 样品在不同温度下放氢后的XRD图谱Fig.7 XRD curves of Li MgBNH-6wt%CeF3 after dehydrogenation at different temperatures
4 结 论
本实验主要研究了CeF3对于LiMgBNH 体系储氢性能的影响,得到如下结论:添加6 wt%CeF3可显著改善2LiNH2-Mg H2-0.1LiBH4体系的吸放氢性能,样品起始放氢温度比未添加CeF3样品降低了10 ℃;放氢过程中存在三个峰值温度;添加6 wt%CeF3后,样品第一峰值放氢温度降低了23 ℃。在140 ℃时,添加CeF3样品的线性放氢区域放氢速率是未添加CeF3样品的3.1倍。Li MgBNH-6wt% CeF3样品具有良好的吸放氢循环性能。在低于180℃温度范围内CeF3对LiMgBNH 体系放氢性能的改善作用显著,当温度高于180 ℃时,Li4(BH4)(NH2)3的生成对LiMgBNH 体系放氢性能的改善占主导作用。

