小麦EPF/EPFL基因家族的全基因组鉴定及TaEPF1-2B与气孔性状的关系分析
魏 迪,常 平,刘佳熠,杨 阳,张 璇,陈 亮,胡银岗
(西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
气孔发育是调控植物抗旱、耐热等逆境胁迫的关键因素,改变气孔性状可以在一定程度上提高植株的光合作用和水分利用效率[1-2]。EPF/EPFL基因家族是调控气孔发育的重要因子,鉴定并分析小麦EPF/EPFL家族基因的表达特性,有助于探究其在小麦气孔发育中的作用,为改良小麦抗旱节水性提供参考。EPF/EPFL基因家族编码一类植物中特有的小分子量分泌型多肽,部分家族基因参与气孔早期发育过程并能够调节气孔密度[3-4],除此之外,EPF/EPFL基因还参与调控植物花序结构、叶片形态及介导花粉管伸长等形态建成过程[5-6]。EPF/EPFL基因家族在拟南芥(Arabidopsisthaliana)[3,7]、小立碗藓(Physocomitrellapatens)[8]、大麦(Hordeumvulgrae)[9]、水稻(Oryzasativa)[10]、玉米(Zeamays)[10]等植物中都已得到了系统鉴定。在禾本科作物中,玉米ZmSTOMAGEN(ZmEPFL9)基因正调控玉米气孔发育,在光照强度增强及干旱胁迫下其表达量均提高[11-12]。前人研究发现,异源过表达大麦HvEPF1[9]、水稻OsEPF1和OsEPF2[10]、小麦TaEPF1B和TaEPF2D[13]均导致拟南芥气孔密度显著下降。Yin等[14]和Caine等[15]分别对水稻OsEPFL9基因进行敲除和RNAi干扰,结果均导致水稻叶片气孔密度显著降低,而过表达OsEPFL9则使水稻叶片气孔密度激增[15]。Dunn等[13]研究发现,在小麦中过表达TaEPF1B基因可降低气孔密度,提高水分利用效率。其他学者在水稻[15]、大麦[9]、马铃薯(Solanumtuberosum)[16]及杨树(PopulusL.)[17]的研究中也得到了类似结果,说明过表达EPF/EPFL基因可以在植株发育初期适当降低气孔密度,使其在保持光合作用的同时减少蒸腾和水分散失,从而提高植株的耐旱性和水分利用效率。Sun等[18]研究发现,过表达TaEPFL1使转基因拟南芥花丝缩短、角果发育异常,从而影响雄蕊发育。小麦EPF/EPFL基因虽有报道[13,18],但主要集中在与气孔发育相关的TaEPF1、TaEPF2和TaEPFL9以及与雄蕊发育有关的TaEPFL1的功能研究,而对小麦EPF/EPFL家族的系统鉴定及表达分析等基础研究还未见报道。TaEPF1可负调节气孔密度,但该基因与气孔微观性状的关系尚不清楚。
本研究对小麦EPF/EPFL家族基因进行全基因组水平的鉴定,比较其与祖先种乌拉尔图小麦(Triticumurartu)和粗山羊草(Aegilopstauschii)EPF/EPFL家族成员的共线性关系,分析其基因、蛋白结构及系统进化,并基于转录组数据及qRT-PCR分析其时空表达特性及其对非生物胁迫的响应特征,并对24个小麦品种的TaEPF1-2B单倍型与气孔性状的关系进行分析,以期为进一步解析小麦EPF/EPFL家族基因在小麦生长发育,特别是干旱等逆境胁迫下的功能奠定基础。
1 材料与方法
1.1 小麦EPF/EPFL基因家族的全基因组鉴定及蛋白理化性质分析
从Ensembl Plants(http://plants.ensembl.org/index.html/)下载拟南芥11个EPF/EPFL蛋白序列,其中,EPF1~EPF2、EPFL1~EPFL8的保守结构域为EPF(PF17181),EPFL9的保守结构域为Stomagen(PF16851)。利用BLASTP和hmmsearch程序分别在最新版中国春小麦基因组数据库(ftp://ftp.ensemblgenomes.org/pub/plants/release-51/fasta/triticus-aestivum)中搜索TaEPF/EPFL转录本(E值<1e-10),合并两种方法得到蛋白序列,去除冗余序列。使用Pfam(http://pfam.xfam.org/)和NCBI-CDD(https://www.ncbi.nlm.nih.gov/cdd)对候选蛋白进一步鉴定,最终获得小麦EPF/EPFL基因家族成员,基于染色体位置及与拟南芥EPF/EPFL的同源关系进行命名。使用SignalP(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽,利用CropPAL(https://crop-pal.org/)进行蛋白亚细胞定位,利用ProtParam(https://web.expasy.org/protparam/)预测家族蛋白的理化性质。
1.2 小麦EPF/EPFL基因及其编码的蛋白结构分析
利用GSDS 2.0(http://gsds.cbi.pku.edu.cn/)分析基因结构。使用MEME在线程序(http://meme-suite.org/tools/meme)分析家族蛋白的保守基序,基序数量设置为10。利用Pfam分析保守结构域。使用TBtools软件整合作图。
1.3 小麦与其祖先(粗山羊草、乌拉尔图小麦)EPF/EPFL基因的共线性分析
以拟南芥EPF/EPFL蛋白作为种子序列,使用Triticeae Multi-omics Center(http://202.194.139.32/)的BlastP程序对小麦祖先种粗山羊草和乌拉尔图小麦进行序列比对,获得其EPF/EPFL基因信息,利用OrthoFinder 2分析基因直系同源关系。使用Circos程序绘制基因在染色体上的位置分布以及小麦、粗山羊草和乌拉尔图小麦的共线性图谱。
1.4 EPF/EPFL基因家族系统进化树的构建
从 Ensembl Plants下载拟南芥、水稻和玉米的EPF/EPFL蛋白序列。用MEGA 7.0的Clustal_W程序进行序列多重比对,采用最大似然法(maximum likelihood,ML)构建进化树,Bootstrap值为1 000,生成的进化树利用iTOL(http://itol.embl.de/)进行美化。
1.5 TaEPF/EPFL基因的表达模式分析
利用小麦表达数据库ExpVIP(http://www.wheat-expression.com/)获取TaEPF/EPFL基因在根(胚根、根)、茎(茎轴、茎秆、穗下茎)、叶(叶片、叶鞘)、穗、雌蕊、雄蕊和籽粒在不同发育阶段(幼苗期、营养生长阶段、生殖生长阶段)的转录组数据;利用小麦表达数据库WheatExp (https://wheat.pw.usda.gov/WheatExp/)获取其在干旱、高温(37 ℃)、旱热和冷胁迫(4 ℃)下的转录组数据;对TPM (transcripts per kilobase million)值进行log2转化并使用TBtools软件绘制热图。
1.6 TaEPF/EPFL基因对干旱胁迫的响应 分析

1.7 TaEPF1-2B的功能标记开发及其不同单倍型与气孔性状的差异检验
TaEPF1及TaEPF2能够负调控气孔密度[13],根据小麦表达数据库ExpVIP,选取表达量较高的TaEPF1-2B及TaEPF1-2D,利用Oligo 7软件设计基因组特异性引物(表1),扩增目的片段纯化回收后连接PMD18-T载体,连接产物转化DH5ɑ感受态细胞,挑单克隆送样测序,测序结果使用DNAMAN软件进行序列分析。根据测序结果,开发TaEPF1-2B外显子276位处插入缺失(InDel)标记InDel-Ex276(表1),采用两轮扩增进行检测。PCR扩增体系均为10 μL,包括2×Es Taq Master Mix 5.0 μL,上、下游引物各0.4 μL,模板DNA 0.7 μL,无菌超纯水3.5 μL。第一轮扩增程序:94 ℃ 2 min;94 ℃ 30 s, 60 ℃ 30 s,72 ℃ 22 s,34个循环;72 ℃ 2 min。第二轮扩增以稀释100倍后的第一轮扩增产物(引物为1-2B)为模板,引物为InDel-Ex276,扩增体系同上。第二轮扩增程序:94 ℃ 2 min;94 ℃ 30 s, 60 ℃ 30 s,72 ℃ 10 s,34个循环;72 ℃ 2 min。扩增产物利用8% PAGE凝胶分离检测,银染显带。根据TaEPF1-2B的功能标记检测结果对小麦材料分型。
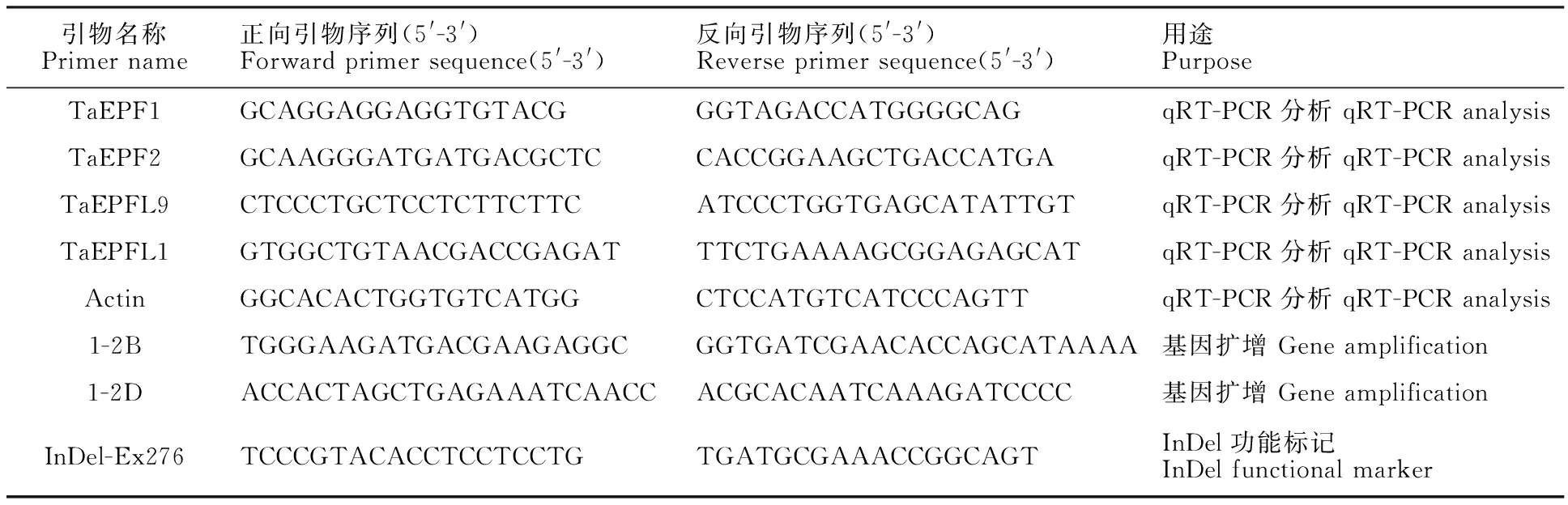
表1 本研究所用的引物Table 1 Primers used in this study
供试材料(表2)于2019年10月初播种于西北农林科技大学旱区节水农业研究院试验田(北纬34°20′,东经108°24′)。每个品种播种5行,行长1.5 m,行距25 cm,株距3.3 cm。播种前施用复合肥料(N∶P2O5∶K2O比例为20∶18∶5)750 kg·hm-2,冬季补充灌溉一次,适时除草,开花期喷施杀菌剂和杀虫剂,以预防病虫害。小麦灌浆中期,采用LI-6400(LI-COR公司,美国)便携式光合仪测定净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、和胞间CO2浓度(Ci)。测量选择在晴朗少风的上午9:00-11:30进行,采用内置红蓝光源,光强设置为1 200 μmol·m-2·s-1,每个品种选取3片生长一致且无病虫害的旗叶进行测量。同时,取样测定气孔性状,将所取的旗叶中部叶片置于FAA固定液中保存,每品种6个重复,采用刮取法[19]制作旗叶下表皮临时装片,置于光学显微镜下观察拍照,使用Image J软件统计气孔密度、气孔长度、气孔宽度和气孔面积。采用SPSS 22.0对单倍型数据进行T检验,分析不同单倍型间差异的显著性。

表2 24个供试小麦品种的名称Table 2 Name of 24 tested wheat cultivars
2 结果与分析
2.1 TaEPF/EPFL基因家族成员的鉴定及蛋白理化性质分析结果
根据拟南芥EPF/EPFL蛋白序列及其保守结构域(PF17181和PF16851),利用BLASTP和hmmsearch程序在最新中国春小麦基因组数据库中搜索(E值<1e-10),分别获得64个和38个转录本序列,合并去冗余序列后,最终鉴定得到6个TaEPF基因和29个TaEPFL基因。根据聚类结果,参考与拟南芥EPF/EPFL的同源关系进行基因命名(表3)。
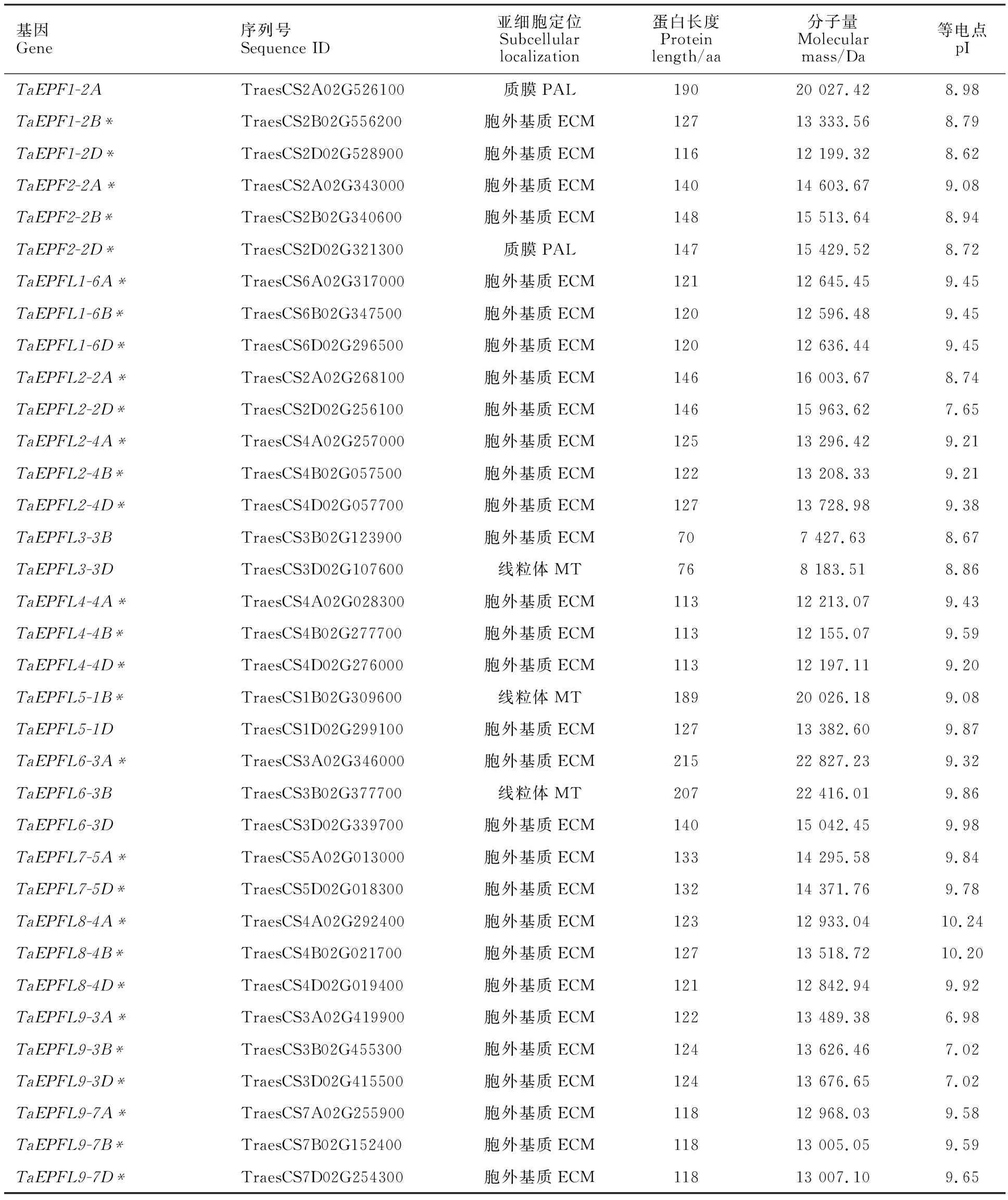
表3 35个小麦TaEPF/EPFL基因的基本信息Table 3 Basic information of 35 wheat TaEPF/EPFL genes
TaEPF/EPFL家族基因的大小介于213~3 556 bp之间,编码的蛋白质序列长度为70~215 aa,分子量为7 427.63~22 827.23 Da,等电点为6.98~10.24,表明家族蛋白富含碱性氨基酸;82.9%的家族蛋白含有信号肽结构,绝大多数TaEPF/EPFL蛋白定位在胞外基质中,表明 TaEPF/EPFL蛋白可能作为一种胞外信号因子来发挥作用。
2.2 TaEPF/EPFL基因结构及蛋白保守基序分析
利用MEGA 7.0构建系统进化树(图1A),发现35个TaEPF/EPFL蛋白被聚为5组。基因结构分析结果(图1B)显示,TaEPF/EPFL基因家族外显子数目为1~4个,同一分支的基因结构具有一定的保守性,如TaEPFL9-3A、TaEPFL9-3B和TaEPFL9-3D均包含3个外显子,编码氨基酸长度为122~124 aa。
保守结构域分析结果(图1C)显示, TaEPF1~TaEPF2、TaEPFL1~TaEPFL8的保守结构域均为EPF,TaEPFL9的保守结构域为Stomagen。保守基序分析结果(图1C)显示,TaEPF/EPFL蛋白均包含2~4个motif结构,部分motif结构在家族基因中相对保守,也有一些motif在家族成员间表现出不同程度的特异性;例如,Ⅰ~Ⅳ组蛋白的C末端均包含motif 2,其中Ⅰ~Ⅲ组蛋白的保守结构域EPF包含motif 1和motif 2,第IV组的EPF保守结构域除包含motif 1和motif 2外,还包含motif 9,且部分motif 1被motif 8替代;motif 3、motif 5和motif 7仅在第V组中存在,Stomagen保守结构域仅由motif 3组成。TaEPF/EPFL家族蛋白在C末端存在6个相对保守的半胱氨酸残基,推测蛋白保守基序的差异可能是造成小麦EPF/EPFL家族功能多样性的原因。
2.3 小麦与祖先种EPF/EPFL基因的染色体分布及共线性分析
以拟南芥EPF/EPFL序列为种子序列,利用Triticeae Multi-omics Center的BlastP程序对小麦祖先种粗山羊草和乌拉尔图小麦进行比对,共获得12个粗山羊草AetEPF/EPFL基因和4个乌拉尔图小麦TuEPF/EPFL基因。利用Circos程序绘制TaEPF/EPFL在染色体上的位置分布及其与祖先种EPF/EPFL的共线性分析图(图2),发现TaEPF/EPFL分布在除1A、5B外的19条染色体上,基因数目在A、B、D三个同源染色体组上差异不大。TaEPF/EPFL在染色体上分布不平衡,大多位于染色体两端,且较为分散,没有成簇现象,基因间不存在串联重复。小麦祖先种粗山羊草和乌拉尔图小麦的16个EPF/EPFL基因在普通小麦基因组中均存在直系同源基因,且染色体位置对应,具有极高的共线性。表明小麦EPF/EPFL基因是从其祖先种进化而来。值得注意的是,TaEPF/EPFL在小麦A染色体组上存在11个基因,而在其祖先种A染色体组供体种乌拉尔图小麦中仅存在4个TuEPF/EPFL基因,其余未有对应关系的TaEPF/EPFL可能是通过B、D染色体组上的TaEPF/EPFL基因复制加倍形成。
2.4 EPF/EPFL蛋白的系统进化分析
对拟南芥(11个)、水稻(12个)、玉米(17个)和小麦(35个)的EPF/EPFL蛋白进行系统发育进化分析,结果(图3)显示,EPF/EPFL被分为5个亚组,每个亚组均包含拟南芥、水稻、玉米和小麦的EPF/EPFL。单子叶植物和双子叶植物的EPF/EPFL分布在同一分支,表明在双子叶和单子叶植物分化之前,EPF/EPFL家族就已形成。
2.5 小麦TaEPF/EPFL基因的时空表达模式
利用小麦表达数据库ExpVIP下载的小麦RNA-seq数据,比较TaEPF/EPFL基因在不同发育阶段(幼苗期、营养生长阶段、生殖生长阶段)的根(胚根、根)、茎(茎轴、茎秆、穗下茎)、叶(叶片、叶鞘)、穗、雌蕊、雄蕊和籽粒中的表达特性,结果(图4)发现,TaEPF/EPFL基因在籽粒和根中几乎不表达,大部分TaEPF/EPFL在雌蕊、叶鞘和茎尖分生组织中的表达量明显高于其他组织,总体表现为在幼嫩组织中表达量较高,例如,TaEPFL1-6D和TaEPFL9-3A在幼苗、第三叶和第五叶中均表达,但在旗叶中未检测到。大部分同源TaEPF/EPFL基因在发育过程中表现出相似的表达模式,例如TaEPFL2-4A、TaEPFL2-4B和TaEPFL2-4D在叶鞘、穗、雄蕊、雌蕊、柱头和子房中均表达,且在雄蕊中的表达量最高,柱头和子房次之;但也有例外,例如,TaEPFL9-3A和TaEPFL9-3D在幼叶、叶片、叶鞘和穗中均表达,而TaEPFL9-3B仅在叶鞘中特异表达。值得注意的是,部分TaEPF/EPFL基因在不同组织中未检测到表达量,可能是其本身的表达丰度较低,也可能是在小麦进化过程中发生了基因功能分化,从而导致基因的冗余和沉默。
2.6 小麦TaEPF/EPFL基因对非生物胁迫的响应
利用小麦公共表达数据库ExpVIP,分析TaEPF/EPFL基因分别响应干旱胁迫、高温 (37 ℃)胁迫、旱热胁迫以及低温(4 ℃)胁迫的表达模式,结果(图5)显示,14个TaEPF/EPFL基因响应干旱胁迫;11个基因响应高温胁迫,且大部分在高温胁迫6 h后上调表达;TaEPF/EPFL基因对旱热胁迫响应不明显;6个基因响应低温胁迫。
进一步选取TaEPF/EPFL基因家族中3个参与气孔发育的基因(TaEPF1、TaEPF2和TaEPFL9)[13]以及参与小麦雄蕊发育的基因 (TaEPFL1)[18],采用qRT-PCR分析其在中国春和抗旱小麦品种晋麦47的幼苗中对干旱胁迫(20% PEG6000)的响应。结果(表4)表明,在中国春中,TaEPF1在干旱胁迫1 h时的表达量迅速增加,随着胁迫时间的延长,表达量逐渐下降,在12 h表达量出现回升;而在晋麦47中,TaEPF1表现为对干旱胁迫响应不明显;TaEPF2在中国春和晋麦47中的表达模式相似,随着干旱胁迫时间的延长,表达量均呈现先上升后下降的趋势,分别在胁迫后9 h和6 h达到峰值,分别约为对照的 7.50倍和5.82倍;在中国春中,随着干旱胁迫时间的延长,TaEPFL9的表达量持续下降,胁迫6 h后维持在较低水平,而在晋麦47中,TaEPFL9的表达量在干旱胁迫下1 h时增加,之后迅速下降并低于初始对照水平;TaEPFL1在两个品种中对干旱胁迫的响应均不明显。总体来看,这4个基因在干旱胁迫下的表达模式与小麦表达数据库中转录组数据基本一致,但也存在一些差异,这可能是因为小麦品种和处理时期不同,公共表达数据库中所用小麦品种为TAM 107,且研究基于整株水平。

表4 部分TaEPF/EPFL响应干旱胁迫后的相对表达量Table 4 Relative expression of some TaEPF/EPFL genes to drought stress
2.7 TaEPF1-2B、 TaEPF1-2D序列多态性分析及其不同单倍型与气孔性状的相关性
根据小麦公共表达数据库ExpVIP的表达量数据,对高表达量基因TaEPF1-2B和TaEPF1-2D进行基因全长扩增及测序,结果显示,在24个小麦品种中,TaEPF1-2D未发现核苷酸多态性,而TaEPF1-2B存在7个变异位点(5个SNP,2个InDel),除276位6 bp的InDel及457位T/C的SNP位点之外,其余多态性位点均只在少数品种中检测到,属于稀有突变(表5),本研究未展开深入研究,且276位6 bp InDel及457位T/C SNP两个多态性位点紧密连锁。 红芒麦(编号23)和中国春(编号24)的TaEPF1-2B均不存在多态性。

表5 TaEPF1-2B编码区单核苷酸多态性Table 5 Single nucleotide polymorphisms of TaEPF1-2B gene
由于多态性位点紧密连锁,对276位的6 bp缺失突变开发InDel标记InDel-Ex276,在基因组特异引物(1-2B)的基础上进行二次扩增,可以将自然群体分为两种单倍型HapA和HapB(图6)。进一步将单倍型与24个小麦品种的气孔性状值和光合性状值进行T检验,结果(表6)显示,TaEPF1-2B不同单倍型的小麦性状间存在明显差异,其中气孔性状差异表现最为明显,单倍型HapA和HapB在气孔密度、气孔长度、气孔宽度和气孔面积上均存在极显著差异,单倍型HapA具有较低的气孔密度、较大的气孔长度、气孔宽度和气孔面积;两种单倍型的光合速率存在显著差异,单倍型HapA具有较高的净光合速率。

表6 TaEPF1-2B不同单倍型的气孔及光合性状Table 6 Stomata and photosynthetic traits between TaEPF1-2B haplotypes
3 讨 论
本研究在全基因组水平共鉴定到35个小麦EPF/EPFL基因,多于拟南芥(11个)[3]、水稻(12个)[10]、玉米(17个)[10]和大麦(11个)[9],这可能是由于普通小麦是由3种二倍体小麦天然杂交形成的异源六倍体,在进化过程中经历了全基因组复制事件,在A、B、D三个亚基因组上通常存在同源基因;通过与其祖先种的比较分析,表明其有良好的共线性。值得注意的是,小麦EPF/EPFL基因在染色体上并不存在串联重复现象,因此全基因组复制事件是导致小麦EPF/EPFL基因家族扩张的主要原因,这也可能是限制小麦EPF/EPFL基因家族数量的主要原因。TaEPF/EPFL家族蛋白的C端存在6个相对保守的半胱氨酸残基,在参与分子内二硫键的形成过程中发挥着重要作用[20];绝大多数EPF/EPFL家族蛋白的N端存在信号肽剪切位点,且亚细胞定位在细胞外基质中,推测其与拟南芥EPF/EPFL蛋白功能一致,为一类小分子分泌多肽,属于分泌途径,可能作为胞外配体与细胞膜上的受体相结合,从而传递胞外信号,推测其在细胞间信号传导过程中行使功能[21-22]。
系统发育进化分析表明,EPF/EPFL基因被聚类分为5个亚组,每个亚组均包含拟南芥、水稻、玉米和小麦的EPF/EPFL基因,表明其在小麦、拟南芥、水稻和玉米的进化过程中具有较高的保守性,其分化可能发生在植物的单子叶和双子叶分化之前。EPF/EPFL基因在小麦进化过程中非常保守,从二倍体到六倍体的演变中并未发生基因丢失现象,在小麦及其祖先种中存在较高的共线性,推断其在进化过程中可能受到强烈的进化约束,暗示EPF/EPFL家族基因功能的保守性,其可能在维持植物正常生理功能等基础信号转导途径中发挥重要作用。
大部分TaEPF/EPFL基因在小麦幼嫩组织和穗中表达,推测其可能在叶片、茎部和穗部形态建成初期发挥重要作用,这与拟南芥EPF/EPFL基因调控雄蕊和花序发育、影响气孔密度等功能相一致[3]。在干旱、高温等非生物逆境胁迫下,部分TaEPF/EPFL基因能够迅速做出响应,表明部分TaEPF/EPFL基因可能参与逆境胁迫应答。值得注意的是,少数TaEPF/EPFL基因在不同组织中均未检测到,究其原因,可能是由于EPF/EPFL这一类多肽激素一般作为胞外配体作用于各种发育途径的最上游,需要通过与细胞膜表面受体激酶结合启动下游级联信号来发挥作用[21],胞外信号传导因子的浓度一般较小,但可以通过细胞快速的特异调节来维持特定的浓度,这些检测不到表达量的基因是否通过复杂的应答调控机制来发挥特定功能还有待进一步探究。
进一步分析部分TaEPF/EPFL基因对苗期PEG模拟干旱胁迫的响应,发现在中国春和抗旱小麦品种晋麦47中,TaEPF1、TaEPF2、TaEPFL9和TaEPFL1对干旱胁迫的响应模式不同,在短期干旱胁迫下(1h),TaEPF1和TaEPFL9的表达量呈现相反的趋势,推测可能是由于品种抗旱性不同所导致,小麦在苗期受到干旱胁迫时,可能通过降低TaEPF1的表达水平以及提高TaEPFL9的表达水平来抵御干旱胁迫。气孔是植物与外界环境进行水气交换的重要通道,控制CO2及水分的进出,小麦叶片气孔密度及气孔大小对气孔导度有一定影响,间接影响植物的光合速率和蒸腾速率。Bhagwat等[23]研究表明,气孔密度是一种可遗传性状。本研究开发的标记InDel-Ex276可以根据TaEPF1-2B多态性位点将自然群体分为HapA和HapB两种类型,且HapA具有较低的气孔密度及较大的气孔面积,这与Khazaei等[24]报道的研究结果相一致。孟 雷等[25]对气孔性状与光合速率的关系进行探究,发现在水分充足和干旱条件下,气孔密度与植物叶片净光合速率分别呈正相关和负相关。不同学者对小麦气孔性状与干旱胁迫下水分利用效率的关系进行研究,结果均不一致。Wang等[26]发现,在干旱胁迫下气孔密度与水分利用效率呈正相关,这可能是由于除气孔外的其他特性对蒸腾和水分损失的影响;而Merah等[27]研究证明,干旱胁迫下硬粒小麦的气孔密度与水分利用效率呈负相关。HapA单倍型具有较低的气孔密度、较大的气孔面积及较高的光合速率,这种表型性状是否有利于小麦水分利用效率的提升及干旱环境的适应,还需要结合环境条件进一步深入探究。Dunn等[13]研究表明,小麦TaEPF1、TaEPF2与拟南芥EPF1、EPF2功能类似,在拟南芥中异源过表达TaEPF1-2B和TaEPF2-2D均可降低气孔密度,且在小麦中过表达TaEPF1-2B的植株表现出较低的气孔密度和较高的水分利用效率。这些均表明,TaEPF/EPFL基因在小麦气孔发育过程中发挥着重要调控作用,进而对叶片光合作用、蒸腾作用产生影响。因此,进一步深入揭示小麦EPF/EPFL家族基因的功能,可为提高小麦对非生物逆境胁迫的抗性以及改良小麦抗旱节水性提供新的靶标和候选基因。

