UPLC-MS/MS 分析牛肉红朱橘果皮发育期类黄酮组分特征
李文云,罗 怿,王小柯,林 乾,韩秀梅,陈永涛,李金强
(贵州省农业科学院果树科学研究所,贵州 贵阳 550006)
类黄酮是柑橘中重要的多酚类次生代谢物[1-2],如陈皮中的橙皮苷、柚皮芸香苷、川陈皮素、橘皮素、5-羟基-6,7,8,3,4′-五甲氧基黄酮和3,5,6,7,8,3′,4′-七甲氧基黄酮[3],化州橘红中的柚皮苷和野漆树苷[4],枳壳中的柚皮苷、新橙皮苷、枳属苷等[5],均具有较高的药用价值。此类化合物以C6-C3-C6为基本骨架,通过中央3 碳链互相连结而成,主要包括异黄酮、黄烷酮、黄酮醇、黄酮和花青素等[6],因其具有较强的抗氧化和清除自由基能力而被广泛关注。
研究表明,柑橘类黄酮的生物活性功能可能与其抗氧化作用有密切关系[7-8],如甜橙、柑和橘中含量丰富的具有较强抗氧化作用的橙皮苷;柚中含量丰富的柚皮苷对动脉粥样硬化、心血管疾病、糖尿病、神经退行性疾病、骨质疏松症和风湿病等具有显著疗效[9-10]。研究表明,类黄酮主要通过抑制前列腺素的生物合成、抑制磷酸二酯酶活性、减轻组胺释放等作用来发挥其药理作用[11-12]。类黄酮对人体具有重要的生物学功能,但人体不能直接对其合成,必须通过食物才能获得[13-14]。柑橘是人类膳食中类黄酮的主要来源之一,所以探究柑橘类黄酮积累特征具有十分重要的意义。
牛肉红朱橘(CitrusreticulataBlanco.‘Niurouhong’)由朱红橘(Citrus reticulata Blanco.‘Zhuhongju’)突变而来,是贵州省惠水县优良的地方品种,其果皮果肉因富含类胡萝卜素而呈诱人的橘红色[15-16]。牛肉红朱橘成熟果实富含多种抗氧化物质[17],但未见相关人员对果实发育过程中主要抗氧化物质类黄酮动态积累特征进行系统分析研究。本研究以贵州地方特色柑橘品种——牛肉红朱橘为研究对象,利用超高效液相色谱串联质谱仪(UPLC-MS/MS)检测其果实不同生长发育阶段果皮中黄酮变化水平、动态积累特征和含量差异,并对不同生长发育阶段类黄酮等差异代谢物进行筛选,以期为后期类黄酮合成路径上关键基因发掘以及功能性食品开发提供参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
牛肉红朱橘果实:采自贵州省惠水县烂坝林场,于不同生长发育阶段进行采样,即花后150 d(N1)、花后180 d(N2)、花后200 d(N3)、花后220 d(N4)、花后240 d(N5)。每次采收30 个果实,采完后立即送往实验室,用蒸馏水清洗干净,剥离外果皮后用液氮速冻,贮藏于-80 ℃超低温冰箱中备用。
甲醇、乙腈和乙酸均为色谱纯,购于德国默克公司。
1.1.2 仪器与设备
Shim-pack UFLC SHIMADZU CBM30A 超高效液相色谱,Applied Biosystems 4500 QTRAP 串联质谱,WatersACQUITYUPLCHSST3C18 色谱柱,DW-86L490超低温冰箱,LyoLab 3000 冷冻干燥仪。
1.2 方法
1.2.1 类黄酮提取
取冷冻干燥后的果皮样品研磨至细碎粉末,准确称取100 mg 粉末,溶解于1.0 mL 70%的甲醇溶液中,振荡混匀后于4 ℃冰箱中过夜,9 500 r/min 离心10min,移液枪吸取上清液,过0.22 μm 滤膜后待上样。
1.2.2 类黄酮检测
利用超高效液相色谱串联质谱进行检测。C18 色谱柱,配置ESI 涡轮离子喷雾接口,利用Analyst 1.6.3软件处理质谱数据。
检测方法:UPLC 设置参照Wang 等[18]的方法,水相为超纯水(含0.04%乙酸),有机相为乙腈(含0.04%乙酸)。流动相A 为超纯水(含0.04%乙酸),流动相B 为乙腈(含0.04%乙酸)。洗脱梯度为:0~11 min,由A∶B=95∶5 匀速线性梯度变化至A∶B=5∶95;11~12 min,A∶B=5∶95;12.1~15 min,A∶B=95∶5。流速为0.4 mL/min,柱温40 ℃,进样量5 μL,电喷雾离子源温度550 ℃,质谱电压5 500 V。色谱参数设置参照Chen 等[19]进行。
定性与定量分析:根据保留时间、质核比和代谢物数据库,对质谱数据进行定性分析,利用三重四级杆的多反应监测模式对代谢物进行定量分析。
1.2.3 数据分析
对类黄酮原始数据进行归一化处理后,利用R软件的偏最小二乘判别分析(Partial least squares discrimination analysis,OPLS-DA)模型绘制热图,并计算变量重要性投影值(Variable importance in project,VIP)。符合VIP≥1 且差异倍数≥2 或差异倍数≤0.5的物质为差异代谢物。利用KEGG 数据库对类黄酮差异代谢物进行注释。
2 结果与分析
2.1 牛肉红朱橘果皮类黄酮组分分析
利用UPLC-MS/MS 检测牛肉红朱橘5 个不同生长发育阶段的果皮,共得到206 种类黄酮;其中,N1和N2 阶段共检测到204 种,两者均未检测到矢车菊素-3-O-半乳糖苷和飞燕草素-3-O-乙酰葡萄糖苷;N3 和N5 共检测到206 种;N4 检测到205 种。检测到的物质主要包括黄酮、异黄酮、黄酮醇、查耳酮、黄烷酮、花青素等,其中有54 种获得KEGG 注释ID。热图分析结果见图1,从图1 可以看出,5 个不同生长发育阶段类黄酮含量存在明显差异,N1 和N2 大部分类黄酮丰度较高,热图上表现为红色,两者聚在一起;而N3、N4 和N5 类黄酮丰度较接近,大部分类黄酮丰度较N1 和N2 低,在热图上表现为绿色,三者距离较。
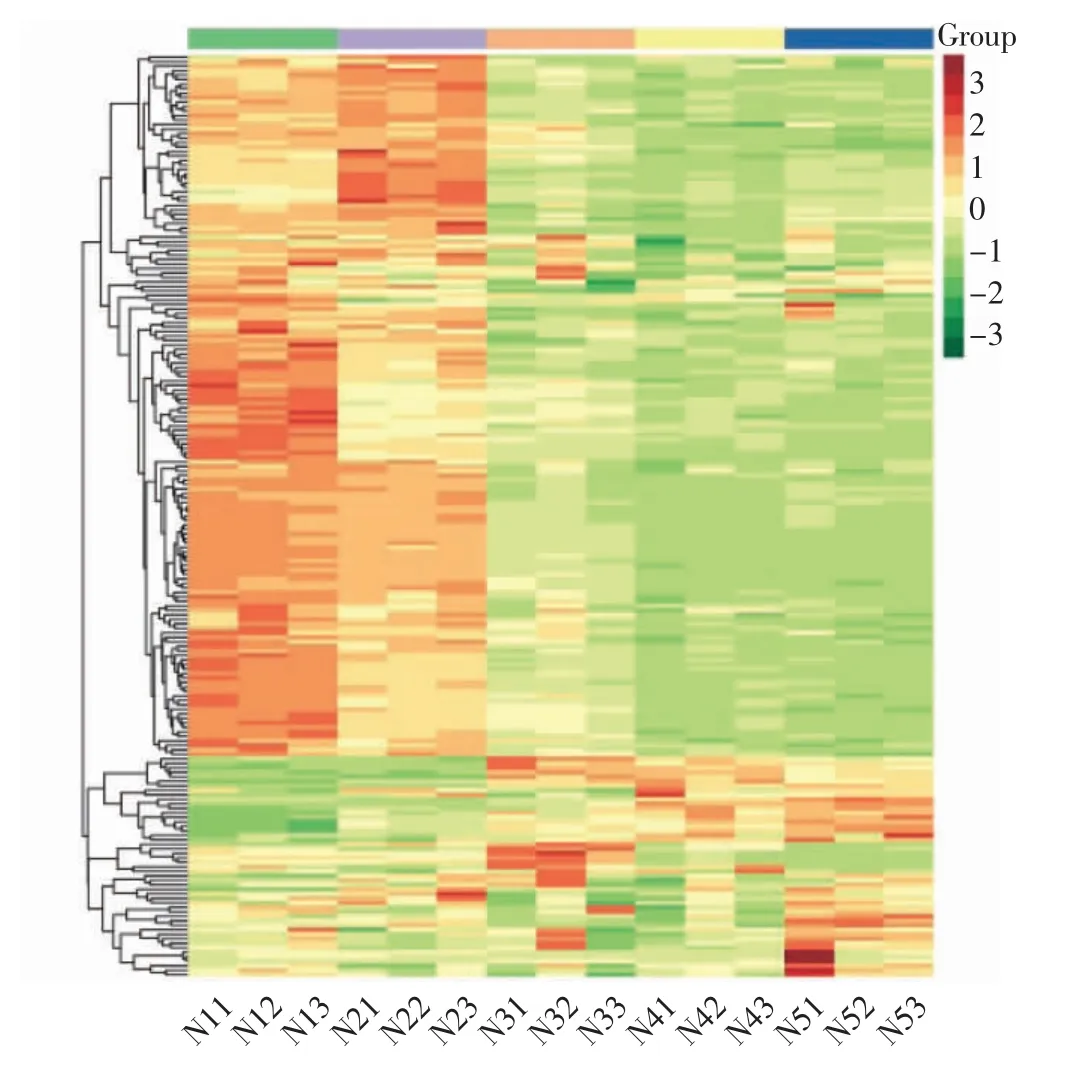
图1 不同生长发育阶段牛肉红朱橘果皮类黄酮相对丰度热图分析Fig.1 Heat map of flavonoid relative abundance in pericarp of‘Niurouhong’mandarin fruits at different development stages
2.2 牛肉红朱橘果皮类黄酮差异代谢物筛选分析
通过对不同生长发育阶段进行比较筛选到的差异物质信息见表1。N1 vs N2 筛选到11 个差异代谢物;N2 vs N3 筛选到的差异代谢物最多,共47 个代谢物;N3 vs N4 筛选到13 个代谢物;N4 vs N5 筛选到的差异代谢物最少,仅10 个。在果实生长发育期所检测到的大部分类黄酮含量随着果实逐渐成熟呈下降趋势,仅少部分物质如根皮素、根皮苷、芹菜素-3-O-鼠李糖苷、槲皮素-7-O-葡萄糖苷等呈上升趋势。N2~N3 是类黄酮含量变化的拐点时期,大部分物质如芹菜素、异野漆树苷、香叶木苷、木犀草素-7-O-葡萄糖苷、橙皮素-7-O-葡萄糖苷、5,6,7,4’-四甲氧基黄烷酮等,在N2~N3 表达丰度急剧下降,随后变化放缓,N2 vs N3 筛选到的差异物质也最多。

表1 牛肉红朱橘果皮不同生长发育阶段差异代谢物信息Table 1 Information on selected differential metabolites in pericarp of ‘Niurouhong’mandarin fruits at different development stages
N1 vs N2 筛选到的差异物质中橙皮素、4′,6-二羟基-5,7-二甲氧基黄烷酮、杨梅素-3-O-β-D-葡萄糖苷等5 个差异物质含量减少,芹菜素-3-O-鼠李糖苷、金合欢素-7-O-芸香糖苷、香叶木素-7-O-芸香糖苷等6 个差异物质含量增加。N2 vs N3 筛选到的差异物质中芹菜素、金合欢素、李属异黄酮等39 个差异物质含量减少,柚皮素-7-O-葡萄糖苷、根皮苷、矢车菊素-3-O-半乳糖苷等8 个差异物质含量增加。N3 vs N4 筛选到的差异物质中2,4,4′-三羟基查耳酮、5,7,8-三羟基-6-甲氧基黄酮、二氢槲皮素等11 个差异物质含量减少,山柰酚-4-O-β-D-吡喃葡萄糖苷和矢车菊素-3-O-半乳糖苷2 个差异物质含量增加。N4 vs N5 中橙皮素和柚皮黄素-3-O-(3-羟基-3-甲基戊二酸)-葡萄糖苷2 个差异物质含量减少,根皮素、芫花素和根皮苷等8 个差异物质含量增加。
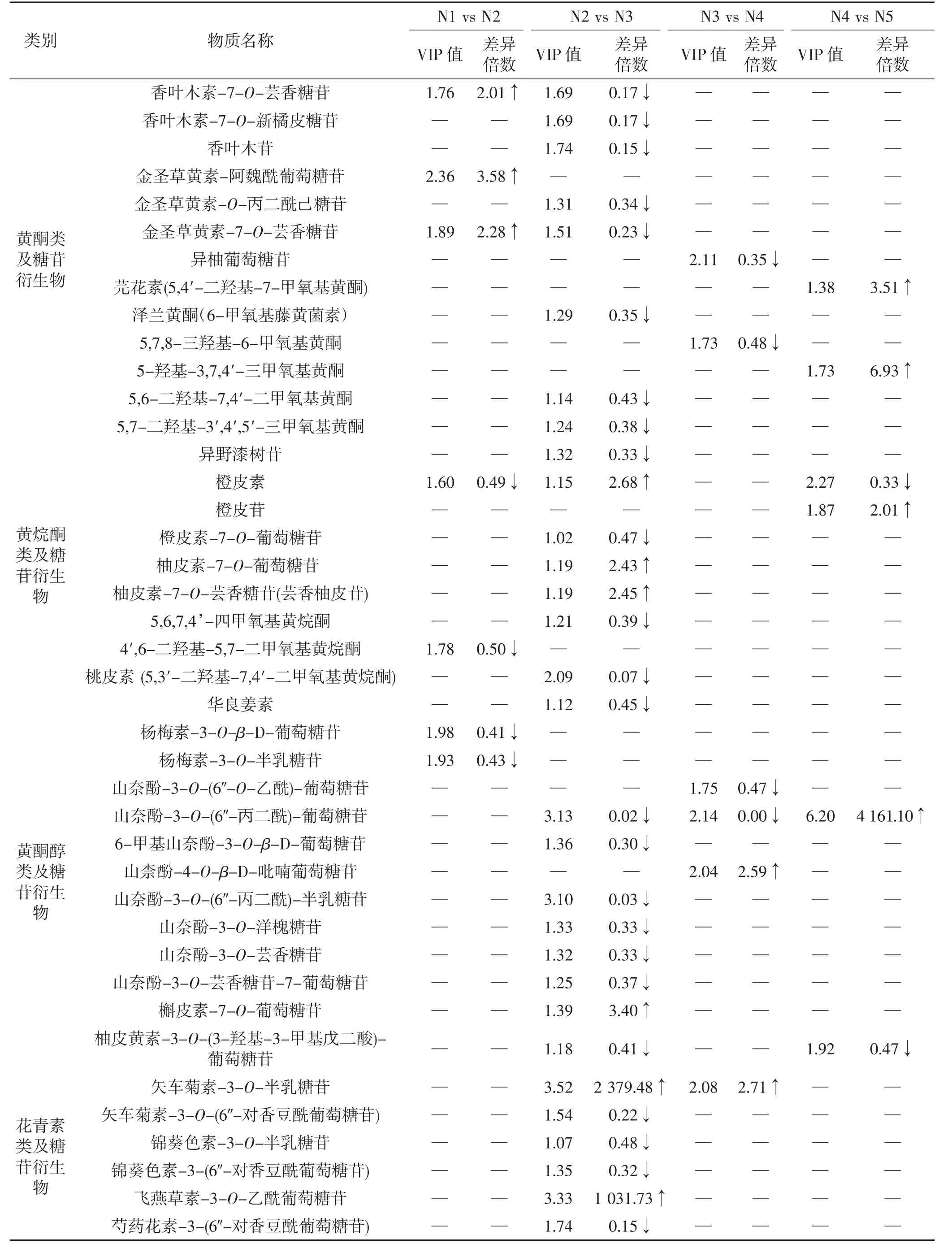
续表1 牛肉红朱橘果皮不同生长发育阶段差异代谢物信息Continue table 1 Information on selected differential metabolites in pericarp of ‘Niurouhong’mandarin fruits at different development stages
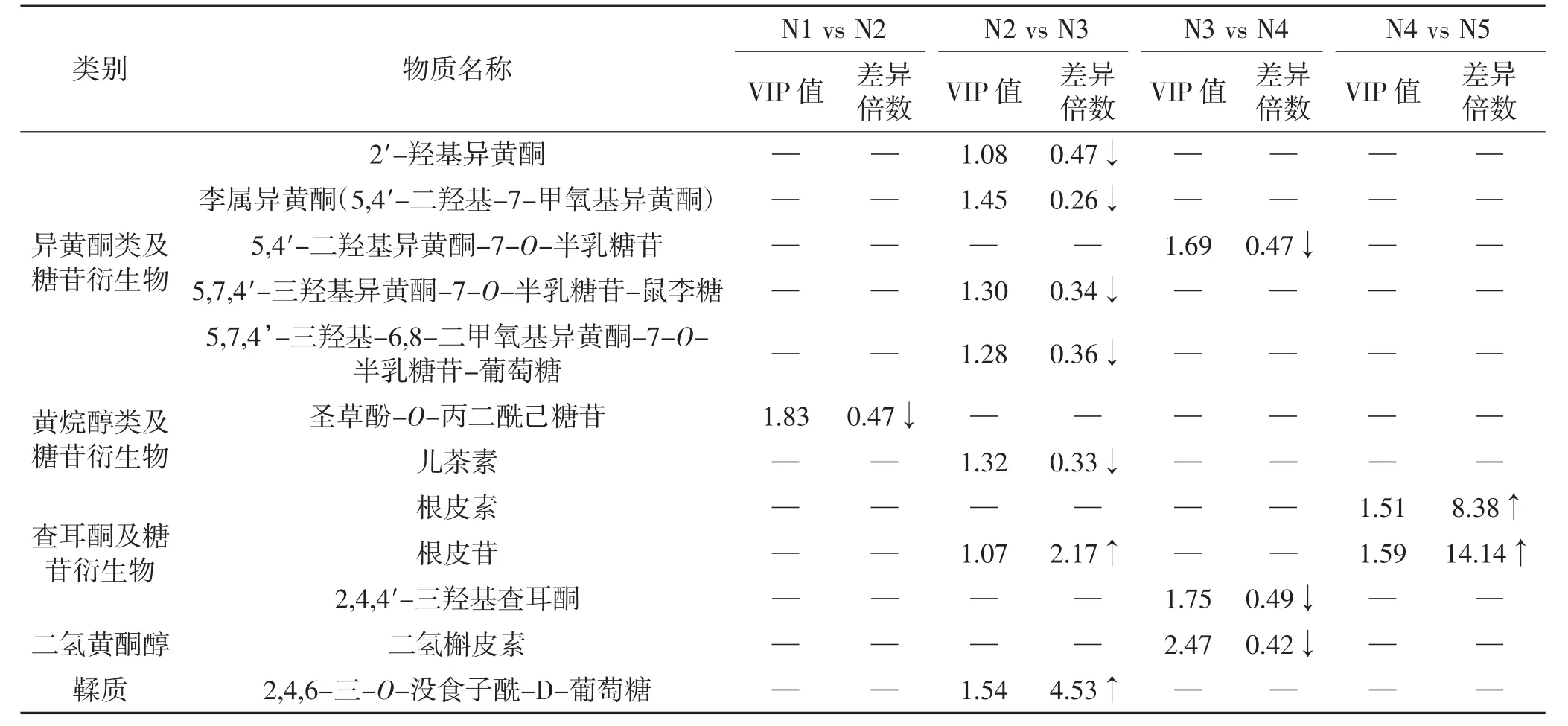
续表1 牛肉红朱橘果皮不同生长发育阶段差异代谢物信息Continue table 1 Information on selected differential metabolites in pericarp of ‘Niurouhong’mandarin fruits at different development stages
KEGG 注释分析结果(图2)表明,N1 vs N2差异代谢物A 仅富集于类黄酮合成(Flavonoid biosynthesis)通路。N2 vs N3 差异代谢物B 主要富集于异黄酮(Isoflavonoid biosynthesis)、黄酮和黄酮醇(Flavonoid and flavonol biosynthesis)、次生代谢(Bios-ynthesis of secondary metabolites)等7 条通路。N3 vs N4 差异代谢物C 主要富集于黄酮和黄酮醇,以及苯丙烷生物合成(Biosynthesis of phenylpropanoid)等5条通路。N4 vs N5 差异代谢物D 主要富集在类黄酮生物合成、黄酮和黄酮醇的生物合成和次生代谢生物合成3 条通路。以上4 组比较结果均涉及类黄酮生物合成通路,所占被注释代谢物总数的比例也较高,为37.5%~50%。从注释结果还可以看出N2 vs N3 涉及的代谢通路最多,也更为复杂。
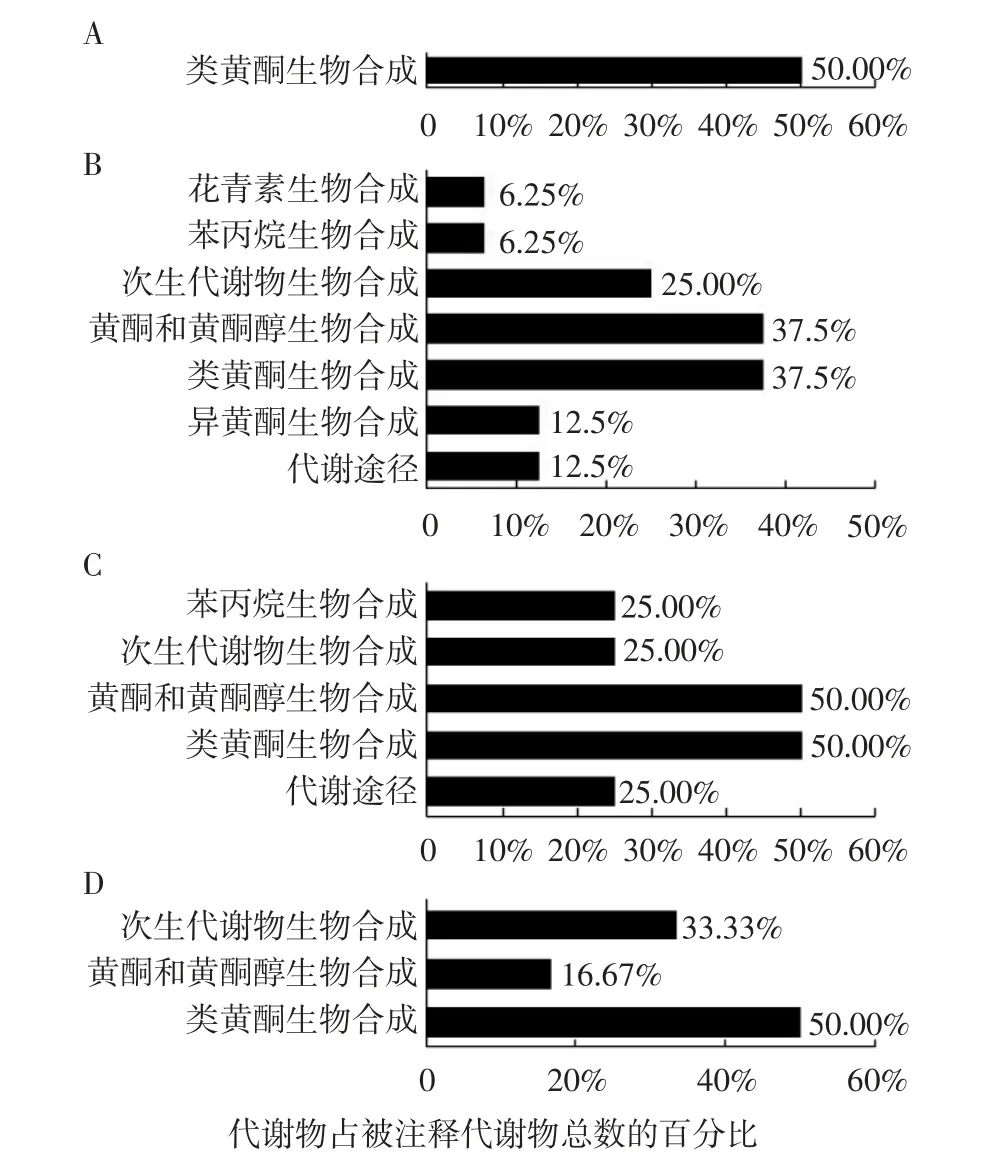
图2 牛肉红朱橘果皮差异代谢物KEGG 注释分类图Fig.2 KEGG annotation analysis of differential metabolites in pericarp of ‘Niurouhong’mandarin fruits
3 讨论与结论
类黄酮是一类重要的抗氧化物质,除了参与植物防御外,在人体健康方面也发挥着重要作用[20]。类黄酮生物合成来自于苯丙烷代谢途径,前体物质香豆酰辅酶A 和丙二酰辅酶A 在查尔酮合酶(Chalcone synthase, CHS)和查耳酮异构酶(Chalcone isomerase,CHI)催化下形成重要中间产物柚皮素,随后柚皮素和其衍生产物经过一系列酶促反应,并在葡萄糖苷转移酶、鼠李糖基转移酶、酰基转移酶、羟基转移酶、甲基转移酶等修饰下进一步糖基化、酰基化、羟基化、甲基化形成稳态苷类[21]。与类黄酮苷元相比,类黄酮形成稳态苷类后能够增加可溶性和稳定性,有助于其代谢稳态的调节、储存、运输,且更易为人体吸收和利用[22]。目前在柑橘中已被鉴定出的类黄酮超过80 种,包括黄酮类、黄烷酮类、黄烷醇类、花青素类等[8]。研究表明,不同类型柑橘类黄酮组成和含量存在较大差异,并表现出一定的种质特异性,如柚皮苷、新橙皮苷和枳属苷等黄烷酮糖苷在柚、葡萄柚、枳等种质中特异积累,橙皮苷和柚皮芸香苷在甜橙、柑、橘和柠檬等种质中特异积累[23-24],多甲氧基类黄酮在宽皮柑橘中的含量较高[25],黄酮和黄酮醇主要在柠檬和莱檬中积累[26],花青素主要在血橙中积累[27]。
果实成熟是个复杂的过程,涉及多个生理生化性状的变化,以及多个结构基因或调节基因的共同作用[28]。随着牛肉红朱橘果实成熟,外观和风味发生显著改变,果皮颜色由绿色转变为橘红色,口感逐渐变甜,风味逐渐浓郁,视觉、味觉、嗅觉、触觉等多个感官品质发生改变。而作为抗氧化评价重要指标的类黄酮,在果皮成熟过程中变化趋势基本一致,大部分呈现下降的趋势。田静等[29]分析了化州柚发育时期柚皮苷含量变化结果表明,无论是果皮还是果肉,柚皮苷含量均随果径增大呈下降趋势,与该研究结果一致;Chen 等[30]在研究暗柳橙、红暗柳橙、清家脐橙等黄皮层生长发育期芸香糖苷积累特征时也得出类似结果,即柚皮芸香苷、橙皮苷、香风草苷等随着果实成熟整体代谢趋势降低。
本研究利用代谢组学原理和方法对果皮发育期(花后150~240 d)类黄酮代谢规律进行了研究,结果表明:成熟度对类黄酮组分和含量具有较大的影响。N1 vs N2 差异代谢物仅富集于类黄酮生物合成途径;而在N2~N3 期(花后180~200 d)类黄酮表达丰度急剧下降。随着果皮颜色由绿逐渐转为黄绿相间,再到成熟时期的橘红色,越来越多的差异代谢通路如黄酮、黄酮醇、次生代谢等被筛选到。本研究结果反映了牛肉红朱橘果皮生长发育期类黄酮代谢物变化规律以及相关生物过程的协同性和复杂性。而参与这些生物过程的关键基因除了可能与类黄酮合成途径上下游的黄酮合成酶(CHS、CHI、FNS)、类黄酮-3′-羟化酶(Flavo-noids-3′-hydroxylase,F3′H)、鼠李糖基转移酶(Rhamnosyltransferase,Rhat)、葡萄糖基转移酶(Glucosyltransferase,Glct)等结构基因具有密切关系外,可能还受调节基因的单独或协同调控[31]。但具体是哪些基因在牛肉红朱橘类黄酮代谢过程中起关键作用,还有待后期从代谢调控、关键结构基因或调节基因着手进行深入挖掘和探索。

