非洲菊菌核病病原菌的分离鉴定及抑菌药剂筛选
曹奕鸯,夏朝水,陈昌铭,陈玮婷,甘玮欣,林辉锋,林发壮,莫智龙
(三明市农业科学研究院花卉研究所,福建 三明 365051)
0 引言
【研究意义】非洲菊Gerbera jamesoniiBolus是菊科大丁草属多年生宿根草本花卉,原产于南非,是世界五大切花之一。因其具有花色丰富、花枝挺拔、花朵硕大、切花率高、在保护地栽培下可周年产花的优点,故被广泛种植[1]。近年来,随着种植面积的扩大以及设施栽培带来良好的病害繁殖环境,非洲菊病害日趋严重,其中菌核病是易诱发的病害之一[2]。国外的美国、阿根廷、匈牙利、以色列[3-6],国内的上海市、浙江温岭、江苏淮安及河南淮阳等非洲菊产区均有非洲菊菌核病的报道[7-10]。福建省是非洲菊的主要产区之一,近年来种植规模已超过一万亩[11],其中清流县是福建省最早规模化种植非洲菊的地区,也是种植面积最大的地区。经笔者调查发现,当地非洲菊菌核病发病率较高,连作地块发病严重,发病率最高可达30%,菌核病已成为该地区非洲菊生产上亟需解决的问题,但是迄今为止,当地主要的防治方法还是用石灰、敌克松等土壤消毒的方式进行预防,采用多菌灵等常规药剂进行治疗,均未能有效控制。同时国内在非洲菊菌核病病原菌形态学、分子鉴定、药剂筛选方面的研究较少,影响了非洲菊菌核病的识别及有效防治。现阶段在生产上迫切需要分离病害病原,并进行防治药剂筛选,才能有针对性地进行防控,进一步提高防控效果。【前人研究进展】目前国内外关于非洲菊菌核病的报道较少,主要介绍发病症状[3-4,7,9-10]、发生情况[7,10]及防治措施[9],仅有周韦成[7]通过形态学鉴定方式,鉴定出非洲菊的菌核病病原为核盘菌Sclerotinia sclerotiorum。【本研究切入点】菌核病已成为福建省清流县非洲菊生产上亟需解决的问题,有关非洲菊菌核病分子鉴定及防治药剂筛选有待深入研究。【拟解决的关键问题】采用组织分离法分离菌核病病原菌,利用形态学和ITS分子鉴定方式鉴定病害病原,并利用室内毒力测定法进行防治药剂的筛选研究,以明确病原菌种类,筛选出有效杀菌剂,以期为防治非洲菊菌核病提供科学依据,为进一步进行非洲菊抗病性育种等提供重要材料。
1 材料与方法
1.1 病原菌菌株的分离与致病力测定
1.1.1 病原菌菌株的分离 非洲菊菌核病病株样品采集于福建省清流县美丰花卉苗木农民专业合作社非洲菊种植基地,采用组织分离法[12]分离纯化病原菌:病叶或病枝用自来水洗净,在无菌操作台上取病部的组织,浸入75%酒精3 s后,用无菌水冲洗3次并用无菌吸水纸吸干水分;接着置于0.1%升汞中消毒1 min,再用无菌水冲洗3次并吸干水分;最后取0.5 cm大小的病健交接处组织转移至PDA培养基中央,置于25 ℃恒温、黑暗条件下培养。采用菌丝尖端纯化法逐步纯化分离菌株,纯化后的菌株置于4 ℃条件下保存。
1.1.2 病原菌菌株的致病力测定 将保存的菌株接种到PDA培养基上并继代1次,完成菌株的活化。接种时,用直径6 mm的打孔器取新鲜菌丝边缘菌碟,将菌碟中菌丝面贴于100 d苗龄非洲菊杯苗的叶柄基部,在相同位置放置无菌PDA培养基作为对照。接种完成后,装入透明自封袋中置于光照培养箱中22 ℃,12 h光暗交替条件下保湿培养。接种后观察记载发病过程,显症后再次分离鉴定病原菌,验证是否与接种菌株一致。
1.2 病原菌菌株的形态学观察
用黄色移液枪枪头取边缘菌丝菌碟,将菌碟移至PDA培养基中央,置于22 ℃恒温黑暗条件下培养,观察菌丝生长和菌核形成情况。菌核的萌发诱导参考孙敬贤等[13]的方法:收集培养基中的菌核,先在4 ℃的低温黑暗条件下处理5周,后将菌核移入盛有湿润灭菌沙子的罐头瓶中,置于室内自然温度及弱光下培养,同时观察记载菌核萌发过程。菌核萌发形成成熟子囊盘后,对子囊盘进行切片处理,并在显微镜下观察子囊孢子形态和大小。
1.3 菌株分子鉴定
采用基于ITS序列的分子鉴定方式对非洲菊菌核病病原进行分子鉴定:利用omega D3195-02真菌DNA提取试剂盒提取菌核病病原菌DNA,以病原菌DNA为模板,以ITS1F(5′-TCCGTAGGTGAACCT GCGG-3′)和ITS4R(5′-TCCTCCGCTTATTGATA TGC-3′)为引物扩增病原菌rDNA-ITS序列。PCR反应体系为50 μL:包括正反向引物各1 μL、2×PCR Mix 25 μL、50 ng·μL-1的DNA模板1 μL,ddH2O 23 μL;PCR反应程序:95 ℃预变性3 min,95 ℃变性20 s,55 ℃退火30 s,72 ℃延伸40 s,共40个循环,最后72 ℃延伸7 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后,送至铂尚生物技术(上海)有限公司福州测序部进行测序,测序得到的序列提交至GenBank数据库,同时,将测序结果在GenBank数据库中进行比对,比对后下载同源序列,利用MEGA6.06软件,选择邻接法(Neighbor-Joining,NJ),通过自举分析(bootstrap)进行置信度检测(自展值为1000),并基于Kimura 2-parameter模型计算进化距离,构建系统进化树。
1.4 杀菌剂对病原菌的室内毒力的测定
将表l中供试药剂均用无菌水稀释成1000 μg·mL-1质量浓度的母液,各药剂分别用无菌水配制成使用浓度的10倍。同时,在无菌操作条件下,用移液枪取1 mL不同浓度药剂分别注入直径为9 cm的无菌培养皿,倒入冷却至50 ℃左右的无菌PDA培养基9 mL,轻轻摇匀,制成系列浓度的含药培养基,以注入无菌水的不含药平板作为对照,每处理重复3次。采用菌丝生长速率法测定5种杀菌剂对供试菌核病菌株C4-1菌丝生长的抑制作用:用直径6 mm的打孔器取新鲜病原菌菌丝边缘菌碟,接种于含系列质量浓度杀菌剂的PDA培养基上,置于22 ℃黑暗条件下培养2 d;采用十字交叉法测量菌丝直径,取平均值,计算菌丝生长抑制率,计算公式为:抑制率/%=[(对照菌落直径-处理菌落直径)/(对照菌落直径-菌碟直径)]×100;以药剂质量浓度的对数值为横坐标x,以抑制率转换成的几率值为纵坐标y,求出各药剂对非洲菊菌核病菌株C4-1的毒力回归方程和相关系数,并计算出各药剂的有效抑制中浓度EC50。

表1 供试杀菌剂母液及使用浓度Table 1 Original and applied concentrations of fungicides under study
2 结果与分析
2.1 病原菌的分离与致病力测定
采用组织分离法获得了纯化后的菌株C4-1。在光照培养箱中,对100 d苗龄非洲菊苗接种,结果表明菌株C4-1可以侵染非洲菊苗,接种第2 天开始发病(图1-A),病部首先出现水渍状软腐并逐渐向叶片和茎基部处蔓延;接种第3天可见病部表面密生白色絮状物(图1-B);接种10 d后在病部可见由白色菌丝团集聚形成的黑色鼠粪状菌核(图1-C),而对照处理的非洲菊苗生长正常,未出现病害(图1-D)。此外,从植株发病部位重新分离到的病原菌与原始菌株一致,接种后病害发病症状与田间发病症状(图1-E)一致,说明菌株C4-1即是导致非洲菊菌核病的病原。

图1 非洲菊苗期菌核病感病过程及田间发病症状Fig. 1 Development of sclerotinia stem rot in gerbera seedlings and disease symptoms in the field
2.2 病原菌的形态观察
22 ℃恒温培养条件下,菌株C4-1在PDA培养基中可迅速生长,2 d可长满9 cm直径的培养皿(图2-A),此时菌丝为白色,气生菌丝较少;培养3 d后,菌丝开始出现白色棉絮状菌丝,并在培养皿边缘部位集聚形成白色的菌丝团(图2-B);5 d后菌丝团慢慢变硬,黑色素逐渐累积,菌核形成部位表面布满小水珠(图2-C);最后,水珠慢慢消失,并在培养皿边缘形成直径2~5 mm、坚硬、椭圆形或近球形的黑色菌核(图2-D)。
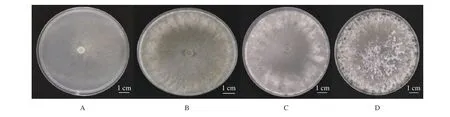
图2 菌株C4-1在PDA培养基中的生长过程Fig. 2 Growth of C4-1 in PDA medium
菌核经低温处理后,在自然条件下弱光培养,可观察菌核萌发及子囊的形成过程:菌核萌发后首先长出浅褐色的子囊柄(图3-A);接着子囊柄顶端膨大开始形成子实体(图3-B);随着子实体继续生长,子囊柄顶端逐渐形成直径为0.5~0.8 cm的淡黄色盘状子囊盘(图3-C),一个菌核可长出2~10个子囊盘(图3-D)。将子囊盘切片处理,于显微镜下观察,可见子囊棍形、无色、内含8个单行排列的子囊孢子(图3-E),子囊孢子椭圆形,平均大小为(9~12)μm×(4~7)μm(图3-F)。

图3 菌核的萌发过程及子囊和子囊孢子的形态Fig. 3 Germination process of sclerotia and the morphology of asci and ascospores
2.3 病原菌的分子鉴定
对病原菌C4-1 rDNA的ITS序列进行扩增和测序,得到540 bp长度的核苷酸序列,序列提交至GenBank数据库获得菌核病菌株C4-1的序列登录号为MW535875.1。与GenBank中下载的菌株ITS序列进行系统进化分析,结果表明(图4),分离菌株C4-1与核盘菌Sclerotinia sclerotiorum菌株CBS 499.50、ATCC MYA-4521、ATCC46762聚为一支,与核盘菌属其他种不在同一个分支,结合菌株的形态特征,确定分离到的病原菌为核盘菌Sclerotinia sclerotiorum。

图4 基于ITS核苷酸序列构建的核盘菌属系统发育树Fig. 4 Phylogenetic tree of Sclerotinia based on ITS nucleotide sequence
2.4 不同药剂对核盘菌菌丝的室内毒力测定
由表2可见,5种杀菌剂对非洲菊核盘菌菌丝生长的抑制效果不同。在供试的5种杀菌剂中,25%咪鲜胺对菌株C4-1的抑菌作用最强,EC50值为0.0324 μg·mL-1;其次为50%啶酰菌胺、40%菌核净、15%三唑醇,EC50值分别为1.0337、1.8362、6.9408 μg·mL-1;50%多菌灵的抑菌作用最弱,EC50值仅为22.4349 μg·mL-1。

表2 5种杀菌剂对非洲菊核盘菌菌株C4-1的毒力Table 2 Toxicities of 5 fungicides on S. sclerotiorum C4-1
3 讨论与结论
传统植物病原菌的鉴定采用柯赫氏法则结合形态学观察的方法,但这种方法需要丰富的植物病理学基础[14]。近年来随着分子生物学的发展,分子生物学技术在病害鉴定的研究中也得到了广泛的应用,特别是真菌rDNA的ITS区段既具保守性,又在科、属、种水平上均有特异性序列,通过对ITS区进行测序,来诊断和检测植物病原菌已越来越被广泛应用[15]。李克宁[16]、周韦成等[7]在非洲菊菌核病病害鉴定中采用了形态学鉴定的方法,明确非洲菊菌核病病原为核盘菌。卢灿华等[17-20]将形态学鉴定结合分子鉴定应用于香料烟、桑葚、扁豆、大白菜等植物菌核病病原菌鉴定中。本研究通过形态学和分子鉴定方法鉴定出非洲菊菌核病的病原为核盘菌Sclerotinia sclerotiorum,与前人通过形态学鉴定得出的结果一致[7,16],故非洲菊菌核病病原鉴定可以采用形态学鉴定或者分子鉴定的方式。此外,核盘菌引起的菌核病的菌核在诱导子囊和子囊孢子时,需要较长时间的低温诱导和适温培养过程[13],因此,非洲菊菌核病鉴定可优先采用分子鉴定的方法,以提高鉴定效率。
菌核病是一种世界性分布的土传真菌性病害,其中核盘菌引起的菌核病就可危害约75科,278属,408种植物[20]。本研究表明,在适宜条件下非洲菊苗可在接种第2天发病,接种第3天在病部明显可见白色菌丝,在接种第10天形成菌核,菌核病病菌侵染速度快,病害发病严重。由于菌核是菌核病主要初侵染源,它萌发产生子囊孢子,通过风、水等途径传播[21]。因此,避免与十字花科、葫芦科、豆科、茄科等[22]易受菌核病影响的作物轮作,病害严重地块避免连作,发现病株及时清除病残体,是预防非洲菊菌核病的有效措施。同时,菌核萌发与低温处理条件及低温处理后培养温度有关[13],在福建清流,非洲菊菌核病菌核在秋冬季节经过低温诱导,打破休眠后,在冬季至次年春季可见菌核病大范围发生,因此,清流县在防治该病害时,需因地制宜在冬季至次年春季期间加强预防。
本研究通过室内毒力测定结果表明,多菌灵对非洲菊菌核病病原菌菌丝生长抑制作用最弱,EC50值为22.4349μg·mL-1,依10 μg·mL-1<EC50<100 μg·mL-1的多菌灵中抗标准[23],菌核病菌C4-1菌株对多菌灵表现出中抗水平。同时,已在葫芦科、茄科、豆科、伞形科、十字花科、菊科等多种蔬菜上发现了对多菌灵产生抗药性的菌核病菌株[24],因此,利用多菌灵防治非洲菊菌核病防效较差。本研究结果还表明咪鲜胺、啶酰菌胺、菌核净对非洲菊菌核病病原菌菌丝生长抑制作用较强,EC50值分别为0.0324、1.0337、1.8362μg·mL-1,其中,咪鲜胺为咪唑类杀菌剂,啶酰菌胺为酰胺类杀菌剂,菌核净为新亚胺类杀菌剂,因此,在防治菌核病过程中,可轮换使用咪鲜胺、啶酰菌胺、菌核净这几种不同类型药剂,以提高田间防效并延缓病菌产生抗药性。

