高效液相色谱-串联质谱法测定河蟹肝胰腺组织中林可酰胺类抗生素残留
邱稀木,朱晓华,边文冀,王淑芳,孟 勇
[1. 江苏海洋大学海洋科学与水产学院,江苏 连云港 222005;2. 江苏省淡水水产研究所,江苏 南京 210017;3. 江苏省水产质量检测中心/农业农村部渔业产品质量监督检验测试中心(南京),江苏 南京 210017]
0 引言
【研究意义】林可酰胺(Lincosamide)类抗生素主要有林可霉素(Lincomycin)、克林霉素(Clindamycin)、吡利霉素(Pirlimycin),能抑制细菌的蛋白质合成,对大多数革兰氏阳性菌和一些厌氧革兰氏阴性菌有抗菌作用[1-2]。林可酰胺类抗生素主要运用于临床和畜禽养殖上,根据农业农村部印发的《水产养殖用药明白纸2020年1、2号》,林可酰胺类抗生素药物在水产养殖上的运用目前还没有明确的指导属于水产养殖的非规范用药。近年来,在渔用投入品的风险筛查中,在某些改水类产品中检测到林可酰胺类抗生素药物成分,对水产养殖带来了一定的风险隐患。【前人研究进展】目前,关于林可酰胺类药物残留的检测方法比较多,如液相色谱-串联质谱法测定蜂蜜中的林可酰胺类兽药残留[3]、酶联免疫分析方法测定牛肉鸡肉猪肉鱼肉中的林可酰胺类抗生素[4]、高效液相色谱法对林可霉素含量的测定[5]、林可霉素的磁免疫化学发光检测试剂盒及其应用[6]等,但在河蟹样品中林可酰胺类药物的检测方法还未见报道。其中,液相色谱法以保留时间作为定性标准,比较容易产生假阳性的结果,而且灵敏度不高[7];化学发光法需要柱后衍生,操作的过程较为繁琐,时间和人工成本高[7]。且河蟹的肝胰腺样品油脂成分高存在基质效应,基质常常对分析物的分析过程有显著的干扰,并影响分析结果的准确性,所以对样品提取和净化的方法要求会较高[8]。【本研究切入点】固相萃取(SPE小柱)主要用于从各类复杂的基质提取出想得到的分析物,例如生物体(血液和尿液)、水样[9]、土壤、药材[10]中提取目标分析物,达到浓缩或纯化的目的。本研究将固相萃取小柱用于河蟹肝胰腺样品的前处理,以期达到更好的提取和净化效果,降低其他复杂基质对样品提取的影响。【拟解决的关键问题】本研究以3种林可酰胺类抗生素(林可霉素、克林霉素、吡利霉素)为检测对象,将SPE固相萃取柱应用于河蟹的兽药残留检测前处理,以期建立河蟹中林可酰胺类抗生素兽药残留的快速检测方法,对河蟹质量安全管控具有积极的意义。
1 材料与方法
1.1 仪器和试材料
1.1.1 仪器 QTRAP 4500三重四极杆(美国SCIEX公司,配备电喷雾离子源);实验室用水(Millipore系统超纯水);漩涡振荡器(北京佳源兴业公司);Allegra TM 离心机(美国Beckman公司);Turbo Vap浓缩工作站(瑞典Biotage公司)。
1.1.2 材料 甲醇、乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,美国ROE公司);有机滤膜(0.22 μm,天津津腾有限公司);OASIS®HLB 6 :500(mL:mg)固相萃取柱;3种林可酰胺类抗生素标准品(农业农村部环境保护科学研究监测所,100 μg·mL-1);河蟹样品(从南京各农贸市场随机抽样)。
1.2 标准溶液的制备
准确称取5.0 mL林可酰胺、克林霉素和吡利霉素标准品溶液,分别转移至同一50.0 mL容量瓶中,用乙腈作为稀释剂溶解并稀释至一定体积。进一步将5.0 mL该溶液转移至50.0 mL容量瓶中,用乙腈稀释剂稀释至一定体积。
1.3 样品的提取和净化
1.3.1 样品提取 进行以下步骤:(1)将5 g河蟹样品(蟹肉和蟹黄混合)称量到离心管中;(2)加入配置好的2%甲酸乙腈15 mL;(3)使用漩涡振荡器涡旋5分钟使提取剂与样品充分溶解;(4)将每管样品在4 ℃下以9000 r·min-1的速度离心10 min;(5)离心后的上清液转移到另一个50 mL离心管中;(6)残留物用10 mL提取液再次提取,合并上清液。(7)溶液中加入5 mL正己烷,涡旋振荡30 s,9000 r·min-1的速度离心5 min,弃去 上层正己烷,再加入5 mL正己烷重复操作一次。下层溶液待净化。
1.3.2 样品净化 SPE小柱依次用6 ml甲醇和6 ml超纯水以3 mL·min-1的流速进行预处理。将上清液(10 mL)以1 mL·min-1的速度通过固相萃取柱,弃流出液。10 mL超纯水冲洗柱子,弃流出液,抽真空10 min。5 mL甲醇冲洗柱子洗脱。在40 ℃的条件下,洗脱液用氮吹仪吹至完全干,氮吹干后的残留物加入1.00 mL 0.1%甲酸水-甲醇(9∶1)混合溶液,2分钟涡旋使其充分混合,用针管吸取混合溶液,将溶液通过0.22 μm有机滤膜,置入棕色样品瓶中,待上机。
1.4 色谱和质谱分析条件
1.4.1 液相色谱条件 色谱柱:InfinityLab poroshell 120 SB-C18,(100 mm×2.7 mm,2.7 μm);A相为0.1%甲酸水溶液,B相为甲醇;柱温:30 ℃;样品量:10 μL;流速:0.40 mL·min-1;梯度洗脱程序见表1。

表1 流动相梯度洗脱程序Table 1 Procedures of mobile phase gradient elution
1.4.2 质谱分析条件 质谱的电离模式为电喷雾离子源(ESI+模式);辅助加热气体流量:50 L·min-1;雾化气体流量:50 L·min-1;离子源的温度为550 ℃;气帘气流量:35 L·min-1;喷雾电压设置为5500 V。
2 结果与分析
2.1 提取溶剂优化
林可酰胺类抗生素极性较强,容易溶于极性溶剂[2,11]。因此,比较了磷酸盐缓冲液、乙腈、乙酸乙酯和丙酮的萃取效率。结果表明,磷酸盐缓冲液含水量高,不利于后续的浓缩,溶解的蛋白易导致过SPE柱时堵塞;乙酸乙酯作为萃取溶剂时,乳化现象严重,回收率很低;丙酮用作提取溶剂时挥发性很高,直接注入可能会破坏管道和质谱组件[3]。乙腈是极性较强的有机溶剂,具有沉淀蛋白质的作用,各指标的回收率优于其他提取剂。因此,本试验选择乙腈为提取溶剂。此外,分别以纯乙腈、1%甲酸乙腈、2%甲酸乙腈、1%氨水乙腈、2%氨水乙腈作为提取液,考察其对3种林可酰胺类目标物的提取效果。结果显示,相比其他组,2%甲酸乙腈作为提取溶剂时的平均回收率最高,3种林可酰胺类药物的回收率为76.9%~102%,满足期望结果回收率在75%以上。因此,本试验提取样品采用2%甲酸乙腈进行试验。
2.2 色谱条件的优化
利用InfinityLab poroshell 120 SB-C18(100 mm×2.7 mm,2.7 μm)色谱柱在ESI+模式下,比较了在乙腈-水或甲醇-水流动相系统中3种林可酰胺类药物的色谱结果。试验结果是:甲醇-水流动相中3个目标的峰值形状和响应优于乙腈-水,且洗脱时间短,所以选择了甲醇-水流动相系统。
通过在流动相中加入适量的挥发性盐或酸可以提高目标物的反应值、分辨率和峰形[12-13]。因此,在水相中添加甲酸或乙酸铵对流动相系统做进一步优化。离子化后3种目标化合物主要以[M+H]+的形式存在[14-15]。结果是,在水相中添加醋酸铵降低了各目标化合物的响应值[16-18];在水相中加入甲酸后,各目标化合物的质谱响应提高了10%,且添加0.1%甲酸时效果最佳。因此本试验使用0.1%甲酸水-甲醇作为流动相。
2.3 质谱参数的优化
将50 μg·L-1待测林可酰胺标准混合溶液用针型泵注入质谱仪,分别用电喷雾正电离模式和电喷雾负电离模式对药物的母离子全扫描进行比较并优化了碰撞能量和去簇电压。分析结果表明,在电喷雾正电离模式下,3种测试对象的离子信号稳定,响应速度快,因此选择电喷雾正电离扫描模式。在这种模式下,所有3种化合物都产生了[M+H]+的母离子。进一步扫描生成的子离子,选择丰度最高的2个子离子进行定性和定量分析。考察了喷雾电压分别为:4500V、5000 V、5500 V时,3种标准溶液的离子化效率,结果为5500 V时的离子化效率最高。目标化合物的质谱分析条件见表2。3种林可酰胺类抗生素药物的总离子流图见图1。

图1 质量浓度为50 ng·L-1的 3 种林可酰胺类药物标准溶液的总离子流图Fig.1 Total ion chromatograms of 50 ng·L-1standard solutions of 3 lincosamide antibiotics

表2 林可酰胺类药物测定的质谱参数Table 2 Mass spectrometric parameters for lincosamide antibiotics determination
2.4 SPE小柱对蟹黄的净化效果
河蟹的肝胰腺富含碳水化合物、氨基酸、有机酸、蛋白质、胶原蛋白、维生素A、不饱和脂肪酸等,这会影响目标化合物的测定,并污染离子源[19-21]。因此,本试验考察了在河蟹肝胰腺样品提取中,固相萃取柱对3种林可酰胺类药物的净化效果和回收率。试验分析了6种SPE小柱的净化效果(图2),其中OASIS®HLB 6 mL/500 mg SPE柱组的净化结果最好。使用该型号SPE小柱,3种林可酰胺类药物的回收率在80%以上,平均回收率是84.6%,明显好于其他固相萃取柱组。因此,本方法最终选择型号为OASIS®HLB 6 mL/500 mg的 SPE柱来净化河蟹肝胰腺样品。

图2 不同固相萃取柱对目标物回收率的影响Fig. 2 Recovery rates on 3 antibiotics by various SPE columns
2.5 基质效应的考察
电喷雾离子源在电离时候,样品中的基质和目标化合物具有竞争关系,这种现象为基质强化效应或基质抑制效应[22-24]。本试验考察了1、5、10、20、50、100 ng·mL-16个质量浓度,建立对应的直角坐标轴,峰面积为纵坐标,质量浓度为横坐标。基质效应(ME)的计算公式为(基质标准工作曲线的斜率/溶剂标准工作曲线的斜率)×100%[25-27]。使用6种固相萃取柱进行二次纯化后,基质工作曲线与标准工作曲线的斜率之比均低于50%,表明具有显著的基质效应。因此,本方法采用基质匹配曲线对 3 种林可酰胺类抗生素兽药残留进行定量分析。相比于其他组,OASIS®HLB 6 :500(mL:mg)固相萃取小柱可以有效降低河蟹肝胰腺样品在液相色谱质谱联用仪上的基质抑制效应。
2.6 试验方法的评价
2.6.1 方法的线性范围、检测限和定量限 以0、1、5、10、20、50 ng·mL-1为质量浓度水平,以峰面积Y和相应的目标物质质量浓度为X(μg·L-1),绘制出3种林可酰胺类抗生素的基质标准工作曲线,线性相关系数(R2)均高于0.99,线性回归方程和相关系数见表3。将含有3种目标物质的标准溶液添加到空白河蟹样品中,制备具有不同目标物质含量的加标样品。根据优化条件测定样品,分别采用3倍和10倍信噪比(S/N)的计算方法来确定方法的检测限度和定量限度[28-29]。本检测方法目标物的LOD值约为0.3 μg·kg-1,LOQ值约为1.0 μg·kg-1(表3)。本方法的线性范围能够满足实际河蟹肝胰腺样品的检测需要。
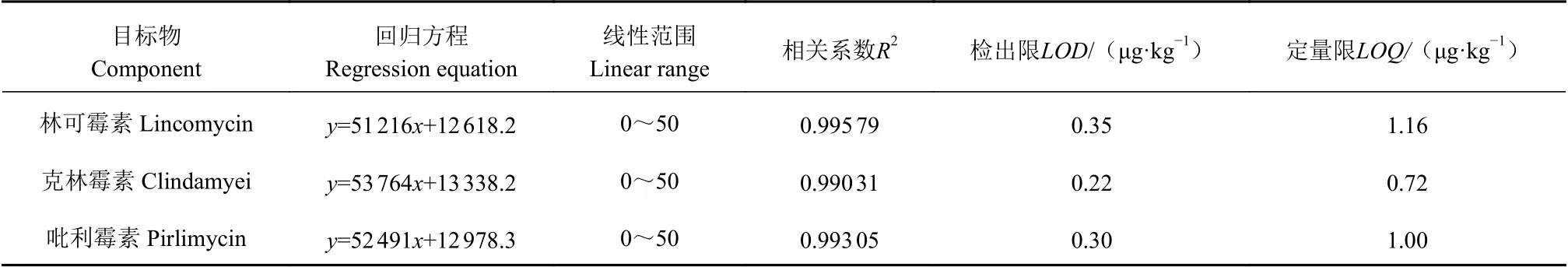
表3 方法的线性回归方程、相关系数、检出限和定量限Table 3 Linear regression equation, correlation coefficient, detection limit, and quantitative limit of assay
2.6.2 方法的准确性和精密度 将混合标准溶液添加到河蟹的空白样品中,以获得目标质量浓度为5.0、10.0和50.0 μg·kg-1的3个加标水平,并根据优化的方法重复测定6次。河蟹样品中3种林可酰胺类抗生素的加标回收率和精度见表4。3种质量浓度的林可酰胺类抗生素在蟹类样品中的回收率为80.5%~99%,相对标准差(RSD)为2.5%~5.2%,回收率和准确度高,能够满足河蟹样品中这3种林可酰胺类抗生素残留的分析要求。

表4 3种林可酰胺类药物的加标回收率及精密度(n=6)Table 4 Recovery and precision of assay on 3 lincosamide antibiotics (n=6)
2.7 实际样品分析
用本方法检测了从各农贸市场抽查到的170份河蟹样品。结果5份河蟹样品林可霉素含量检出。检出的阳性样品林可霉素质量浓度依次为:4.43 、9.23、4.26 、17.77 、8.47 μg·kg-1。本方法简单、快捷、精确度高,适用于河蟹样品中3种林肯酰胺类抗生素残留的检测,其中一份阳性样品的色谱图如图3所示。

图3 阳性样品的色谱图Fig. 3 Chromatograms of positive samples
3 讨论与结论
复杂的油脂基质给河蟹蟹黄抗生素类药物的检测造成了一定的困难。油脂易溶于正己烷,正己烷和水分层,正己烷在上层,弃掉正己烷可达到净化效果;HLB小柱吸附剂是由亲脂性二乙烯苯和亲水性n-乙烯基吡咯烷酮两种单体按一定比例聚合成的大孔共聚物,其保留机理为反相,通过一个“特殊的极性捕获基团”来增加对极性物质的保留提供很好的水浸润性,林可酰胺类抗生素药物是极性较强的物质,因此用HLB小柱提取该药物。
针对河蟹肝胰腺基质的特点,结合现行有效标准和文献报道,本研究对传统提取工艺进行了改进,以减少肝胰腺样品中其他复杂基质的干扰,使用2%甲酸乙腈作样品的提取溶剂,净化过程采用了正 己 烷 祛 脂 和OASIS®HLB 6∶500(mL∶mg)SPE柱进行过滤和富集,优化了部分液相色谱和质谱的分析程序等。采用高效液相色谱-质谱联用技术,建立了在河蟹肝胰腺样品中林可酰胺类抗生素药物残留的快速测定方法。本方法具有步骤少、精确度高、稳定性好、重现性好、减少溶剂的消耗量等优点。本研究完善了对河蟹肝胰腺样品中林可酰胺类兽药残留的定量检测,可为河蟹的质量安全生产监控提供技术支持。

