静脉畸形组织结构与治疗选择的临床分析
肖 莉, 王彦林, 董长宪, 孙 斌
(河南省人民医院血管瘤科,河南 郑州 450003)
静脉畸形(venous malformation,VM)是先天性脉管发育异常最常见的类型,占脉管畸形中的70%,发生率为 1/10 000~2/10 000,散发在身体各个部位。瘤体随年龄增长持续增大,主要临床表现为疼痛、活动受限,最终形成不可逆性功能障碍[1-2]。VM涉及普通外科、整形外科、手足外科、介入科、骨科、小儿外科等专业。治疗方案多元化,主要有硬化剂注射、激光、介入、手术等治疗方式[3]。治疗方式的选择依据医院的优势技术,无统一标准。VM同样的治疗方案疗效有时差异较大。为更精准地选择合适的治疗方案,取得最优疗效,本研究根据临床实践,从病变组织结构特点出发将VM分为3组,回顾性分析各组治疗方案及对应的疗效、初步探讨VM组织结构与治疗方案的对应性,从而提高治愈率、减少并发症发生。
资料与方法
一、一般资料
收集本院血管瘤科2015年1月至2019年12月的VM病人170例,包括首次就诊及治疗后复发或出现并发症,男73例,女97例,平均年龄(23.4±9.9)(1.5~52.0)岁。
病例均为体腔外VM。临床症状有包块、疼痛、运动功能障碍,影像学检查或病理诊断为VM。笔者根据组织结构将VM分成包膜组、非包膜组和骨化组[4-8](见表1)。包膜组病变周围有清晰的包膜,包块局限,随体位改变明显,质软或韧,常伴随较大体积的静脉石,间歇性疼痛,四肢关节伸展、屈曲功能障碍。非包膜组病变与周围组织界限不清,病变内部呈筛网状,静脉石较小不易发现,疼痛不明显,功能障碍出现时间较晚。骨化组病变内有骨质形成,无明显疼痛,以渐进性功能障碍为主,障碍不易纠正(见表2)。
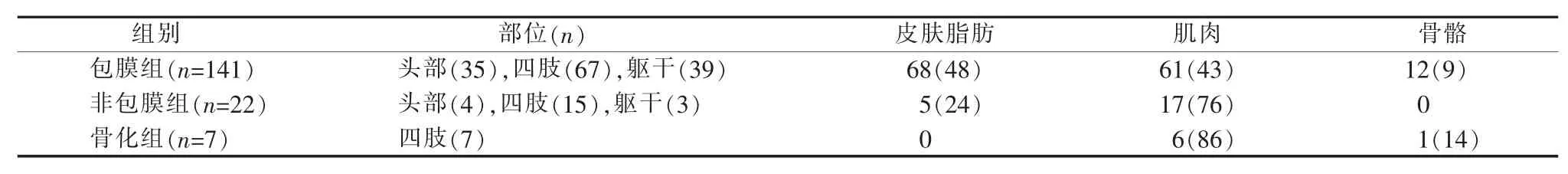
表1 3组VM的组织分布情况[n(%)]

表2 3组VM的临床特点[n(%)]
二、影像学检查
彩色多普勒超声检查为无创、有效的定性诊断方法,可筛查病例。同时使用MRI、X线和CT血管造影(CT angiography,CTA)检查。
三、治疗方案
术前根据瘤体的大小、位置、功能状态设计治疗方案。①手术治疗:切除瘤体+神经血管探查+周围嵌压松解。当出现功能障碍时进行松解。对肌瓣皮瓣转移、肌腱延长的病人,术后予以石膏固定或佩戴制具,康复锻炼半年以上。②微创治疗:于彩超检查定位或CT检查引导下行瘤内硬化剂药物注射、射频消融治疗。
四、评分和随访
术前和出院时行疼痛视觉模拟评分(visual analogue scale,VAS)和Oswestry功能障碍指数(Oswestry disability index,ODI)客观评价疗效,并比较评分。术后1年门诊随访。通过体格检查和影像学检查,了解疗效。
结 果
一、影像学检查
彩色多普勒超声检查呈现混合回声团块,为阳性病变。可见迂曲扩张的管状结构,管径大小不一。部分管腔内见到强回声血栓形成。其内血流信号不明显。挤压、放松探头后管状结构内见血流信号。MRI检查定位诊断实现三维显像,显现各层组织、血管、神经以及与病变的毗邻关系。包膜组T2WI显示不均质分叶状。非包膜组T2WI多显示高信号均质影(见图1、2)。X线检查显示骨化组病变累及骨膜下,骨皮质形态欠规则,部分骨髓腔内高信号,软组织病变部位高信号影,病变杂乱无章的骨化表现,颗粒规则的静脉石(见图3)。CTA检查可诊断复杂混合型高流速脉管畸形以及鉴别诊断。

图1 颌面部包膜组VM的MRI检查表现

图2 颌面部非包膜组VM的MRI检查表现

图3 骨化组VM的X线检查表现
二、VM术中大体所见
手术中可见包膜组VM瘤体边界清晰,与周围正常组织有薄膜隔开。周围无回流静脉或数量较少,内径宽大。瘤体内静脉石体积及数量较多,直径可达1 cm以上,部分瘤内可见肌肉、脂肪、纤维组织(见图4)。非包膜组VM无包膜、无明显边界,呈蜂窝筛网状,周围的回流静脉数量多且细小,静脉石体积小,无明显实体组织伴随(见图5)。骨化组VM瘤体组织纤维化,质地坚硬,似骨皮质,正常组织移行,无明显边界,瘤体内血窦腔丰富(见图6)。
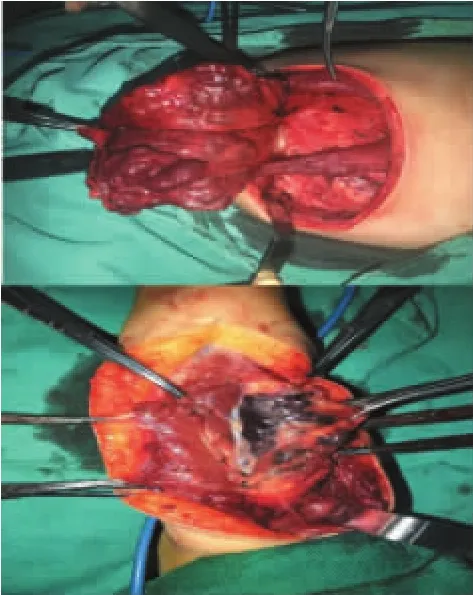
图4 包膜组VM大体观

图5 非包膜组VM大体观

图6 骨化组VM大体观
三、VM病理检查表现
光镜下包膜组、非包膜组和骨化组VM的形态学表现略有不同。骨骼肌纤维之间可见不规则扩张的畸形血管,管壁厚薄不均,散在或成簇状分布。管腔较大者出现细小薄壁分枝状畸形血管,间质混杂增生的纤维和脂肪组织,尤以包膜组多见,亦可见海绵状、网状、交织状薄壁畸形血管。非包膜组多见管腔内大量淤积血液甚至微小血栓形成。骨化组除畸形血管外,可见间质骨化、软骨化生,甚至分化成熟的骨皮质、骨髓、软骨样基质及软骨陷窝形成。不同类型畸形血管形态和排列可重叠或交叉出现,但均未见血管内皮细胞增生(见图7~9)。

图7 包膜组VM病理表现

图8 非包膜组VM病理表现

图9 骨化组VM病理表现
四、疗效评价
疗效评价包括治愈、临床治愈和复发3种。治愈为影像学检查显示瘤体消失,VAS评分提示疼痛消失,查体恢复功能位。临床治愈为影像学检查显示有瘤体残留,但VAS评分提示疼痛消失,查体膝、髋活动恢复功能位。瘤体残留主要来自为恢复功能而适当保留的病变组织及纤维瘢痕增生。复发为症状消失后再次出现阳性体征。疼痛消失但功能恢复不理想不属于复发。微创治疗包括硬化治疗、射频消融。本研究包膜组占82.9%,手术复发率为2.0%,微创治疗复发率5.0%,是预后最佳的组织形态。非包膜组占12.9%,手术复发率为26.7%,微创治疗复发率为42.9%。骨化组罕见,仅4.1%,都采用手术治疗,以纠正功能为主,切除后无复发(见表3)。3组术后出院时VAS与术前比较显示,包膜组、非包膜组差异有统计学意义(P<0.05)。术后出院时ODI与术前比较显示,包膜组、非包膜组、骨化组差异均有统计学意义(P<0.05)(见表4)。本研究结果表明,VM组织结构不同,治疗结果不一致。部分疼痛缓解和功能障碍改善效果非常显著。

表4 治疗前、后疼痛VAS与ODI比较
五、术后并发症
手术后并发症发生有切口脂肪液化、延迟愈合4例,各组中均有发生。包膜组VM发生小腿跟腱周围粘连1例。微创介入术后1例并发皮瓣软组织缺血性坏死。
六、随访
术后1年随访,7例失访,余163例症状未见反复或加重。专科查体、彩超和MRI检查显示,152例疗效同术后,复发11例(见表3)。其中包膜组2例手术治疗后复发,2例微创治疗后复发。非包膜组4例手术治疗后复发,3例微创治疗后复发。2例非包膜组手术后瘤体存在疼痛,但VAS评分降低。
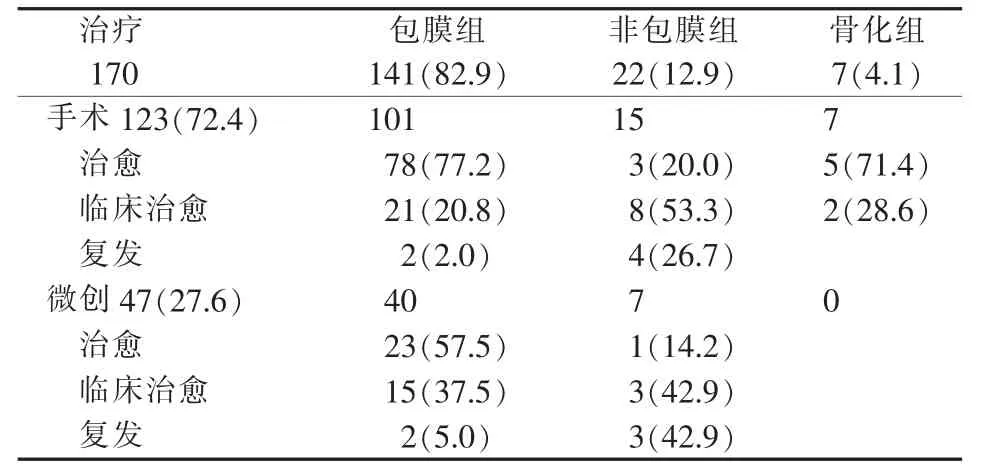
表3 3组VM治疗效果评价[n(%)]
讨 论
根据2018年国际脉管异常研究学会脉管异常新分类以及中华医学会整形外科分会血管瘤和脉管畸形学组编写的《血管瘤和脉管畸形诊断及治疗指南(2019版)》[9-10],VM的临床治疗方案明确。然而临床治疗发现,同样是硬化剂微创治疗VM,治疗结果显示差异较大。有些疗效显著甚至完美,但有些疗效不佳或病情加重。有研究报道近70%的VM需多次硬化剂治疗。硬化剂治疗可显著缓解症状,但治愈能力不足[11]。笔者在VM手术治疗中发现,组织结构差异性导致疗效的差异性,据此将VM分成3组,研究组织结构对治疗方案选择与疗效的对应关系。本研究包膜组VM占比最高,为82.9%,手术复发率2%,微创治疗的复发率为5%。图4的结构特点是有包膜限制瘤体,是介入硬化治疗的首选类型。但部分瘤体内有重要神经、血管穿行,微创治疗会引起神经血管嵌压症状,或包膜内脂肪纤维有形成分较多,微创治疗效果欠佳,应首选手术治疗。包膜的限制使术中出血少、周围组织损伤小,可达治愈。包膜组是VM预后最佳的类型。本研究非包膜组VM占12.9%。微创治疗的复发率42.9%,手术治疗复发率26.7%。主要原因如下:①非包膜组VM的筛网内,硬化药物存留时间明显缩短,周围回流静脉数量较多,代谢快速,硬化效果不佳。②边界不具体,手术中出血控制难度大,且周围易残留病变。因此,非包膜组VM疗效欠佳。有必要联合射频消融或其他破坏组织结构的方法提高疗效。骨化组VM罕见,本研究占比仅4.1%。其特点是肌肉瘤体组织发生骨化,肢体活动范围明显受限。手术治疗明显改善功能障碍,微创治疗无效。
目前,国内、外主要根据静脉造影检查表现的Puig分型来指导VM临床治疗。Ⅰ型:孤立性VM无静脉引流;Ⅱ型:VM引流静脉至正常静脉;Ⅲ型:VM静脉引流至发育异常的静脉;Ⅳ型:静脉扩张。Ⅰ、Ⅱ型适合硬化剂治疗[12],Ⅲ、Ⅳ型应用液体栓塞剂需相对谨慎。后两型VM与正常静脉循环之间有广泛引流。治疗时,液体栓塞剂较多进入正常静脉循环,病灶内栓塞剂浓度降低,疗效降低。Puig分型是根据病变回流静脉特点分类,是微创治疗的理论依据,但其未涉及参与病变的肌肉、脂肪、纤维、神经、淋巴管、骨骼等实体组织。本研究发现包膜组具有PuigⅠ型、Ⅱ型引流静脉特点,也证明包膜组织结构是微创硬化治疗最有效的组织类型。在Puig分型之外,可将组织结构作为选择治疗与预判疗效理论依据的补充。
影像学检查从定性、定量两方面剖析病变。彩超检查是最常见的定性检查,判定病变是否为VM,了解引流静脉的数量、内径大小等情况。X线检查常被忽略。X线检查影像瘤体位置不规则高信号影,可以判定骨化型VM。其他两型VM多引起骨质破坏,X线检查表现为溶骨性改变。CTA检查是与高流速脉管畸形作鉴别诊断的重要方法,虽不是必要的影像学检查,但对混合型脉管畸形需完善诊断,以便对病变动脉成分给予介入处理。
图7~9显示3组病理表现的差异。包膜组瘤体回流静脉宽大,瘤体内易形成较大体积的静脉石。图1的影像检查表现为不均质团块,也进一步说明包膜型常伴有纤维增生。非包膜组瘤体内形成体积微小的静脉石,无明显脂肪纤维组织增生。图2的均质影像也给予佐证。术前通过影像学检查,判断其类型,帮助选择合适的方案,手术、微创或联合其他治疗。
骨化VM发生率最低。VM常见有钙化,但骨骼肌骨化罕见。肌肉组织失去正常的组织结构及功能,是致畸的直接原因。肌肉内广泛骨化的VM病例报道较少,此类骨化现象罕见[6]。本研究7例骨化型VM为儿童和青少年,进展快,大关节屈曲程度严重。1年的屈曲变化类似其他类型数年。骨化型VM需与骨化性肌炎、骨化性纤维黏液样瘤、骨化性纤维异常增生以及骨骼外骨肉瘤相鉴别。对于肌肉或关节附近的慢性或复发性疼痛或无痛肿胀,伴或不伴创伤发生的功能丧失和畸形,需考虑骨化VM的可能。唯有手术切除骨化病变,才能修复功能。Engelstad等[7]描述所谓“瑞士奶酪”外观,反映了穿插着大型海绵状血管通道的成熟骨结构。Panda等[8]报道骨化性肌内血管畸形病理检查显示,骨小梁包绕许多大小形状不一的血管,畸形病变处有成熟的板层骨,血管内血栓形成,大量增生的毛细血管和饱满的内皮细胞。必须对正常肌肉周围边缘进行完整的手术切除。局部的复发率可达50%。认识此型广泛骨化生,对诊断及排除其他骨性疾病很重要。
VM的组织结构不仅帮助细化治疗方案,还对VM围术期的局限性血管内凝血(localized intravascular coagulation,LIC)处理有参考价值。无论是手术治疗还是微创治疗,都需关注D-二聚体升高的VM。LIC的特征有D-二聚体和纤维蛋白降解产物升高,纤维蛋白原、FⅤ、FⅧ、Fす和抗凝血酶Ⅲ水平降低,有时还出现轻到中度的血小板减少[13],常发生在病变体积大、数量多的VM中。治疗前需纠正凝血异常,防止并发弥散性血管内凝血[13-15]。本研究发现,在体积相同时包膜组VM发生LIC的比例最高(32.6%),包膜内更易形成血栓。非包膜组VM回流静脉丰富,流速相对较快,形成血栓的机会少,静脉石的体积较小而多,发生LIC比例为4.5%。尽管骨化组VM的体积与前两者类似,但未出现LIC。并发LIC与VM的组织结构关系密切。D-二聚体水平也可提示其可能的组织结构形态。
近年应用泡沫硬化剂及无水乙醇的微创介入方法取得良好的临床疗效,临床推广较快,但慢性疼痛、皮肤或神经损伤、间室综合征、血红蛋白尿、深静脉血栓形成、肺栓塞、肢体远端缺血坏死、肌内硬化医源性功能障碍等严重并发症发生也很棘手[16-17]。单纯手术治疗技术要求高,术后组织损伤,美观性差,术后恢复困难。笔者及本科室着手VM的精细化管理。根据多年的临床手术、微创治疗经验,初步提出将组织结构形态作为选择治疗方案及预估评价疗效的一种可行性理论依据,目的是选择最优方案,避免盲目手术或硬化治疗。为更精准地治疗VM,提高治愈率,改善功能,减少并发症,以上观点还需进一步完善。

