电针刺激“天枢”-“足三里”对肝脏缺血再灌注损伤大鼠肠道菌群和内毒素的影响
吕针黎, 魏 来,2, 谭思由,李 蓓,杨 浩,孔高茵,2
(1.湖南省人民医院/湖南师范大学附属第一医院,长沙 410005;2.湖南省围术期加速康复麻醉临床医学研究中心,长沙 410005)
肝叶切除和肝移植等肝脏外科手术常采取阻断入肝血流等方式控制出血,而由此操作造成的肝脏血流暂时性阻断及随后的血流再灌注通常引起肝脏缺血再灌注损伤(hepatic ischemia-reperfusion, HIRI)[1-2]。肝门阻断后门脉回流受阻可导致肠道循环淤血和代谢产物蓄积,阻断解除时肝脏内的毒性物质可经血液流至肠道导致肠道双重损害,导致肠道屏障功能受损、肠道菌群失调、细菌和内毒素移位到体循环诱发菌血症[3]。HIRI 引发的肠道损伤等一些列反应可诱导大量相关炎性介质和细胞因子产生释放,促使机体发生全身炎症反应综合征。因此,肠道也被称为多器官功能衰竭(Multiple-organ-failure syndrome,MOFS)的“motor”[4]。有研究表明,缺血再灌注损伤导致的多种术后并发症,如感染,会显著增加术后死亡率[5-6],而肝移植术后早期并发症以感染为主, 且在术后早期死亡的病例中,感染约占64%[7],这可能与肝脏血流阻断再灌注导致肠粘膜损害引起的细菌/内毒素移位有关[8]。现已有实验证实电针预处理对脑、心脏等重要脏器的缺血再灌注具有保护作用[9-10]。同时,亦有研究证明针刺“天枢”“足三里”等穴位具有调节肠道菌群组成的作用[11-12]。而现有研究中,缺乏探究此二穴对HIRI 所致的肠道损伤作用的相关研究。故而本研究拟通过电针预处理“天枢”及“足三里”穴,观察其对HIRI 大鼠肠道菌群组成及内毒素变化的影响,旨在丰富穴位刺激改善HIRI 相关肠道功能损害的理论机制、为临床实践提供依据。
1 材料与方法
1.1 实验动物与分组 SPF 级雄性SD 大鼠32 只,体质量200±20g(购买于湖南斯莱克景达实验动物有限公司,许可证号:SYXK(湘)2015-0013,),饲养于湖南师范大学附属第一医院动物房内,正常进食饮水,适应性生存7d。按随机数字表分为假手术组、模型组、天枢-足三里穴组及非经非穴组,每组各8 只。术前禁食6~8 h,不禁饮。
1.2 主要仪器和试剂 仪器及设备:SDZ-Ⅱ型华佗牌电子针疗仪(苏州医疗用品厂有限公司),不锈钢毫针(华佗牌,苏州医疗用品有限公司),AnymicroDSSTM 图像采集系统,德国LEICARM2245 型石蜡切片机,2.5L厌氧产气包(青岛高科技工业园海博生物技术有限公司);试剂:苏木素-伊红(HE)染色液(北京普利莱基因技术有限公司),ALT、AST、D-乳酸检测试剂盒(南京建成生物工程研究所),内毒素检测试剂盒(酶联生物),大肠杆菌、肠球菌、双歧杆菌和乳酸杆菌选择性培养基(青岛高科技工业园海博生物技术有限公司);药品:麻醉剂采用浓度为10%的水合氯醛溶液(天津市科密欧化学试剂有限公司)。
1.3 HIRI 模型制备及取材方法 对于模型组、天枢-足三里组及非经非穴组大鼠,采用10%水合氯醛(350mg/kg)腹腔注射麻醉后,固定大鼠、备皮、消毒,于剑突下沿正中线做一约3cm 长切口,参照Filos 等[14]方法建模,即暴露第一肝门,并使用无创血管夹夹闭阻断入肝血流30min;随后松开血管夹,腹腔滴入0.5ml 生理盐水后缝合腹部切口;4h 后肝脏再灌注完成。模型构建成功后,可观察到肝脏组织呈花斑和苍白条索样纹路改变,肠壁呈深紫色并出现广泛水肿。随即经腹主动脉取血3~5mL 于采血管中,4℃直立静置30min 后于4℃、3000 r/min 离心20 min,取上清液-20℃冰箱保存备用;迅速切取末端回肠6cm 于10%中性福尔马林溶液中固定;无菌操作下取肠内容物0.1g,置于装有玻璃珠的无菌摇菌管中,加入0.9mL 0.9%生理盐水,200r/min 震荡10min,使肠内容物均质化,此即为第一稀释度10-1,备用。假手术组仅行剖腹、第一肝门暴露30min 后缝合,4h 后取材。
1.4 电针干预方法 天枢-足三里穴在建模前按照《实验针灸学》,取大鼠双侧“天枢”穴及“足三里”穴,消毒后使用0.33 mm× 13mm 的无菌针灸针直刺入相应穴位,左右各一针,针刺深度约为3mm,其中同侧“天枢”和“足三里”分别连接电针仪的正负极,并采用疏密波,频率2/100Hz,强度以能见到大鼠肌肉轻微颤动为宜,干预时间为30min。
非经非穴组在“天枢”及“足三里”外侧旁开5mm的非经非穴区,分别用针灸针直刺约3mm,其中同侧两针分别连接电针仪正负极。干预参数及干预时间同天枢-足三里组。
1.5 培养基配制方法 分别严格按照培养基配制说明书配制EMB 大肠杆菌培养基、Pfizer 肠球菌培养基、MRS 乳酸杆菌培养基以及莫匹罗星锂盐和半胱氨酸盐酸盐改良MRS 双歧杆菌培养基。
1.6 观察指标及检测方法
1.6.1 血清学方法测定血清中谷丙转氨酶(alanine transaminase,ALT) 和谷草转氨酶(aspartate aminotransferase,AST)水平 取各组干预结束后已离心的大鼠血清,严格按ALT 及AST 检测试剂盒说明书步骤操作。
1.6.2 形态学观察 取各组于10%中性福尔马林溶液中固定的肠道组织,HE 染色后光镜下观察各组肠道组织病理形态,以Chiu’s 法评价肠黏膜损伤程度:0 分,正常绒毛;1 分,绒毛顶端下间隙增宽;2 分,绒毛顶端上皮脱落、破溃;3 分,绒毛顶端破坏扩展到基底部;4 分,上皮完全脱落;5 分,固有层崩溃,出现溃疡及出血点。
1.6.3 ELISA 法测定血清D-乳酸(D-lactate,DLac)、内毒素(endotoxin,ET)水平 严格按照D-乳酸及内毒素检测试剂盒说明书步骤操作。
1.6.4 细菌培养及菌落计数 取10-1肠内容物稀释液进行10 倍倍比稀释,经预实验后,分别取稀释度为10-5、10-6、10-6、10-4标本200uL,分别滴加于EMB 大肠杆菌培养基、肠球菌培养基、MRS 乳酸杆菌培养基、 改良MRS 双歧杆菌培养基上,每一组标本分别滴加至两个培养基。然后用无菌“L”型棒分角度旋转涂抹平板,使菌液均匀的涂布在整个平皿表面。大肠杆菌(EMB)和肠球菌(EC)属置于37℃温箱中培养24 小时;双歧杆菌(BS)和乳杆菌属(LBS)置于厌氧袋中,37℃培养48小时。活菌计数:计数结果以log 菌落形成单位/g(CFU/g) 表示。公式:CFU/g=每一稀释度菌落数×稀释倍数/滴种体积(mL)。
1.7 统计学分析 以SPSS 21.0 统计软件对结果进行分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析,并采用LSD 检验进行两两比较,以P<0.05 为差异有统计学意义。
2 结果
2.1 光镜下各组大鼠肠道组织病理改变及病理损伤评分 假手术组示大致正常绒毛;模型组肠粘膜损伤明显,绒毛破损脱落严重,可见上皮层与固有层分离,伴有毛细血管扩张充血;天枢-足三里组可见上皮下间隙扩张,可见毛细血管充血,偶见绒毛破损;非经非穴组可见上皮下间隙增大、毛细血管充血,绒毛破损。见图1。Chiu’s 法评分结果显示:模型组高于假手术组(P<0.01), 天枢-足三里组低于模型组及非经非穴组(P<0.01),见表1。
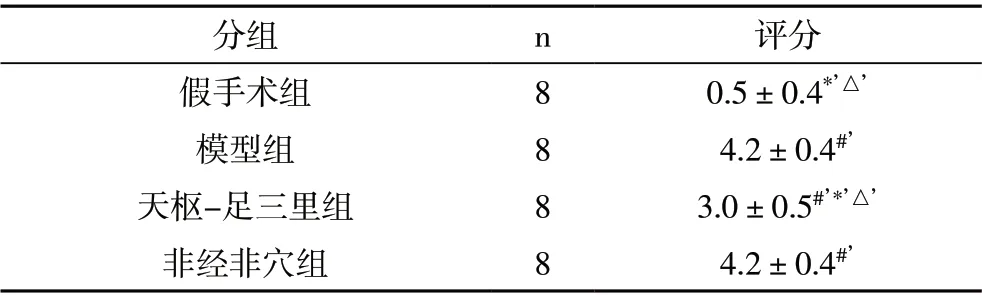
表1 各组大鼠肠道组织Chiu’s法评分比较(分)
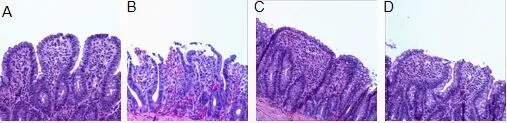
图1 各组大鼠肠道组织光镜下病理学改变(HE, ×100)
2.2 各组大鼠血清中ALT 和AST 水平比较 与假手术组比较,模型组大鼠ALT、AST 含量显著增高(P<0.01);与模型组相比,天枢-足三里组ALT、AST 含量均降低(P<0.01)。见表2。

表2 各组大鼠血清ALT和AST含量比较(卡门氏单位)
2.3 各组大鼠血清中D-乳酸及内毒素水平比较 与假手术组比较,模型组大鼠内毒素、D-乳酸含量显著增高(P<0.01);与模型组相比,天枢-足三里组内毒素、D-乳酸含量均降低(P<0.01);且天枢-足三里组内毒素含量低于非经非穴组(P<0.01),见表3。

表3 各组大鼠血清中D-乳酸及内毒素水平比较
2.4 各组大鼠肠杆菌、肠球菌、双歧杆菌及乳酸杆菌菌落数量比较 与假手术组相比,模型组大鼠肠道双歧杆菌、乳酸杆菌菌落数量降低(P<0.01),大肠杆菌菌落数量增加(P<0.01);与模型组相比,天枢-足三里组大鼠肠道菌群中双歧杆菌、乳酸杆菌菌落数量增加(P<0.01),大肠杆菌菌落数数量降低(P<0.01),但肠球菌各组之间差异无统计学意义(P>0.05)。见表4。
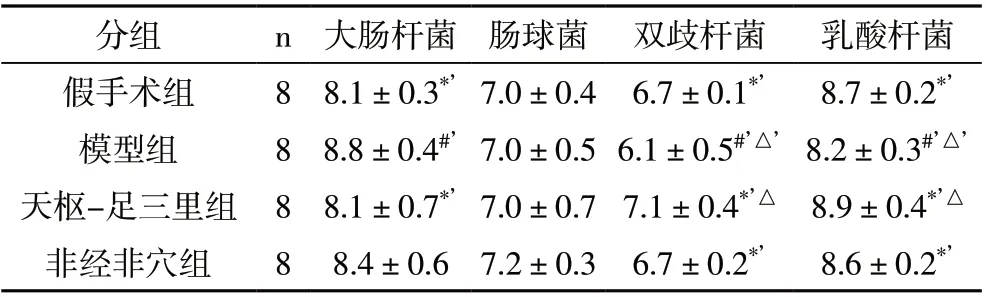
表4 各组大鼠肠杆菌、肠球菌、双歧杆菌及乳酸杆菌菌落数比较(logCFU/g)
3 讨论
有研究[13]指出,当发生肝脏缺血再灌注时,术后肝功能衰竭似乎是肝切除术后最严重的并发症之一,但造成术后肝功能衰竭的诸多因素也可能是造成肠道屏障损害的原因。而HIRI 造成肠粘膜损害进而导致肠道屏障受损的原因又可包括门脉高压、活性氧(ROS)的释放、炎症反应、细胞凋亡或者细胞坏死等[3]。已有报道证实HIRI 不仅对肝脏造成损伤,还会由于再灌注后的氧化应激以及炎症反应引起其他远隔器官如肺、肾、肠道、胰腺、肾上腺和心脏等器官的损伤,从而造成MODS。Filos 团队[14]及 Lemaire 团队[15]分别通过对大鼠及猪进行构建肝脏缺血再灌注模型,观察到细菌和内毒素的移位增加,以及肠道屏障的早期破坏。同时由于门脉阻断导致肠道水肿,肿胀的肠壁又致腹内压过高进而可能加剧肠道灌注的不足以及肠道屏障的损害[16-17]。且肠道蠕动功能的下降也会导致肠道细菌的过负荷,这也会反过来对肠粘膜造成损害[18]。在本试验中,通过对大鼠进行30min 的肝门阻断,可明显观察到肠壁由淡粉色变为深紫色并表现出广泛水肿。本实验结果也显示出模型组与假手术组相比,血清中内毒素水平更高,并且菌群数量变化明显。
在肠道微生物中,乳酸杆菌和双歧杆菌在维持肠道粘膜的定植抗性以及保护肠道屏障方面发挥了重要的作用[19-20]。而任何引起肠道微生态紊乱的因素都可能使肠道优势繁殖的细菌如大肠杆菌、肠球菌等突破受损的肠道粘膜屏障而移位。Hui-Chun Xing[21]等通过对肝脏缺血再灌注大鼠的回肠内容物进行培养,发现I/R 组乳酸杆菌及双歧杆菌菌落数少于未经过I/R 的空白组大鼠,肠杆菌菌落数多于空白组大鼠,同时I/R 组内毒素水平也明显高于空白组。同时通过添加外来益生菌乳酸杆菌及双歧杆菌菌株,发现益生菌组大鼠的肝脏、肠道病理改变以及内毒素水平均得到改善及降低。而D-乳酸是胃肠道固有细菌的产物,哺乳类动物既不产生D 乳酸,也不能或仅能缓慢代谢D-乳酸,因此循环血中D-乳酸浓度的增加实际上反映了肠黏膜通透性增加。因此,本实验通过对大鼠回肠内容物进行选择性细菌培养和血清D-乳酸水平测定,发现模型组大鼠回肠内容物中乳酸杆菌及双歧杆菌菌落数少于假手术组,肠杆菌菌落数高于假手术组,血清D-乳酸水平显著高于假手术组,也说明HIRI 使肠道粘膜受损。
现代研究表明穴位刺激(Acupoint Stimulation,AS)通过对神经、内分泌、免疫等系统的调控,减轻组织氧化应激损伤、降低炎症因子的产生、调节机体免疫功能[22],从而对多个器官和系统产生保护作用。而电针(Electric Acupuncture,EA)作为AS 的常用方法之一,在刺激强度、刺激频率等方面更具量化与标准化,从而被更加广泛的应用于临床。既往研究中[23-24],通过对不同模型大鼠进行天枢穴(ST25)、足三里穴(ST36)等穴位的不同AS,发现其肠道菌群的组成得到改善。在本实验中,通过EA 天枢(ST25)及足三里穴(ST36)后与模型组相比,发现天枢-足三里组大鼠肠道菌群中双歧杆菌及乳酸杆菌菌落数增加,大肠杆菌菌落数下降,且内毒素及代表肠道屏障功能的D-乳酸水平也有所下降。由此也可能说明电针刺激天枢及足三里穴可以保护肠道屏障功能以及改善内毒素血症。
综上,本实验结果表明,对HIRI 大鼠进行天枢(ST25)及足三里穴(ST36)的电针预处理,通过病理结果可以观察到肠道粘膜状况得到改善,血清内毒素及D-乳酸水平下降,以及肠道双歧杆菌菌落数、乳酸杆菌菌落数的增多与大肠杆菌菌落数的减少。表明电针预处理天枢(ST25)及足三里穴(ST36)可能会对HIRI 后的肠道屏障产生保护作用,使肠道菌群的组成以及内毒素血症得到改善。而在未来可以通过16S rRNA 高通量测序等方法对肠道微生物相对丰度、多样性以及整体结构与组成进行更详尽的分析,从而更好的指导临床应用。

