PD-1抑制剂所致皮肤不良反应的临床诊治
徐欣植, 杨 骥
复旦大学附属中山医院皮肤科,上海 200032
程序性细胞死亡受体1(PD-1)抑制剂是一种免疫检查点抑制剂(immune checkpoint inhibitors, ICI),是治疗恶性肿瘤的有效免疫制剂,已成功应用于多种类型实体肿瘤的治疗。多种类型的肿瘤细胞高表达程序性细胞死亡受体-配体1(PD-L1),其与T细胞表面上的PD-1结合后抑制T细胞活化,诱导淋巴细胞凋亡,从而逃脱免疫系统的监视和杀伤,降低自身抗肿瘤反应。
PD-1/PD-L1抑制剂类药物通过阻断上述抑制性信号通路,增强细胞免疫应答,破坏这种抑制抗肿瘤的反应,从而激活对抗肿瘤的免疫系统,起到抗肿瘤作用。但是,在PD-1/PD-L1抑制剂产生抗肿瘤效应的同时,也会产生相关的不良反应,称为免疫相关不良反应(immune-related adverse events, irAEs),可累及多个器官及系统[1-2],累及皮肤时可引起皮疹、结缔组织病等或使原发皮肤病加重。本文收集了近年收治的7例与PD-1抑制剂相关皮肤不良反应患者,对其诊治报告如下。
1 资料与方法
1.1 病例1 患者男性,71岁,诊断为原发性肝细胞肝癌,接受PD-1抑制剂信迪利单抗(sintilimab) 200 mg每3周静脉滴注,免疫治疗前1年起口服甲磺酸阿帕替尼治疗。PD-1抑制剂治疗1个月后,患者全身出现黄豆至钱币大小红色、紫红色丘疹、斑片,部分呈靶形(图1A)。患者双眼球结膜、睑结膜充血发红,上下唇糜烂结痂,考虑“多形红斑(PD-1抑制剂相关)”。停用PD-1抑制剂,经甲波尼及抗组胺药物系统治疗后,患者皮肤症状改善。
1.2 病例2 患者男性,56岁,右颈部低分化鳞状细胞癌。患者使用多西他赛化疗后,肿块加速增大,停止化疗,予PD-1抑制剂纳武单抗(nivolumab)240 mg每2周静脉滴注,联合放疗。免疫治疗1周后,患者躯干、四肢多发皮疹,皮疹呈多形红斑、水疱、大疱,尼式征阴性(图1B),考虑“大疱性类天疱疮(PD-1抑制剂相关性皮疹可能性大)”。暂停使用PD-1抑制剂,并局部应用糖皮质激素软膏,患者皮肤症状逐渐好转。
1.3 病例3 患者男性,63岁,复发性肝恶性肿瘤,单独使用免疫治疗:PD-1抑制剂卡瑞利珠单抗(camrelizumab,SHR-1210)180 mg每2周静脉滴注。治疗9个月后,患者头面部及躯干出现多发粟米至黄豆大小鲜红及暗红色半球形丘疱疹(图1C),诊断为“血管瘤(PD-1抑制剂相关)”。综合评估后,继续给予患者camrelizumab治疗,同时予糖皮质激素软膏外涂,患者皮肤症状未愈但稍好转。
1.4 病例4 患者男性,65岁,肝细胞肝癌术后,单独使用免疫治疗:PD-1抑制剂camrelizumab 180 mg每2周静脉滴注。治疗3周后,患者左侧头皮出现一大小约2 cm×3 cm的红斑,伴破溃,见组织坏死、化脓(图1D),考虑PD-1抑制剂相关皮疹。患者继续使用camrelizumab治疗,同时应用抗生素制剂处理皮疹后好转。
1.5 病例5 患者男性,61岁,肺小细胞癌伴淋巴结转移,单独使用PD-1抑制剂(具体不详)。治疗4周后,面部出现散在红斑,以双侧鼻翼及唇周为中心,逐渐蔓延至额、颈、胸部,伴瘙痒;并自觉肌肉疼痛,以腰部、双下肢为主。数日后病情进展,面部尤其眼睑及口唇肿胀明显,肌肉酸痛伴乏力症状进行性加重,来本院就诊。检查结果:肌酸激酶>4 000 U/L;抗转录中介因子1γ(TIF1γ)抗体、抗Ro-52抗体;四肢肌力Ⅰ~Ⅱ级。结合皮疹、肌肉症状、肌炎特异性抗体等,考虑PD-1抑制剂相关皮肌炎。给予激素+人免疫球蛋白+环孢素治疗后,患者肌酸激酶下降,面部皮疹较前消退,四肢肌力逐渐缓慢恢复。
1.6 病例6 患者男性,28岁,经典霍奇金淋巴瘤复发,有寻常型银屑病病史。患者化疗后单独接受sintilimab 200 mg每3周静脉滴注治疗。首次治疗15 d后银屑病复发,躯干及四肢伸侧出现覆鳞屑的红色斑块(图1E)。患者继续接受sintilimab治疗,银屑病病情加重,考虑PD-1抑制剂相关银屑病加重,采用口服阿维A及外用糖皮质激素软膏控制皮疹。
1.7 病例7 患者男性,65岁,肝细胞肝癌,有寻常型银屑病病史。接受外科手术、化疗和放疗的综合治疗后,单独接受sintilimab 200 mg每3周静脉滴注,首次治疗20 d后,躯干银屑病斑块明显增多、加重(图1F)。考虑PD-1抑制剂相关的银屑病加重,通过口服阿维A及外用糖皮质激素软膏来控制皮疹。
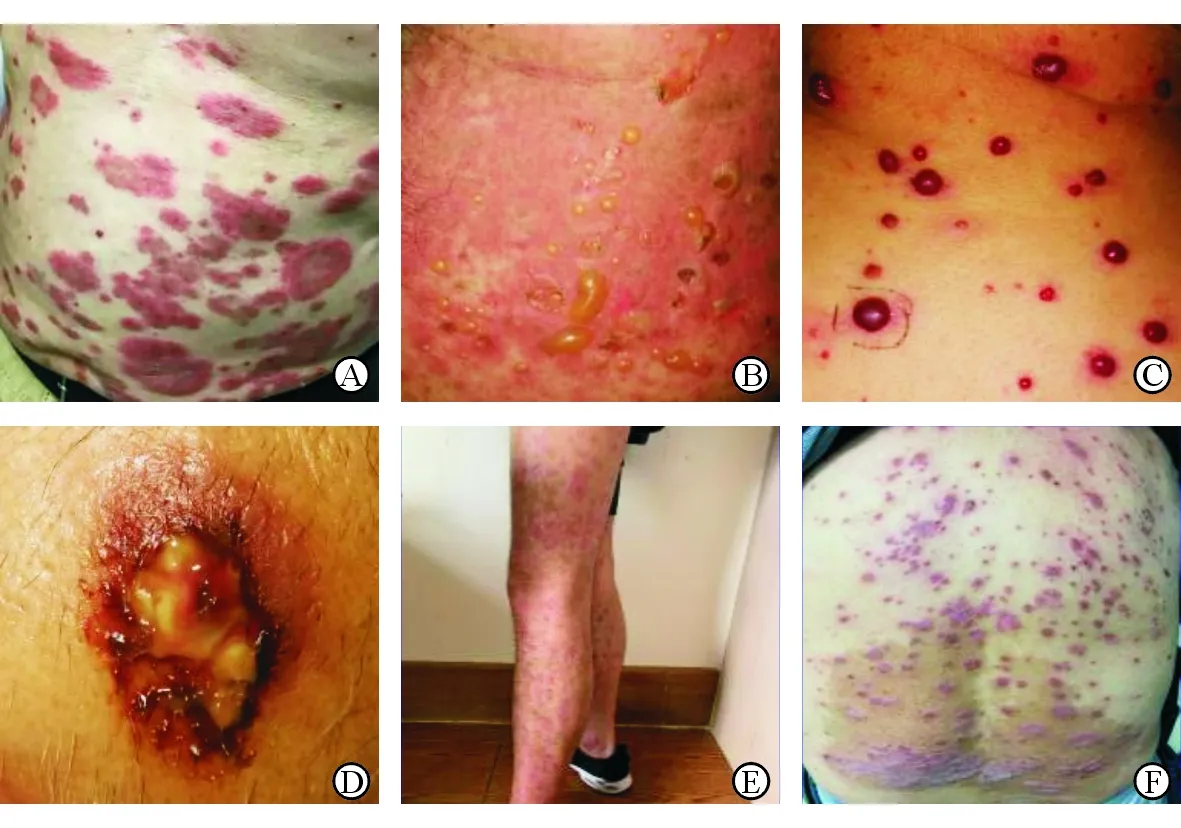
图1 PD-1抑制剂相关皮肤不良反应
2 讨 论
皮肤不良反应是应用PD-1/PD-L1抑制剂类药物后的常见irAE,常发生于用药后的2~5周,最常见的皮肤改变为斑丘疹,发生率为47%~68%[3],也可表现为各种新发皮疹、瘙痒、白癜风等,甚至出现Steven-Johnson综合征、大疱性类天疱疮等严重皮肤不良反应[4]。PD-1/PD-L1抑制剂在抑制自身反应性T细胞活性方面起重要作用,而这些T细胞可以抵御自身免疫性疾病,因此应用PD-1/PD-L1抑制剂可引起各种皮疹及免疫性皮肤病。同时,皮疹的出现可能提示免疫系统激活。免疫相关皮肤不良反应与PD-1/PD-L1抑制剂较好的反应率、患者无进展生存期和总生存期延长显著相关[5]。然而,PD-1/PD-L1抑制剂相关皮疹的具体性质及其潜在的短期和长期临床意义尚未明确。
本研究7例患者均在应用PD-1抑制剂后出现皮肤不良反应,包括新发皮疹、新发结缔组织病和原发皮肤病加重三类,未行皮肤活检。应用PD-1抑制剂后,病例1~4出现新发皮疹;病例5新发结缔组织病(皮肌炎);病例6~7为原发皮肤病(银屑病)加重。PD-1抑制剂致皮疹发生的时间也较为重要,7例患者的皮肤不良反应发生在治疗后1周至9个月,其中6例发生于1个月内。本文中已知的PD-1抑制剂包括sintilimab、nivolumab、camrelizumab。近年来有它们导致皮肤不良反应报道,如sintilimab导致的最常见的治疗相关不良反应事件是皮疹[6];nivolumab可诱发多种皮肤不良反应,包括瘙痒、苔藓样病变、湿疹、白癜风、银屑病、大疱反应、痤疮样皮疹等[7];camrelizumab引发的血管瘤,实质为与免疫相关的反应性皮肤毛细血管增生症(RCCEP),发生率很高,可不停用camrelizumab给予对症治疗[8-9]。
PD-1抑制剂相关皮肤病除了各种皮疹,也可能诱发结缔组织病,如红斑狼疮、皮肌炎等[10-11]。PD-1抑制剂引起的皮肌炎皮疹分布和形态与一般皮肌炎相似,但炎症损伤和皮疹更重,肌肉损伤也更严重,肌酶水平更高,且常伴心肌损伤。除激素治疗外,常需要给予患者静脉丙种球蛋白冲击和免疫抑制剂(如环磷酰胺、环孢素A)等联合治疗。
银屑病是一种慢性全身性炎症性疾病,白细胞介素23(IL-23)/辅助性T细胞17(Th17)途径发挥重要作用;银屑病患者的IL-17水平高于健康人[12]。有文献[13-14]报道过nivolumab导致相关银屑病恶化病例。临床研究[15]显示,PD-1抑制剂治疗后,银屑病患者的Th1和Th17反应增强,这可能是其银屑病加重的原因。
ICI类药物在我国属于新型抗肿瘤药物,逐渐在抗肿瘤方面展现出明显优势与巨大潜力。然而,其不良反应也需要引起临床关注,包括皮肤不良反应。目前,ICI新药研发进展迅速,其皮肤毒性需要进一步通过病例总结进行研究,进而指导临床正确判断,并给予积极的应对措施。
利益冲突:所有作者声明不存在利益冲突。

