不同囊胚活检方法用于植入前遗传学检测的临床效果
宋 歌 米冬青 蒋 彦 田 耕 袁景川 耿彩平 苗穗兵 吴小华
河北省石家庄市妇产医院(河北医科大学附属妇产医院)( 050011)
胚胎植入前遗传学检测技术(PGT)是在体外受精-胚胎移植技术(IVF-ET)的基础上,使用全染色体筛查技术,对体外受精胚胎进行植入前检测,以避免染色体不平衡胚胎植入宫腔。胚胎活检可以获取细胞进而为PGT提供可检测的遗传物质。随着体外胚胎培养技术的发展,越来越多的生殖中心逐渐将胚胎培养至囊胚,囊胚的滋养层细胞活检能够得到更多的细胞用于PGT,显著降低对胚胎的损伤、提高诊断的准确性,已经成为目前PGT的主要活检方式[1-3]。囊胚活检方法中目前使用较多的是在胚胎发育至第3天(D 3)打孔[4],称之为D3打孔活检法。笔者探索开发了一种新的囊胚活检方法,即D5打孔孵出/D6皱缩后活检相结合的方法(简称新D5/D6活检法),本文回顾性分析D3打孔活检法和新D5与D6活检法的结局,探讨新D5/D6活检法的有效性。
1 对象与方法
1.1 研究对象
2019年1月—2020年6月在本中心接受PGT且符合纳入标准的63例患者为研究对象。纳入标准:女性年龄≤40岁,≥8个成熟卵母细胞,第3天优质胚胎≥3个[5]。此研究通过石家庄市第四医院医学伦理委员会批准,患者夫妻双方在经过充分的遗传咨询后,要求选择并签署PGT知情同意书。PGT周期按活检方法分成两组,其中D3打孔活检组(37个周期),新D5/D6活检组(38个周期)。
1.2 胚胎培养
本研究中PGT周期的卵泡刺激方案不做限制,人绒毛膜促性腺激素(hCG)注射后36h取卵,取卵日全部采用卵胞浆内单精子显微注射(ICSI)受精,原核观察时间在受精后16~18h,之后采用G系列序贯培养系统37℃三气培养箱(5%CO2,5%O2和90%N2)中培养胚胎。第3天卵裂胚根据细胞个数、碎片大小和均一性对胚胎进行评分[6],两种活检方法均挑选2PN来源的≥4细胞且胚胎评分≥2级的卵裂胚[7]继续培养;D5和D6囊胚质量评估基于Gardner囊胚评分标准[8],根据囊胚的扩张程度和囊胚的大小评价内细胞团和滋养外胚层细胞质量[9]。将D5或D6评分≥3期,内细胞团和滋养层细胞评级中不同时含C级的囊胚定义为可利用囊胚[10]。囊胚扩张程度≥3期且≥BB级的囊胚定义为优质囊胚[11]。为了减少误差,两名技术熟练的胚胎学家每周轮流进行胚胎分级和滋养层活检。
1.3 活检样本采集
1.3.1D3打孔活检组在胚胎培养D3,对继续培养的卵裂胚,选择避开卵裂球位置(卵裂球与透明带的间隙)进行激光打孔(脉冲0.18 ms),随后更换新的序贯培养液(G2)入培养箱继续培养至第5,6天,为了更好的进行滋养层细胞活检,通过观察胚胎和囊胚评分(Gardner 评分法)[8],对可利用囊胚活检。
1.3.2新D5/D6活检组D5早上观察胚胎发育情况,对4期囊胚立即用激光(脉冲0.18 ms)在内细胞团的对侧穿透性打孔,放入37℃、CO2培养箱中培养5~6h,观察滋养层细胞孵出情况,大多数囊胚滋养外胚层会孵出。①对于滋养层部分孵出以后的囊胚直接吸取孵出的滋养层细胞部分,采用较小的激光(脉冲长度0.12 ms)对准细胞连接处单点激光上下位置打2下,同时活检针适当抽吸,边抽吸边牵拉,出现明显断裂点后,持卵针松开囊胚后与活检针配合进行机械切割,即可将一定数量的滋养层细胞切割下来。②对没有孵出的囊胚,用激光(脉冲0.18 ms)对囊胚内细胞团对侧滋养层细胞间隙进行穿透性打孔,待囊胚轻微皱缩后,活检针直接从透明带上所开的缝隙进入胚胎内部,吸取一定数量滋养层细胞(3~8个)后,利用负压将其沿原缝隙拽出,同时活检针微微抖动, 吸出比合适数量多一些的细胞后,再稍微吐出一些,出现一个较细的凹陷部位,用激光(脉冲0.12 ms)沿着此凹陷部位的细胞连接处单点切割滋养层细胞,同时活检针适当抽吸,边抽吸边牵拉,直至完全分离所需要的滋养层细胞。D6早上观察胚胎发育情况,对于4期囊胚,遵循D6囊胚活检一定要早的原则,采用不提前打孔皱缩后活检的方法,同方法②。每枚囊胚活检3~10个细胞(400×高倍镜下计数有核细胞),活检后的囊胚逐一进行玻璃化冷冻,于液氮罐中保存,在合适时机将检测结果正常的囊胚进行解冻并移植。
1.4 二代测序技术(NGS)及PGT结果的解读
将活检细胞经清洗后装入含有2μl单细胞裂解液的PCR管中,-20℃保存待用。单细胞全基因组扩增后,采用二代测序技术进行PGT。PGT结果选择染色体平衡、无单基因病发病风险的胚胎记录为检测结果正常的囊胚,行单囊胚移植。
1.5 冻融胚胎移植(FET)内膜准备及黄体支持
囊胚移植的内膜准备分为自然周期(NC)和人工周期(HRT)[12]。NC适用于月经周期规律的患者, 通过经阴道超声监测, 优势卵泡直径≥14 mm, 子宫内膜厚度≥8 mm, 排卵后第5日为解冻囊胚日。HRT 适用于月经不规律、排卵障碍以及NC 内膜或卵泡发育欠佳的患者, 以肌内注射黄体酮为第0天,第5天进行囊胚解冻复苏移植。
1.6 观察项目
通过D3优胚率(D3优质胚胎数/卵裂胚胎数),囊胚形成率(囊胚形成数/培养囊胚胚胎数),可用囊胚形成率(可利用囊胚数/形成囊胚数),临床妊娠率(妊娠周期数/移植周期数)等进行评估。单囊胚复苏移植后第14天,检测血清hCG≥ 30 U/L为生化妊娠。移植后 30 d B超示宫内有胎囊和胎心搏动判定为临床妊娠。确定临床妊娠后定期随访产前诊断(羊水穿刺等)至胎儿出生。
1.7 统计学分析
2 结果
2.1 一般资料
本研究纳入63例共75个周期,包括染色体病63周期,单基因病6周期,复发性流产6周期。两组对象年龄、体质指数(BMI)、抗苗勒管激素(AMH)水平、不孕年限、促性腺激素(Gn)总量均无差异(P>0.05)。见表1。
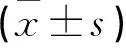
表1 两组一般情况比较
2.2 实验室指标
活检囊胚数348枚,检测成功339枚,活检成功率97.4%,PGT检测结果正常囊胚率41.9%(142/339),正常囊胚检出周期率76.0%(57/75)。两组获卵数、 MⅡ卵数、正常受精率、D3优胚率、D3可用胚胎率、活检成功率无差异(P>0.05)。新D5/D6活检组囊胚形成率、可利用囊胚率、活检D5囊胚率高于D3打孔活检组,活检滋养层细胞数量低于D3打孔活检组(均P<0.05)。见表2。
2.3 移植结局
因自然妊娠等原因有6例未行囊胚移植,共复苏移植囊胚51周期,包括D3打孔活检组20个周期,新D5/D6活检组31个周期。二次移植6例,其中5例第1次移植未妊娠,1例第1次移植流产,二次移植均妊娠。周期妊娠率64.7%(33/51),33个妊娠周期中,流产3例,胚胎停育2例,异位妊娠1例,目前共获得19例健康新生儿,均无明显出生缺陷发生,尚有8例妊娠中。两组妊娠率、囊胚复苏率无差异(P>0.05)。见表2。

表2 两组实验室指标比较

指 标 D3打孔活检组(n=37)新D5/D6活检组(n=38)t/χ2PD3可用胚胎率(%)88.4(366/414)88.9(375/422)0.0430.835 囊胚形成率(%)64.8(237/366)72.0(270/375)4.500.034 可利用囊胚率(%)63.7(151/237)73.0(197/270)5.0170.025 活检D5囊胚率(%)63.6(96/151)74.1(146/197)4.4790.034 活检滋养层细胞数量(个,x±s)6.38±1.505.18±1.233.7820.001活检成功率(%)96.7(146/151)98.0(193/197)0.5570.456PGT检测正常囊胚率(%)43.2(63/146)40.9(79/193)0.1680.705囊胚复苏率(%)95.0(19/20)100(31/31)1.5810.198周期妊娠率(%)60.0(12/20)67.7(21/31)0.3190.612
3 讨论
囊胚活检首选激光法破膜,因为激光破膜速度快,能有控制地打出规范的小孔,它在技术上要求较低,需要较少的培训[13]。虽然D3打孔活检法操作简单、容易掌握,但该方法也有如下不足:①很多卵裂胚不一定形成囊胚,增加了无效工作量;②在D3打孔,孵出细胞存在较多不确定环节,如内细胞团处于活检位置、囊胚过早孵出、孵出不充分,这样就要重新二次打孔,操作难度加大,活检操作时间不能确定等;③提前打孔导致形成较少数目的囊胚滋养层细胞、囊胚滋养层细胞大、囊胚滋养层细胞提前孵出的情况等[14];④有文献报道,D3打孔后可能影响胚胎发育潜能[15-17]。
目前关于囊胚活检的操作步骤尚无共识,文献中也缺少相应的数据,有关囊胚活检时机的选择以及囊胚活检的细节也鲜有提及。囊胚腔扩张时间不固定,反复开箱观察会影响胚胎的发育,胚胎学家甚至需要每天不定时观察囊胚是否扩张和孵出,这些都是亟待解决的问题[18]。为此探索D5打孔孵出联合D6皱缩后活检法(新D5/D6活检法),第5天(D5)囊胚的细胞间紧密联系度较差,活检切割的黏连度较高,这些决定了D5囊胚最好采用打孔后孵出再活检的方法,在D5观察到形成囊胚后,在内细胞团对侧打孔,此时囊胚已经发育成熟,囊胚腔已经完全扩张,透明带变薄,打孔皱缩后囊胚会以一个比较稳定的速度扩张,并在打孔处使一定的细胞孵出,对孵出的滋养层细胞进行活检切割,操作更加便利,能够提高活检效率。相反,D6囊胚细胞间紧密联系度增加,较易切割,可以采用不提前打孔的方法,直接皱缩活检,不用等到D6下午,减少体外培养时间,减少激光切割的创面,减小受影响细胞的比例。
本研究结果显示,新D5/D6活检组的囊胚形成率、可利用囊胚率和活检D5囊胚率高于D3打孔活检组,说明D3打孔活检法与D5打孔孵出/D6皱缩活检法相比可降低囊胚的发育潜能。Zhao[7]的研究也证明新的囊胚活检方法能够获得更多的囊胚用于滋养外胚层活检,这与本研究结果一致,但其对于新活检方法的介绍较含糊,也没有提及不同发育速度囊胚的细胞间紧密度和活检切割的黏连度等方面,不能给胚胎实验室操作人员提供明确的参考。
笔者的新D5/D6活检法D5在囊胚上只打1个孔,减少囊胚在冷冻过程中的损伤,减少孵出嵌顿导致胚胎着床失败。而且笔者在实际操作中,采用新D5/D6活检法,每天只要观察一次胚胎就能确定囊胚是否当天需要活检,使活检操作人员对活检时机把握得更加明确,大大降低了对囊胚发育的干预频率,对于不同发育速度的囊胚,采用个性化活检方案,更加符合胚胎的自然发育规律。
与D3打孔活检组相比,新D5/D6活检组的临床妊娠率、囊胚复苏率无显著性差异,有待加大样本量来进一步研究。有学者的研究发现活检滋养外胚层细胞的数量可能影响妊娠结局,随着活检滋养层细胞数量的增加,其植入率会降低[19]。本研究中,D3打孔活检组与新D5/D6活检组相比, 活检滋养层细胞数量明显增高,可能与活检方法本身导致的囊胚过早孵出、孵出细胞较多有关。
总之,使用新的囊胚活检方法可使囊胚活检变得更加简单,使活检操作人员对活检时机把握得更加明确,与经典的D3打孔活检法相比是有效的。

