无曲液态米酒酿酒酵母筛选
郑瑞龙,杨传佳,钮成拓,郑飞云,王金晶,李 崎,刘春凤*
(1.工业生物技术教育部重点实验室(江南大学),江苏 无锡 214122;2.江南大学酿酒科学与工程研究室,江苏 无锡 214122;3.江南大学生物工程学院,江苏 无锡 214122)
米酒是以糯米为主要原料,经液化、糖化、发酵酿造而成[1]。我国糯米酿酒历史悠久。传统米酒多为固态或半固态发酵,经浸米、蒸煮、加曲、发酵、压榨、澄清、煎酒、陈化、勾兑等步骤,采用“酒曲复式发酵法”[2]。一般认为,米曲是米酒酿造过程中重要微生物来源,可为米酒酿造过程提供淀粉酶、糖化酶和蛋白酶等丰富酶系,但传统米酒生产工艺效率较低,能耗较高,浸米废水对环境污染严重,且无法保障米酒批间风味稳定性[3]。如今,酶制剂在酿造业应用广泛,盛凤云等利用高温淀粉酶将粉碎原料粉碎后液化,取代传统工艺中的浸米和蒸米,并初步估算能量,可节省50%以上[4]。张敏将酶法液化的糯米粉进一步添加糖化酶和麦曲进行多酶酿造米酒[5]。但目前液态发酵米酒多为酒曲与酶制剂协同作用,中国酿酒协会曾提出从传统双边发酵改为先糖化后发酵的清液发酵技术可行[6]。与传统发酵米酒(曲和酵母联合处理)相比,使用酶法液化制备糯米糖液,接种纯种酵母液态米酒,使米酒产品风味品质更可控,并且可以提高劳动生产率和机械水平,有利于现代化工业生产应用。
酵母性能优劣不仅决定米酒酿造效率,还影响米酒风味品质[7-8]。我国传统米酒酒曲中含有多种微生物,其中酿酒酵母(Saccharomyces cerevisiae)是酒曲中主要产酒精功能菌,对米酒质量和发酵效率有较大影响[9-10]。酒曲中酵母包括酵母属、假丝酵母属、复膜孢酵母属和毕赤酵母属等[2],目前对适用于米酒纯种发酵的酿酒酵母研究较为缺乏。伍保龙等从米酒酒曲中分离得到产酒精能力强的酿酒酵母,但并未对其风味进行分析及米酒纯种发酵[11]。邹凌波使用从酒曲和米酒醪中分离得到的酿酒酵母协同糖化酶进行双边发酵[12]。对于适用于纯液态发酵的酿酒酵母筛选应用仍鲜有报道,菌株多样化为酿造酒生产提供丰富多样性[13],筛选适用于液态米酒纯种发酵的酿酒酵母具有重要价值与意义。为此,本研究以分离自米曲样品中潜在酿酒酵母和实验室保藏共计198株菌株为研究对象,测定其产气能力、乙醇生产能力和发酵速率等,并分析菌株发酵所得米酒理化指标、挥发性风味物质及其香气贡献,最终得到具有优良潜力的酿酒酵母。该研究对纯种发酵液态米酒开发具有重要参考价值。
1 材料与方法
1.1 材料与试剂
糯米购置于当地市场;米曲购自四川、湖北、江西、广西、云南、江苏等地区;菌株YSHJ为上海某酒厂提供,应用于米酒发酵,为酿酒酵母属。有机酸、挥发性化合物标准品为色谱纯,购自美国Sigma-aldrich公司;试验药品均为分析纯,购自国药集团化学试剂有限公司。
1.2 培养基
YPD培养基:用于酵母培养,主要成分包括葡萄糖20 g,蛋白胨20 g,酵母粉10 g,琼脂粉20 g(用于固体培养基),蒸馏水1 000 mL,115℃灭菌15 min;
商业Biggy agar培养基:由青岛海博生物技术有限公司提供;
TTC底层培养基:葡萄糖50.5 g,蛋白胨10 g,酵母浸膏7.5 g,酸性磷酸钾5 g,硫酸镁2 g,柠檬酸1.35 g,琼脂30 g,115℃灭菌15 min,灭菌冷却后加入氨苄青霉素1.0 g;TTC上层培养基(g·L-1):葡萄糖0.5 g,琼脂15 g,115℃灭菌15 min,冷却后加入TTC(2,3,5-氯化三苯基四氮唑)0.5 g。
1.3 方法
1.3.1 酵母菌株分离
购买来自四川、湖北、江西、广西、云南、江苏等地区12种米酒酒曲。分别取2 g酒曲样品添加至含玻璃珠50 mL无菌生理盐水中,25℃、180 r·min-1活化20 min后,将菌液稀释涂布至添加含有1 g·L-1丙酸钠、25 mg·L-1氨苄抗菌YPD固体平板中,28℃培养48 h,观察菌落生长情况。挑选出具有形态圆形、表明光滑、边缘整齐菌落,在YPD平板上作二次划线分离,纯化分离物接入YPD液体甘油管中于-80℃保存,并编号。
1.3.2 菌株起始发酵能力
将甘油管保藏菌株接种于YPD液体试管中,28℃、180 r·min-1培养活化2次后接种至糖度为11%含杜氏小管糯米汁培养基中,25℃静置培养48 h,保留起酵速度快菌株用于下一级筛选。
1.3.3 菌株硫化氢生成能力
在YPD液体试管中活化起酵能力较好菌株,在Biggy agar平板上点样5μL过夜培养物,28℃静置培养48 h,根据菌落颜色选择低产或不产硫化氢菌株用于下一级筛选(菌落颜色越浅,硫化氢生成能力越低)。
1.3.4 菌株乙醇生成能力
将以上筛选得到酵母菌株在YPD液体试管中活化,在TTC下层平板上点样5μL,28℃培养24~48 h,倒入TTC上层培养基,28℃避光培养2~4 h,挑选菌落颜色较深,产酒精能力强菌株。
1.3.5 糯米汁糖液制备
粉碎糯米按照料水质量比1∶6,于50℃投料。添加高温α-淀粉酶,升温至95℃,保温30 min,升温至100℃,煮沸10 min;冷却至50℃,按200 U·g-1糯米添加蛋白酶,保温30 min;升温至62℃,按180 U·g-1糯米添加糖化酶,保温120 min;过滤后煮沸10 min。所得糯米糖液根据需要稀释成目标糖度,于高压蒸汽灭菌锅中105℃灭菌10 min。
1.3.6 液化法米酒发酵试验
在糯米汁中接种酿酒酵母菌株,以米酒酵母YSHJ为对照。
具体发酵方法为:糯米汁糖度16%,发酵规模500 mL,装液量60%,发酵体系中酵母接种量为107cfu·mL-1,25℃发酵,并监测其失重,直至24 h内失重<0.2 g·300 mL-1,发酵结束后离心过滤获得米酒。每批次发酵设置3个生物学平行。
1.3.7 液化法米酒分析检测
1.3.7.1 米酒理化指标测定
米酒理化指标分析过程参照黄酒国家标准[14]和《酿酒工业分析》[15]方法。
1.3.7.2 米酒有机酸含量测定
将酒样适当稀释后,经C18固相萃取柱过滤后用0.22μm水系滤膜过滤备用。
色谱条件:色谱柱Waters X select HSS T3(4.6 mm×250 mm);流动相:0.02 mol·L-1(pH 2.5)磷酸二氢钾缓冲液;流速:0.5 mL·min-1;检测波长:210 nm;进样量:10μL;柱温30℃。根据峰保留时间和其峰面积与相应标准品比较,使用标准曲线作定量测定。
1.3.7.3 米酒挥发性风味物质测定
通过SPME-GC-MS测定米酒中挥发性化合物,酒样处理条件为:将8 mL酒样加入20 mL洁净螺口顶空瓶中,并加入2.0 g NaCl和2-辛醇内标(终浓度50μg·L-1)。45℃预热5 min,萃取60 min。萃取结束后,将75μm Car/PDMS萃取头插入进样口,250℃解吸附5 min。分析条件为:EG-20 m弹性石英毛细管柱,30 m×0.25 m×0.25μm;载气为高纯氦气,恒定流量为0.8 mL·min-1;升温程序:从180℃开始,保持2 min,以3℃·min-1升温到230℃,保持10 min;进样口温度250℃,出样口温度200℃;检测电压350 V。
MS条件:EⅠ离子源,发射电流200μA,电子能量70 eV,扫描范围20~550 U。未知化合物定性通过与NⅠST 05质谱库中标准谱图比对确定,化合物定量通过在体积分数10%乙醇溶液中配制待测化合物标准溶液,根据定量化合物与内标化合物峰面积比值与定量化合物浓度绘制标准曲线,依据标准曲线确定果酒中挥发性化合物浓度。
1.3.8 米酒感官品评
感官品评小组由2名具有专业品评经验老师和8名经酒类品评训练并选拔出的研究生组成,小组成员定期开展米酒感官品评训练后作为品评员完成感官品评。感官品评评分和评价标准如表1所示[2]。

表1 感官品评评价标准Table 1 Organoleptic evaluation criteria
1.3.9 菌株18S rDNA鉴定
将甘油管保藏菌株于10 mL YPD培养基中,28℃、180 r·min-1过夜活化,随后转接至10 mL YPD培养基中,28℃、180 r·min-1培养18~24 h。取适量培养液离心1 min(12 000 r·min-1),弃上清,采用酵母DNA提取试剂盒提取菌体DNA,选用酵母ⅠTS通用引物(ⅠTS1-F:5′TCCGTAGGTGAACCTGCGG 3′;ⅠTS4-R:5′-TCCTCCGCTTATTGATATGC 3′)扩增基因组DNA,测序PCR产物。采用BLAST方式将测定的18S rDNA序列与Gen-Bank中酵母菌序列作比对,构建菌株系统发育树。
1.3.10 数据处理与分析
研究使用GraphPad Prism 8.4.3绘图,使用SPSS 26.0作显著性、主成分等统计分析,数据为3个独立试验平均值和标准差表示。
2 结果与分析
2.1 酵母菌株筛选
试验从米曲样品中分离得到菌株108株及实验室保藏菌株90株,共198株菌株用于下一步试验(见表2),表中短线以上数目为进入下一筛选阶段菌株个数。

表2 菌株筛选结果Table 2 Screening results of strains
对试验菌株作杜氏小管发酵试验,25℃恒温静置培养48 h。结果表明,57株气体全部充满杜氏小管且均有一定酒精感,47株气体占杜氏小管2/3,该104株为起酵能力较优菌株。酵母在发酵过程中伴随含硫化合物合成而产生H2S,H2S挥发性较强,具有臭鸡蛋不愉悦气味。通过使用BⅠGGY琼脂培养基显色程度对杜氏小管筛选得到酵母产H2S能力作表征。其中29株菌株菌落为白色或黄色,认为其低产硫化氢。进一步通过TTC筛选平板,选择菌落颜色深红色产酒精能力强10株菌株开展后续研究。
调整糯米汁发酵培养基糖度为12%,接种10株菌株,并以米酒酵母YSHJ为对照,该菌株为酒厂提供,并已应用于米酒生产。测定发酵速度与酒精度。各菌株发酵速率根据其CO2生成速度判断,斜率越大则发酵速度越快,结果如图1显示,菌株21和26的CO2失重最高,分别为4.86和4.84 g。菌株13和40发酵速度最慢。所有菌株中,有7株菌株酒精度高于对照菌株。

图1 不同菌株发酵性能Fig.1 Fermentation ability of different strains
2.2 米酒发酵
基于上述试验筛选得到7株发酵性能较为优良菌株,开展米酒发酵试验,同时以米酒酵母YSHJ为对照组,发酵完成后,分析其基础理化指标、挥发性风味化合物。
2.2.1 米酒理化指标分析
米酒基础理化指标如表3所示,除菌株30和127发酵时间较长,12 d完成发酵,其余菌株发酵时间均为10 d。不同菌株发酵米酒酒精度为7.02%~7.19%V/V,无显著差异,菌株21、30、184发酵米酒残糖高于对照菌株YSHJ。相较于对照菌株,菌株26、89和167发酵米酒具有更高酒精度和更少残糖,具有潜在发酵优势。除菌株21、26具有较高总酸含量外,其余菌株发酵米酒总酸含量低,适量酸可提高米酒品质。菌株21、26、127和167所得米酒具有较高甘油含量,甘油是酵母酒精发酵过程中主要副产物之一,可为酒体提供圆润、柔滑口感,一定含量甘油可增加米酒复杂性。

表3 米酒理化指标Table 3 Physicochemical indices of rice wine
2.2.2 米酒有机酸含量分析
米酒中有机酸种类丰富,共检出有机酸8种,其中含量最高两种有机酸为柠檬酸和乳酸。有机酸有助于稳定酒体香气,提高酒品质,但含量过高则表现酸感突出、酒质粗糙。柠檬酸酸味较长,口感圆润清爽,但过量则辣口[16],对照菌株发酵所得米酒产生的柠檬酸为0.71 g·L-1,是所有菌株中产柠檬酸量最高菌株。乳酸口感柔和,增加酒体醇厚度[17],菌株167发酵的米酒乳酸含量最高,达0.55 g·L-1,作为一种温和有机酸,更高浓度乳酸可能使酒体更柔滑。琥珀酸又称丁二酸,具有酸味和咸苦味可调和酒体,其可形成丁二酸二乙酯等化合物,对酒的风味具有重要影响[18],菌株21、26、127和30发酵的米酒均具有含量较高的琥珀酸。苹果酸酸感清爽,呈味持久且略带刺激性,菌株之间苹果酸含量差异小,占总有机酸含量12%~15%(见表4)。

表4 米酒有机酸组成Table 4 Organic acid components of rice wine (g·L-1)
2.2.3 米酒感官品评
按照黄酒品评描述对米酒作感官品评,表5显示各菌株发酵所得米酒感官品评得分结果。所有菌株发酵米酒色泽差异较小,酒体澄清透明,但光泽较弱。香气指标下各菌株具有一定差异,其中菌株21、26发酵米酒香气较为馥郁,酒香纯正且有糯米香,菌株184和YSHJ发酵米酒酒香较为突出,但米香略弱,菌株89和127发酵米酒香气愉悦度低,有轻微异杂味,整体酒香、米香不足。发酵米酒酒体普遍清爽柔和,其中,菌株21、26和YSHJ发酵米酒的酒体更为协调,酸甜度较为适中。菌株127发酵米酒具有明显辣口感和酸感,口感较差。典型性上虽得分差异小,但菌株21、26和YSHJ发酵米酒相较于其他菌株米酒发酵香气更为突出。因此,将进一步测定各菌株发酵米酒挥发性风味物质以分析其特点。

表5 米酒感官品评得分Table 5 Organoleptic evaluation of rice wine
2.2.4 米酒挥发性风味物质组成分析
通过GC-MS检测8种不同菌株发酵米酒中挥发性风味化合物,共检测到挥发性化合物84种,其中包含25种醇类化合物,30种酯类化合物,8种酸类化合物12种醛酮类化合物和其他类化合物9种。菌株27发酵米酒挥发性风味化合物种类最多,为60种。菌株67发酵米酒最少,为50种。菌株YSHJ、21和26发酵的米酒检出55种,菌株30、89和104发酵米酒分别检出56种、53种和54种挥发性风味化合物(数据未显示)。酯类化合物作为米酒中种类最多的挥发性化合物,主要以乙酯为主,如癸酸乙酯、乙酸乙酯、辛酸乙酯、乙酸异戊酯等。醇类化合物含量最高分别为异戊醇、苯乙醇和异丁醇。
在所有化合物中,以醇酯类化合物含量最为丰富,可占到挥发性化合物总量87.08%~91.47%(见图2)。作为对照菌株,YSHJ发酵米酒中,醇类化合物相对含量69.39%,酯类化合物占比19.64%,酸类化合物占比7.54%,醛酮酚类化合物占比3.28%。酯类化合物可促进果香和花香等香气产生[19],对米酒香气发挥积极作用,菌株26和30所得发酵酒中酯含量较高,占总挥发性风味化合物24.22%和24.96%,其酸类化合物含量也相对较高,分别为9.75%和11.30%,适量的酸可提高酒的复杂程度和协调性。菌株89、167和184所得米酒醇类化合物占比在70%以上,菌株184发酵所得米酒中醇类化合物占比为所有菌株最高,为76.52%,高浓度醇类会产生刺激性气味和苦涩味道[20]。

图2 米酒挥发性风味化合物组成Fig.2 Composition of volatile compound in rice wine
挥发性风味化合物对香气的贡献更多取决于其风味阈值和在酒中实际含量。因此,选取酯类含量较为丰富的菌株21、26、30、127和YSHJ,对其米酒中22种挥发性风味化合物作定量分析。
米酒中醇类物质除乙醇外,主要为高级醇。高级醇是在发酵过程中,通过氨基酸脱羧和脱氨基形成。高级醇在酒中可使酒体更丰满浓郁,但高级醇含量过高不仅破坏酒体协调,更易对人体造成损伤[21],一般情况下发酵啤酒中高级醇含量<100 mg·L-1,黄酒中高级醇含量为8~540 mg·L-1,葡萄酒中高级醇认为<300 mg·L-1[22]。异戊醇、异丁醇、苯乙醇和正丙醇是米酒中最主要高级醇。异戊醇、异丁醇具有明显刺激性气味和苦涩感,菌株127发酵米酒具有最高异戊醇产量(61.33 mg·L-1),菌株YSHJ发酵米酒具有最高异丁醇含量(67.99 mg·L-1)。苯乙醇可产生类似玫瑰、香甜和丁香的香气,是米酒中独特风味化合物[23],菌株YSHJ、127和26发酵米酒中苯乙醇产量较高,分别为10.24、9.04、7.68 mg·L-1,作为米酒酿造菌株可为米酒提供典型米酒香气。
酯类化合物是黄酒香气成分中含量第二高的挥发性风味物质,乙酸乙酯、乳酸乙酯、乙酸异戊酯和丁酸乙酯是米酒中含量较高的酯类化合物。其中,乙酸乙酯在各菌株中含量最高,为5.88~6.90 mg·L-1,作为米酒中主要酯类风味化合物之一,乙酸乙酯酒有积极的香气贡献。乳酸乙酯在菌株21和30发酵所得米酒中未检出,在其他菌株发酵米酒中含量为2.63~2.67 mg·L-1。乙酸异戊酯具有香蕉风味。中链脂肪酸乙酯,如丁酸乙酯、己酸乙酯和辛酸乙酯可提供令人愉悦的果香。

表6 米酒中挥发性风味化合物定量分析Table 6 Quantitative analysis of volatile compounds in rice wine
2.2.5 米酒主要挥发性化合物OAV
香气活力值(Odor activity value,OAV)用于表征化合物对样品香气的贡献程度,通过该挥发性风味化合物在样品中浓度与该化合物气味阈值比值计算[24],OAV大于1则表示该化合物对酒整体香气具有明显贡献[25]。
由表7可知,根据OAV计算结果,22种挥发性化合物中共有13种化合物OAV>1,是关键香气化合物。苯乙醇作为米酒中具有特征风味的化合物,其在4个菌株发酵米酒中香气活力均不及对照菌株YSHJ,但菌株127和菌株26所得米酒相对较高,分别为1.81和1.54。乙酸异戊酯、丁酸乙酯和癸酸异戊酯OAV>10,乙酸异戊酯具有香蕉、水果特征香气,丁酸乙酯具有白兰地、水果特征香气,癸酸异戊酯具有香蕉、青草和白兰地特征香气。这些化合物可给酒体贡献积极的果香味,但癸酸异戊酯在菌株127所得米酒中并未检出。结合感官品评结果,YSHJ和菌株127发酵米酒香气得分较低,酒精感较明显,与其异丁醇和异戊醇浓度较高有关。

表7 主要挥发性风味化合物OAV及香气描述Table 7 Odor activity value and aroma description of volatile compounds
芳樟醇和十六酸乙酯在除菌株21以外菌株所发酵米酒中均有检出,芳樟醇虽含量较低,但菌株26、30和127发酵米酒对应OAV>1,可为酒提供花香和薰衣草香气。十六酸乙酯具有果香、奶油香特征香气,OAV>4,菌株26发酵米酒十六酸乙酯OAV最高,为4.32。中、长链脂肪酸乙酯被认为是米酒中具有代表性的重要风味化合物[27]。
酸类物质是酿造酒中重要呈味物质,可赋予酒体协调的口感。但高浓度下,产生脂肪、腐臭等异味,给酒带来负面影响[28-29],例如高含量辛酸造成酒风味品质下降。菌株127发酵米酒的酸类化合物OAV普遍高于其他菌株。菌株26发酵的米酒中酸类化合物OAV较低,感官评价香气较为馥郁和谐。
对OAV值大于1的13种挥发性化合物作主成分分析。如图3所示,前两个PC描述67.55%方差,其中第一主成分PC1占方差46.22%,与癸酸异戊酯呈负相关。第二主成分PC2占方差21.33%,与十六酸乙酯、芳樟醇等呈正相关,与乙酸乙酯、正癸酸呈负相关。化合物之间主成分得分有重叠,表明其含量具有相似特征。
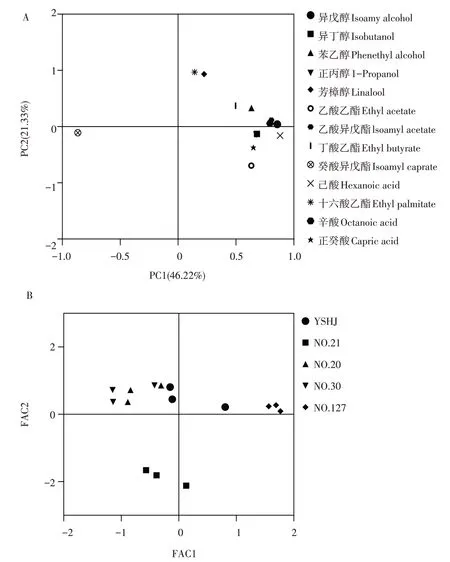
图3 米酒主成分分析Fig.3 Principal components analysis of rice wine
基于PC1和PC2计算得到每个菌株酒样样本分数,FAC1和FAC2,分别对应图B中x和y轴,该图显示5株样品在坐标系中差异,样品相距越远其差异值越大。
综合上述研究,菌株NO.26发酵速度快,挥发性风味物质组成较优,感官评价酒体协调,香气馥郁,且带有米酒米香与清香,具有纯种发酵优质米酒的潜力。
2.3 菌株鉴定
初步筛选获得优选菌株NO.26,提取菌体DNA后,采用BLAST方式将测定的18S rDNA序列与GenBank中序列作比对,生成系统发育树。所有筛选菌株与酿酒酵母(Saccharomyces cerevisiae)CBS 1 171模式菌株形成一个簇,表明筛选菌株为酿酒酵母,结果如图4所示。

图4 基于18S r DNA测序所构建酵母菌株系统发育树Fig.4 Phylogenetic tree of yeast based on 18S r DNA sequencing
3 讨论与结论
优质酵母菌株对于酿造酒发酵至关重要,对口感和风味均影响极大[30]。目前,对于米酒或黄酒酵母筛选多基于传统酿造工艺,选育具有低产尿素[31]、低产高级醇[32]、高产β-苯乙醇[33]等菌株,对于筛选适用于纯种液态米酒发酵的酵母菌株研究较少。纯种酿酒酵母分离和应用,有利于米酒酿造向现代工业化生产进一步迈进[3]。王莹钰使用6种黄酒酵母发酵液化法糜子黄酒,不同菌株之间发酵速率、乙醇产量和挥发性风味物质组成等存在显著差异[34]。邹凌波建立一种酶制剂完全替代酒曲液态米酒酿造工艺,并从酒曲和酒醪中筛选得到1株发酵能力较优酿酒酵母,但并未根据其风味特性和感官品评进一步分析筛选[12]。
本试验以米酒酒曲和实验室保藏菌株为筛选源,基于菌株产气、产硫化氢、产酒精试验,发酵性能试验和挥发性风味化合物分析,筛选获得优良酿酒酵母菌株NO.26。该菌株在糖度16%糯米糖液中,25℃发酵10 d可产生酒精度为7.19%V/V米酒,发酵速率快,产酒精能力强。使用该菌株发酵所得米酒中多种挥发性风味化合物如苯乙醇、芳樟醇、十六酸乙酯等均优于其他菌株或处于较高水平,酿造米酒具有发酵米酒典型米香和清香,口感清爽鲜甜,感官品评结果优于其他菌株。
目前,适用于米酒发酵的菌株多样性不足,严重限制米酒风格丰富性。研究对酵母菌株发酵特性提供系统的选育方法,并筛选得到具有优良酿造品质的酿酒酵母,对于未来开发纯种液态法米酒产品具有较强工业应用参考。

