妊娠相关性乳腺癌的临床、病理及影像学特征
霍敏, 胡益祺, 宋良宵, 刘少欣, 艾涛
妊娠相关性乳腺癌(pregnancy-associated breast cancer,PABC)是指在妊娠期或分娩后一年内确诊的乳腺癌。相关文献报道,PABC约占所有乳腺癌的0.2%~3.8%,且随着中国二胎政策的开放和女性生育年龄的增长,PABC发病率也呈逐渐上升趋势[1]。另外,由于妊娠哺乳期特殊的生理状况及乳腺正常的生理变化(乳房增大、密度增高和血流增加),给临床诊疗带来了诸多困难。本研究通过回顾性分析PABC的临床、病理及影像学特征,旨在提高对PABC的认识和诊断水平。
材料与方法
1.病例资料
回顾性分析2017年3月-2021年5月在华中科技大学同济医学院附属同济医院就诊的20例PABC患者的临床、病理及影像资料。在本院电子病历系统搜集并记录患者的年龄、发现临床症状到确诊时间间隔、临床症状、病理及免疫组织化学结果。在影像归档和通信系统(Picture Archiving and Communication Systems,PACS)影像工作站搜集患者的乳腺超声和MRI影像资料。
2.检查方法
乳腺超声检查采用彩色多普勒超声仪(GE VingmedUltrasoung AS Strandpromenaden 45,N-3191 Horten,Norway),浅表探头9L-D 2.7~7.8 MHz。患者取仰卧位,双手上举充分暴露乳房,由超声科医师对乳腺进行常规扫查,发现病灶后分析病灶及腋窝淋巴结的声像图特点,探查病灶的彩色多普勒超声(color doppler flow imaging,CDFI) 血流信号。
乳腺MRI检查采用Siemens SKYRA3.0T扫描仪,16通道乳腺专用相控阵线圈。患者取俯卧位,平静呼吸状态下双侧乳腺自然下垂于成像线圈中。主要的MRI扫描方案及参数:①轴面脂肪抑制T2加权自旋回波(T2WI),TR 3700 ms,TE 101 ms,翻转角137°,矩阵320×320,视野320 mm×320 mm,层厚4 mm;②多b值扩散加权成像(DWI),TR 5000 ms,TE 70 ms,翻转角180°,矩阵188×115,视野280 mm×170 mm,层厚5 mm,b值取0、50、1000、2000 s/mm2;③动态对比增强磁共振成像(dynamic contrast enhanced MRI,DCE-MRI)采用TWIST-VIBE 技术,TR 5.24 ms,TE 2.46 ms,翻转角10°,矩阵320×260,视野320 mm×260 mm,层厚1.5 mm;DCE-MRI以5.74 s/期的时间分辨率连续扫描60期,并于第三期末采用高压注射器注射钆对比剂(欧乃影,GE Healthcare),对比剂剂量为0.1 mmol/kg体重,注射流率为2.5 mL/s。对比剂注射完毕以后以20 mL生理盐水冲管,DCE-MRI总扫描时间为5分57秒。
3.图像分析
乳腺超声图像分析:由1位经验丰富的超声科医师对超声图像进行分析。记录肿块的大小、形态、边界、内部回声、腋窝淋巴结及其他转移征象等二维声像图特征,采用彩色多普勒血流显像探查病灶内部及周围的血流信号特点。
乳腺MRI图像分析:由2位经验丰富的放射科医师对MRI图像进行分析。记录乳腺腺体密度和病变的类型、大小,重点分析病灶的T2WI和DCE-MRI信号特征(形态、边界、有无瘤周水肿和瘤内坏死、背景强化、瘤内强化特征),测量病灶的时间-信号曲线(time-intensity curve,TIC)和平均表观扩散系数(apparent diffusion coefficient,ADC)值。定量测量的感兴趣区(ROI)勾画及基本要求:ROI放置于病灶最大层面且强化程度最高或扩散受限程度最高的区域,避开病灶内明显液化坏死、出血、钙化等区域。
结 果
1.一般资料及临床表现
本组患者年龄范围为25~40岁,平均年龄(32.45±3.41)岁。自发现临床症状或体征到确诊的时间间隔为1~7个月,平均(3.05±1.86)个月。本组20例患者均可触及乳房肿块,其中5例触及腋窝淋巴结肿大,1例皮肤增厚、发红,2例患者有乳腺以外病症和/或体征(1例发现左背部肿块伴左上肢疼痛,1例发现胸壁结节)。
2.病理结果
本组患者穿刺或术后病理结果显示乳腺浸润性癌19例(95%),导管原位癌1例(5%)。免疫组化结果显示Luminal 型7例(35%),HER-2过表达型3例(15%),基底样(三阴)型10例(50%),Ki-67高表达(LI>15)者18例(90%)。腋窝淋巴结转移阳性13例(65%),淋巴结转移阴性1例(5%),无腋窝淋巴结病理结果6例(30%)。临床分期结果显示Ⅱa期2例(10%),Ⅱb期7例(35%),Ⅲa期3例(15%),Ⅲb期1例(5%),Ⅲc期1例(5%),Ⅳ期2例(10%);余4例为术后患者(表1)。

表1 20例PABC患者的病理及免疫组化结果
3.影像学表现
超声表现:20例患者就诊后均行常规乳腺超声检查(表2),双侧乳腺腺体表现为回声不均,呈“哺乳期”样改变。病灶多呈形态不规则、边界欠清的低回声,伴或不伴钙化(图1)。彩色多普勒血流显像多可见血流信号(图2)。根据乳腺ACR BI-RADS分类第五版诊断标准,乳腺超声诊断结果为:3例(15%)为BI-RADS4类,13例(65%)为BI-RADS5类,4例(20%)为BI-RADS 6类。

表2 20例PABC患者的超声表现
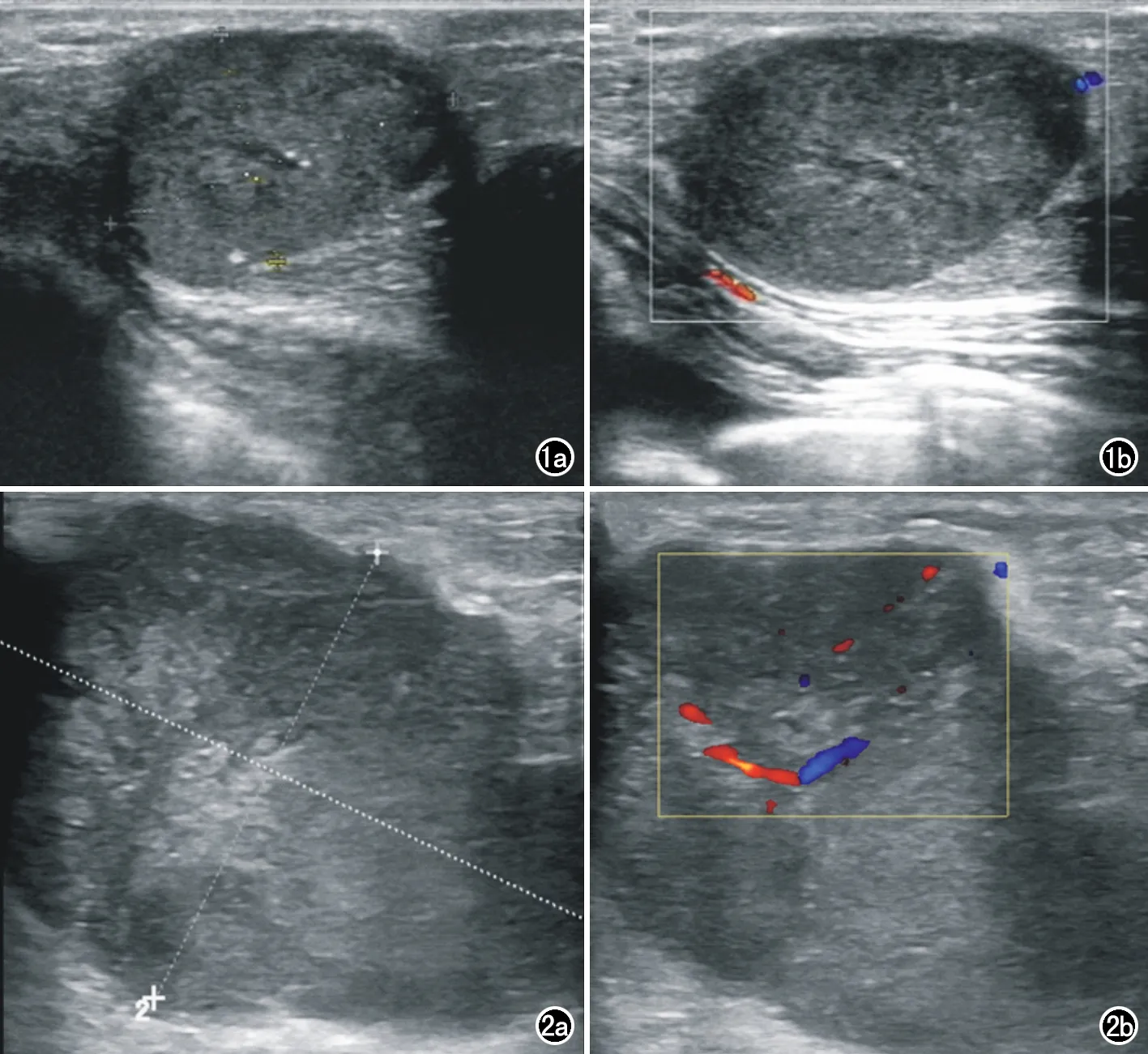
图1 PABC患者,女,25岁,哺乳期发现肿物1月余,BI-RADS评估为4类。右乳包块空心针活检病理结果为乳腺浸润性导管癌。a) 二维超声检查示右侧乳腺实质性包块,大小约25mm×16mm,形态规则,边界尚清,内可见多个强回声斑; b) CDFI示病灶内无明显血流信号。 图2 PABC患者,女,32岁,妊娠中期自检发现右乳包块3月余,BI-RADS评估为5类。右乳包块空心针活检病理结果为乳腺浸润性癌。a) 二维超声检查示右侧乳腺低回声包块,大小约54mm×38mm,形态不规则,边界欠清; b) CDFI示病灶内可见血流信号。
MRI表现:本组病例中,16例(80%)患者获取到术前乳腺MRI资料(6例行MRI平扫+DWI检查,10例行MRI平扫+DWI+DCE-MRI检查),余4例(20%)患者为术后乳腺MRI资料。病灶以肿块型为主,在T2WI上多呈混杂长T2信号,DWI(b=1000 s/mm2)序列上呈混杂高/高信号,平均ADC值约(0.719±0.121)×10-3mm2/s(图3、4)。乳腺MRI的详细影像学特征见表3。根据乳腺ACR BI-RADS分类第五版诊断标准,乳腺MRI诊断结果为:1例(5%)为BI-RADS 4类,15例(75%)为BI-RADS 5类,4例(20%)为BI-RADS 6类。

表3 20例PABC患者的MRI表现

图3 PABC患者,女,38岁,哺乳期发现右乳肿块3月余,BI-RADS评估为5类。术后病理结果为乳腺浸润性癌。a) T2WI示右侧乳腺上部不规则肿块(箭),病灶呈混杂长T2信号,其内可见片状长T2信号,伴瘤周水肿; b) DWI(b=1000s/mm2)示病灶呈不均匀高信号(箭); c) ADC图,病变区(箭)ADC值为0.650×10-3mm2/s; d) 未注射对比剂图像; e) 注射对比剂90s后图像,病灶呈肿块样强化(箭); f) TIC曲线为Ⅲ型。
讨 论
妊娠相关性乳腺癌包括妊娠期和哺乳期发生的乳腺癌,又被称为妊娠哺乳期乳腺癌[2]。由于妊娠哺乳期乳房的特殊生理学改变,使得早期诊断非常困难,不易被发现,因此多数患者就诊时已属于中晚期。另外,诊疗过程需要兼顾母亲的疗效与胎儿(或哺乳期婴儿)的安全,这就使得对PABC的诊治更为复杂。本研究通过详实的病例数据,系统性分析了PABC的临床、病理及影像学特征,结果也表明影像学检查(乳腺超声和MRI)在PABC诊断及评估上具有较高的准确性,在PABC的筛查及早期诊断中具有潜在的推广应用价值。

图4 PABC患者,女,31岁,哺乳期发现乳腺肿块3月余,BI-RADS评估为5类。术后病理结果为乳腺高级别导管原位癌。a) T2WI示右侧乳腺明显增大,其内见团片状混杂稍长T2信号,边界不清,伴广泛皮肤增厚、水肿(箭); b) DWI(b=1000s/mm2)示病灶呈不规则片状高信号(箭); c) ADC图,病变区(箭)ADC值为0.796×10-3mm2/s; d) 未注射对比剂图像; e) 注射对比剂90s后图像,病灶呈非肿块样强化(箭); f) TIC曲线为Ⅲ型。
Ventura[3]认为 PABC的发病率随着女性延迟分娩而有所上升。本组病例中,患者平均年龄为(32.45±3.41)岁,为PABC的高发年龄阶段。另外,妊娠期由于雌孕激素及催乳素水平的明显升高,促进乳腺腺体增生及导管扩张,导致乳腺癌的局部症状和体征常被忽视或漏诊,从而导致诊断延迟。通常PABC自发现临床症状或体征到病理确诊的时间间隔约为5~15个月[4];而PABC诊断延迟1、3、6个月时,腋窝转移的风险评估分别增加了1.8%、5.2%和10.2%[5]。因此,早期确诊对于乳腺癌患者的临床诊疗决策与预后具有重要意义。本组病例中,患者自发现临床症状或体征到病理确诊的时间间隔为(3.05±1.86)个月,时间短于上述研究数据;其原因可能与本组病例中病灶多表现为肿块型(87.5%)且病灶较大[乳腺MRI检查,肿瘤最大径为(49.5±22.8)mm]有关。由此,建议妊娠哺乳期女性从妊娠早期一直到哺乳期结束都应将乳腺癌的筛查纳入常规检查项目,以提高PABC的早期检出率。
临床实践中,乳腺疾病的影像学检查方法主要包括乳腺X线、超声、MRI检查。乳腺X线检查是乳腺癌筛查的首选影像学方法,但因其电离辐射性,女性对于孕期前后行乳腺X线检查的接受度较低,本组病例中所有患者均未行乳腺X线检查。有研究表明,乳腺X线检查过程中,在腹部防护良好的条件下,胎儿所受到的辐射可低至0.004 Gy,远低于胎儿致畸的暴露阈值(0.1 Gy)[1,6]。因此,妊娠及哺乳期行乳腺X线检查是安全可行的,但需要考虑腺体密度对诊断敏感性的影响。乳腺超声检查具有简单、无创、无电离辐射损伤等优点,常作为临床怀疑PABC的首选检查方法。本研究中,PABC的超声影像学特征主要表现为形态不规则、边界欠清实质性肿块,多为低回声伴/不伴强回声光斑,CDFI可见血流信号,与非妊娠期乳腺癌的超声表现大致相同。而且,与Ahn等[7]的研究相似,本研究乳腺超声检查检测出了所有病灶(敏感度为100%)。但也有研究表明,单纯乳腺超声检查有可能将乳腺癌误诊为乳腺炎(尤其是非肿块样病变),从而导致病情延误而错失最佳诊疗时机[8]。
MRI检查因其良好的软组织分辨率及无电离辐射等优势,已广泛应用于乳腺疾病的诊断及疗效评估;但由于妊娠与哺乳期乳腺腺体明显增生,乳腺毛细血管增多,乳腺密度增高,而乳腺癌组织多表现为等-稍长T2信号强度,边界不清,因此乳腺MRI平扫对PABC的诊断价值不高。DWI可定量测量活体组织间隙分子的受限程度,直观反映组织的细胞密度及微环境的变化,提高乳腺疾病诊断的特异性,高b值DWI(b值=800或1000 s/mm2)能很好地抑制增生的乳腺背景信号,提高病灶与正常组织之间的对比度,有助于病灶的检出和定性诊断。本研究中,PABC的平均ADC值为(0.719±0.121)×10-3mm2/s,明显低于正常的背景组织信号,且与相关文献报道的非妊娠相关性乳腺癌患者的ADC值(0.87~1.36)×10-3mm2/s相近[9]。DCE-MRI是通过注射钆对比剂之后的快速动态扫描,获取对比剂在血管外-组织间隙内分布的动态信息,从而量化评估病灶内的血流灌注等病理生理学特征,用于病灶的诊断与疗效评估。相关研究表明,PABC与非PABC相比,强化程度更明显,强化时间更早,信号更复杂[10]。动态增强乳腺MRI的钆对比剂可穿过血-胎盘屏障,具有潜在致畸作用,因此不推荐动态增强MRI用于妊娠期女性。另外,妊娠期女性体重增加、腹围增大,容易受电磁热效应和体位受限(俯卧位)等因素影响,增加检查难度;同时电离磁场对胎儿生长发育的影像尚不明确,因此不建议妊娠前3个月行MRI检查。
本组有1例患者以乳腺脓肿就诊,术后病理结果为乳腺浸润性癌。为了避免PABC的误诊,需要进行鉴别诊断的常见病变有乳腺纤维瘤、积乳囊肿、乳腺炎、乳腺脓肿及乳腺增生。尤其是乳腺炎合并乳腺脓肿的患者,其常具有发热、局部红肿等典型的临床症状;脓肿在增强MRI上常表现为多发大小不等的环形强化,可融合呈花环状,脓液在高b值DWI上呈高信号伴明显的扩散受限;脓肿周围的炎性病变多表现为边界欠清的片状轻-中度强化区域,TIC呈Ⅰ或Ⅱ型。
PABC的确诊主要依靠病理学检查。局麻下空心针穿刺活检术为主要的细胞学检查方法,穿刺活检组织应常规行ER、PR、Her-2、Ki-67等免疫组化检查。相关研究表明,PABC的组织病理学及免疫组化结果与35岁以下年轻女性乳腺癌类似,最常见的病理类型为ER、PR阴性的浸润性乳腺癌[4,11,12]。本组病例中,乳腺浸润性癌占95%,基底样(三阴)型占50%,与既往研究结果一致。另外,Ki-67高表达患者比例高,说明PABC肿瘤细胞增殖活跃,恶性程度高。此外,PABC患者发生腋窝淋巴结转移的比例较高(本组病例为65%),主要原因可能是由于分娩后乳房复苏过程中血管生成,炎性因子及细胞外基质改变被激活,这些变化有利于肿瘤的扩散与生长,从而加速了腋窝淋巴结转移的发生[13-14]。
综上所述,PABC因为妊娠和乳腺癌同时发生,相互作用而使其诊疗有了一定的特殊性。临床上要进一步加深对妊娠哺乳期发生PABC可能性的认识,合理选择影像学方法对PABC进行筛查和早期诊断,这对改善PABC的诊疗决策及预后具有重要意义。

