基于Wnt通路下调微小RNA-130a对颅脑损伤模型大鼠神经功能的修复作用▲
郑细良 祁占宁 张 亮 方治军 孙智宏
(1 北京市大兴区人民医院神经外科,北京市 100026,电子邮箱:zfpvtr@163.com;2 延安大学咸阳医院神经外科,陕西省延安市 712000)
随着生活节奏的加快,交通事故频繁发生,使得颅脑损伤发生率呈上升趋势,颅脑损伤易导致神经功能缺失,从而影响患者的认知功能,甚至对患者的生命健康产生威胁,严重影响患者生活质量。因此,治疗颅脑损伤时进行神经功能修复尤为重要[1]。Wnt信号通路是在各种生物体中广泛存在的一种保守信号通路,参与调控细胞增殖、分化、迁移以及凋亡等多种过程[2]。颅脑损伤后,损伤部位释放大量的自由基及炎症因子,使得脑细胞进一步坏死,加重病情[3]。微小RNA(microRNA,miRNA)-130a在颅脑损伤部位高度表达,参与氧化应激及炎症反应损伤的过程[4]。本研究探讨基于Wnt通路下调miRNA-130a的表达对颅脑损伤模型大鼠神经功能的修复作用。
1 材料与方法
1.1 实验动物 30只SD健康雄性大鼠,购自上海斯莱克公司,许可证号:SYXK(冀)2020-009,月龄7~10 (8.5±0.8)个月,体重220~232 (226.8±3.9)g。在湿度为50%~55%、温度为(24.1±2.1)℃、充足光照(光照12 h/d)的环境下适应性喂养大鼠1周。本研究经我院伦理委员会批准。
1.2 主要试剂 单唾液酸四己糖神经节甘酯钠注射液(齐鲁制药有限公司,国药准字:H20046213);Wnt3a mRNA、β-联蛋白(β-catenin)mRNA提取试剂盒购自大连Takara生物工程有限公司;miRNA-130a试剂盒由武汉华美生物工程公司提供;兔抗小鼠单抗细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)抗体(艾美捷科技有限公司,批号:A-AO1014a);小鼠抗小鼠白细胞介素(interleukin,IL)-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α抗体(上海臻科生物科技有限公司,批号:48T96T、AB24781);小鼠抗小鼠超氧化物歧化酶(superoxide dismutase,SOD) 、丙二醛、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)抗体(武汉博士德生物工程有限公司,批号:AB24156、AB15874、AB57841、AB26348)。
1.3 方法
1.3.1 分组与建模:大鼠适应性饲养1周后,将大鼠按照随机数字表法分为正常组(10只)和干预组(20只),正常组不做处理,采用Feeney自由落体硬膜外撞击法[5]对干预组大鼠建立颅脑损伤模型。建模方法为,给予大鼠腹腔注射2%戊巴比妥钠(0.2 mL/100 g)麻醉后,将大鼠头部固定,剪去头颈皮毛,消毒皮肤,沿中线右侧将头皮切开,分离骨膜至颅骨,暴露硬脑膜,再以直径为4.5 mm、重量为25 g的砝码,造成30 cm高空坠落的打击力,使大鼠出现颅脑损伤。建模后大鼠表现出瞳孔缩小、肢体抽搐等症状,即表示建模成功。本实验共有19只大鼠建模成功,将建模成功的大鼠按照随机数字表法分为模型组(9只)和下调miRNA-130a组(10只)。给予下调miRNA-130a组大鼠经尾静脉注射单唾液酸四己糖神经节甘酯钠注射液30 mg/kg,1次/d,共3天,以进行基于Wnt通路下调miRNA-130a的干预[6],正常组、模型组大鼠每日给予腹腔注射同等剂量的生理盐水。3组大鼠均连续注射7 d。
1.3.2 标本采集:所有大鼠连续干预1周后取心脏血液3 mL,2 000 r/min离心20 min,分离上清液,置于-80℃冰箱保存。腹主动脉采血5 mL后麻醉并断头处死大鼠,分离脑组织,取右侧海马组织于液氮中快速冷冻,置于-80℃冰箱保存。
1.3.3 苏木精-伊红染色:取大鼠左侧海马区脑组织,4%甲醛固定24 h后行常规石蜡包埋及连续切片,将切片烤干后进行脱蜡处理,之后依次置入不同浓度(95%、80%、70%)的酒精中,3 min/次。使用苏木精染色15 min后清洗3次,30 s/次,使用盐酸酒精分化处理30 s,充分清洗之后使用1%伊红染色,使用酒精脱水处理后进行脱蜡处理,封片后在显微镜下观察苏木精-伊红(hematoxylin-eosin,HE)染色结果。
1.3.4 miRNA-130a、Wnt3a mRNA、β-catenin mRNA相对表达水平的测定:采用实时荧光定量PCR技术法检测miRNA-130a,以及Wnt3a mRNA、β-catenin mRNA的相对表达水平。首先提取海马细胞总RNA,检测其RNA纯度及浓度后,进行反转录处理,获得cDNA,以甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,行PCR扩增,采用Primer Premier 6.0软件设计引物序列,由Invitrogen公司合成引物。引物序列见表1。反应条件为96℃ 6 min;94℃ 15 s、65℃ 45 s,60个循环。以2-△△Ct方法计算miRNA-130a、Wnt3a mRNA、β-catenin mRNA相对表达水平,实验重复3次,取平均值。

表1 引物序列
1.3.5 大鼠血清中的SOD、丙二醛、IL-6、TNF-α、神经生长因子、BDNF、NSE、MCP-1水平的检测:(1)采用分光光度法检测SOD水平,采用硫代巴比妥酸荧光法测定丙二醛水平。(2)采用酶联免疫吸附测定法检测IL-6、TNF-α及神经生长因子(nerve growth factor,NGF)、BDNF、NSE、MCP-1水平。
1.4 统计学分析 采用SPSS 19.0软件进行统计分析。计量资料以(x±s)表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3组大鼠海马区脑组织HE染色结果 正常组海马区脑细胞排列整齐密集,且细胞大小、形态正常,胞核完整;模型组大鼠海马区脑细胞间隙较宽,细胞肿胀,且神经元萎缩及肿胀,出现核固缩;与模型组比较,下调miRNA-130a组大鼠海马区脑组织的病理改变明显减轻。见图1。

正常组 模型组 下调miRNA-130a组
2.2 3组大鼠海马组织Wnt3a mRNA、β-catenin mRNA及miRNA-130a相对表达水平的比较 与正常组相比,模型组、下调miRNA-130a组Wnt3a mRNA、β-catenin mRNA相对表达水平均升高(P<0.05);与模型组相比,下调miRNA-130a组Wnt3a mRNA、β-catenin mRNA及miRNA-130a相对表达水平均降低(P<0.05)。见表2。
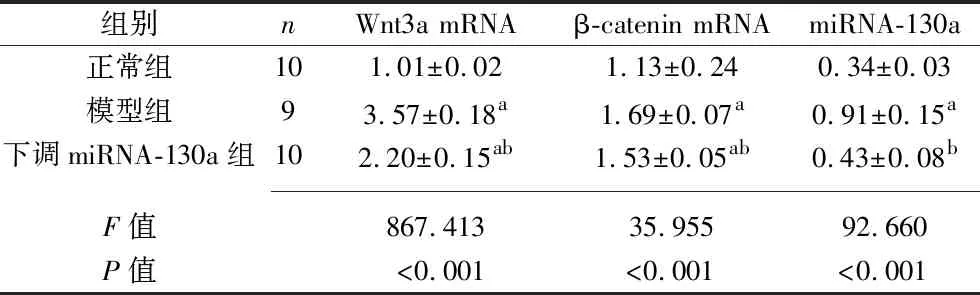
表2 3组大鼠海马组织Wnt3a mRNA、β-catenin mRNA及miRNA-130a相对表达水平的比较(x±s)
2.3 3组大鼠血清SOD、丙二醛水平的比较 与正常组相比,模型组、下调miRNA-130a组的SOD水平降低,丙二醛水平升高(P<0.05);与模型组相比,下调miRNA-130a组的SOD水平升高,丙二醛水平降低(P<0.05)。见表3。
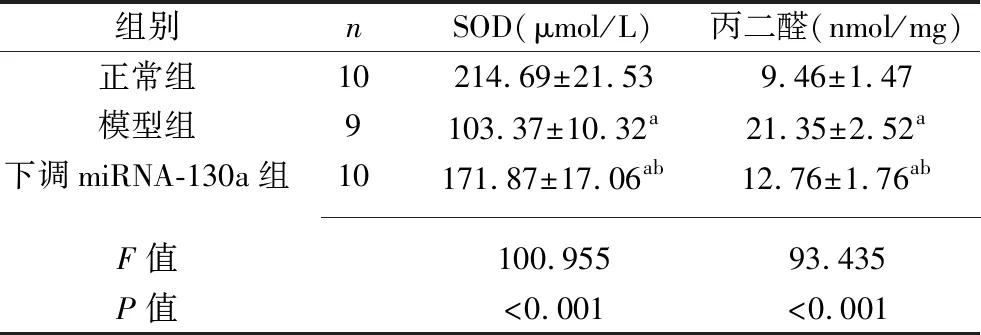
表3 3组大鼠血清SOD、丙二醛水平的比较(x±s)
2.4 3组大鼠血清IL-6、TNF-α及MCP-1水平的比较 与正常组相比,模型组、下调miRNA-130a组的IL-6、TNF-α及MCP-1水平均升高(P<0.05);与模型组相比,下调miRNA-130a组的IL-6、TNF-α、MCP-1水平降低(P<0.05)。见表4。

表4 3组大鼠血清IL-6、TNF-α及MCP-1水平的比较(x±s)
2.5 3组大鼠血清NSE、BDNF及NGF 水平的比较 与正常组相比,模型组、下调miRNA-130a组的NSE水平升高、BDNF及NGF 水平降低(P<0.05);与模型组相比,下调miRNA-130a组NSE水平降低,BDNF、NGF水平升高(P<0.05)。见表5。

表5 3组大鼠血清NSE、BDNF及NGF 水平的比较(x±s)
3 讨 论
颅脑损伤作为临床上较为常见的一种创伤,常表现为意识障碍、头痛以及呕吐等,给患者的生活带来严重的影响[5]。研究显示,颅脑损伤常导致脑组织缺血缺氧、炎症反应以及神经细胞凋亡等,使得病情进一步发展,引发脑缺血及脑梗死,严重者可导致死亡[6]。多数颅脑损伤患者可出现神经功能障碍,尤其是由钝器或锐器外力所致的颅脑损伤患者,常留有不同程度的神经功能障碍[7]。探寻有效治疗颅脑损伤所致神经功能障碍的方法是临床研究的热点[8]。
Wnt信号通路是神经干细胞增殖分化过程中较为关键的调控通路[9]。正常情况下,Wnt/β-catenin通路表达水平较低,但发生颅脑损伤时该通路将会被激活。其中Wnt3a为Wnt/β-catenin通路的起始蛋白,其表达升高将会激活Wnt信号通路[10]。β-catenin为Wnt/β-catenin通路中的信号转导因子,正常组织细胞中β-catenin以磷酸化的降解复合物形式存在,且含量较低。miRNA在真核细胞中广泛存在,参与各种生理、病理过程[11]。miRNA-130a为miRNA-130具有代表性的因子,研究发现在宫颈癌、肺癌等多种恶性肿瘤中miRNA-130a均呈高表达,其通过细胞内多个信号通路参与肿瘤细胞的增殖及侵袭过程[12]。研究显示,在颅脑损伤中,下调miRNA-130a相对表达水平,可有效减轻炎症反应及氧化应激,提示下调miRNA-130a的表达可能对颅脑损伤具有保护作用[14]。本研究结果显示,下调miRNA-130a组海马区脑组织病理改变较模型组减轻,且与模型组相比,下调miRNA-130a组的Wnt3a mRNA、β-catenin mRNA及miRNA-130a相对表达水平均降低(P<0.05),说明通过Wnt通路下调miRNA-130a能够减轻颅脑损伤模型大鼠的脑组织损伤。
颅脑损伤时氧自由基大量释放,脑组织中的SOD水平下降,丙二醛水平升高[14]。研究显示,在颅脑受到损伤后,氧化应激将会加重脑损伤过程,导致大量氧自由基的产生,进而促进蛋白质氧化、脂质过氧化等,引发脑水肿、颅内压升高的发生[15]。SOD、丙二醛水平或活性高低与氧自由基导致的脑损伤具有密切联系[16]。例如,血清中SOD水平降低会导致脑细胞破坏程度增加,对氧自由基的灭活作用减弱,加剧病情进展;丙二醛水平上升会加剧氧自由基的攻击损害[17]。本研究结果显示,与模型组相比,下调miRNA-130a组的SOD水平升高,丙二醛水平降低(P<0.05),说明通过Wnt通路下调miRNA-130a的表达水平能够减轻颅脑损伤大鼠的氧化应激水平。
在颅脑损伤患者脑内神经元受损、变性及凋亡的过程中,均有炎症反应的参与,且炎症反应为多种创伤后共有的病理过程。炎症反应能改变颅脑损伤患者血-脑屏障的通透性,使脑血流紊乱,进而加重患者的缺氧、缺血,使脑组织受损程度增加[18]。IL-6为促炎因子,当其水平显著上升时,血管内皮细胞通透性增大,加重继发性脑损伤[19]。TNF-α是活化巨噬细胞的小分子,当其水平过度升高可促进其他炎症因子释放,同时会加剧组织细胞损伤。MCP-1是一种单核细胞特异性趋化因子,在炎症反应中发挥重要作用。本研究结果显示,与模型组相比,下调miRNA-130a组的IL-6、TNF-α、MCP-1水平降低(P<0.05),提示通过Wnt通路下调miRNA-130a表达水平能够降低颅脑损伤大鼠炎症反应水平。
颅脑损伤常伴有神经损伤,导致患者出现神经功能障碍,影响其生活质量[20]。血清中NSE能反映神经损伤程度,当神经系统受到损伤后,其水平将会显著升高。BDNF与NGF均能够促进神经功能重建。BDNF为神经营养因子家族成员,由脑组织合成,主要分布在脑皮质、纹状体区以及海马区,在神经细胞轴突生长,神经元存活,促进神经康复,抵抗神经细胞凋亡及增加突触可塑性中发挥重要作用[21]。NGF具有促进神经突起生长的生物效应,参与神经系统的发育、分化以及损伤修复等过程[22]。本研究结果显示,与模型组相比,下调miRNA-130a组的NSE水平降低,BDNF、NGF水平升高(P<0.05),说明通过Wnt通路下调miRNA-130a表达水平能够减轻颅脑损伤模型大鼠的神经损伤程度,促进神经功能修复。
综上所述,基于Wnt通路下调miRNA-130a表达水平对颅脑损伤大鼠进行干预,能够降低炎症反应和氧化应激水平,减轻脑组织损伤,促进神经功能修复。

