旋毛虫p53重组蛋白对血管内皮细胞通透性影响的研究
刁子洋,郭 琨,王姗姗,王雪莹,侯嘉茗,薄禄琪,王 爽,宋铭忻
(东北农业大学动物源性人兽共患病黑龙江省重点实验室,黑龙江 哈尔滨 150030)
旋毛虫病(Trichinosis)是由旋毛虫(Trichinella spi⁃ralis)感染引起的一种重要的呈世界性分布的人畜共患线虫病,对人类健康和畜牧业危害严重,也是一种重要的食源性人兽共患寄生虫病[1]。解剖发现,旋毛虫感染在空肠引起黏膜充血、水肿、灶性出血的症状。并且在急性发作时,多有眼睑与面部水肿,严重者下肢水肿[2]。水肿产生的原因之一是血管内皮细胞通透性的增加。
旋毛虫排泄分泌抗原(ES 抗原)是由杆状体分泌的一种复杂抗原成分,不同生长阶段虫种分泌的ES抗原成分不同。其中,肌幼虫分泌的ES 抗原中,43 ku、45 ku 和53 ku 抗原占全部ES 抗原含量的一半以上[3],说明p53 糖蛋白抗原是ES 抗原的主要成分。研究表明,旋毛虫ES抗原中49 ku、43 ku、53 ku混合蛋白中含有TLR4 的配体成分[4],推测混合蛋白作用原理与同样含有TLR4 配体的细菌脂多糖(LPS)相似。研究表明,LPS可作用于血管造成血管损伤[5],推测这些蛋白中有造成血管损伤的成分。
内皮细胞屏障是维持血管通透性的重要因素[6]。血管内皮细胞间的黏附连接和血管内皮细胞结构完整是构成血管内皮屏障的两个因素[7]。血管内皮细胞通透性升高是由内皮细胞连接蛋白表达异常和血管内皮细胞发生损伤导致[8]。推测线粒体凋亡通路可能导致血管内皮细胞发生凋亡,引起血管通透性增加。内皮细胞连接蛋白包括ZO-1、VE-cadherin等,通过检测这两种连接蛋白,可以观察细胞间连接的变化。
本研究以人脐静脉内皮细胞(HUVES)作为细胞模型,通过旋毛虫p53 重组蛋白(Ts-p53)体外刺激HUVES,检测内皮细胞通透性,分析线粒体细胞凋亡通路中相关凋亡蛋白与抗凋亡蛋白及紧密连接蛋白和粘附连接蛋白含量的变化,研究旋毛虫致宿主出现水肿的机制,解析旋毛虫感染与宿主血管通透性之间的关系,这对研究旋毛虫感染的发病机制有重要意义。
1 材料与方法
1.1 虫种、细胞系及蛋白旋毛虫分离自黑龙江逊克猪,由本教研室保存;HUVES 细胞由内蒙古大学生命科学学院生化与分子生物学教研室惠赠;Tsp53 重组蛋白由本实验室表达并保存。
1.2 主要试剂LPS 购自北京博奥拓达科技有限公司;CCK-8 细胞活性检测试剂盒和FITC-BSA 购自大连美仑生物公司;6 孔Transwell 小室购自杭州沃森生物技术有限公司;SYBR Premix ExTaqⅡ购自宝生物工程(大连)有限公司;兔抗GAPDH、兔抗Bax、兔抗Bcl-2、兔抗间连蛋白Cytochrome C、兔抗Pro-Caspase-9、兔抗cl-Caspase-9、兔抗Pro-Caspase-3、兔抗cl-Caspase-3、兔抗VE-cadherin 和Zo-1 多抗及山羊抗兔IgG-HRP 均购自中国Abmart 公司。
1.3 细胞培养及分组HUVES 用含10%胎牛血清的DMEM 培养基培养,每2 d~3 d 传代一次。实验分为3 组:(1)空白对照组:正常培养细胞18 h;(2)实验组:HUVES细胞与Ts-p53蛋白共培养,分别培养3 h、6 h、12 h 和18 h;(3)阳性对照组:HUVES 细胞与1 μg/mL 的LPS 共培养18 h。
1.4 Ts-p53 刺激HUVES 细胞的浓度优化将对数生长期的HUVES 细胞铺于96 孔板中,每孔1×105个细胞,每5个孔为一组。待细胞长满单层后,分别加入10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL、60 μg/mL、70 μg/mL 的Ts-p53 培养12 h,阳性对照组为用LPS 刺激的细胞,空白对照组为不做处理的空白组细胞。12 h 后弃上清,重新加入培养基,并按每孔培养基总体积的10%加入CCK-8 溶液,孵育4 h,经酶标仪检测OD450nm值,按CCK-8 试剂盒说明书计算细胞的存活率,以上试验重复3 次。
1.5 Ts-p53 对内皮细胞通透性的影响将处于对数生长期的HUVES 铺于Transwell 上层小室,待细胞铺满上层后,换成含2%胎牛血清的DMEM 培养液培养2 h。以1.4 确定的最适浓度Ts-p53 按照1.3 的分组处理细胞。在上层中加入FITC-BSA,下层加入含10%胎牛血清的培养基,继续培养1 h 后,分别吸取每孔上下层培养液各100 μL,测定各组OD520nm值。单层内皮细胞的通透系数(Pa 值)=各组OD520nm值/阳性对照组OD520nm值。以上试验重复3 次。
1.6 Ts-p53 刺激HUVES 对Bax、Bcl-2 转录 及表达水平影响的检测根据GenBank 中登录的相关基因序列设计引物,Bax 和Bcl-2 引物序列如表1。利用1.4 最适浓度Ts-p53 刺激HUVES 并按照1.3 分组,于刺激后不同时间(3 h、6 h、12 h、18 h)收获各组细胞,提取各组细胞的总RNA,反转录为cDNA 作为模板,利用qPCR 检测Ts-p53 刺激HUVEC 对其线粒体凋亡通路中Bax 和Bcl-2 的影响。另外,按照1.4 的方法培养HUVEC,利用RIPA蛋白裂解液提取不同时间(3 h、6 h、12 h、18 h)各组细胞可溶性粗蛋白,再经BCA 蛋白定量试剂盒测定各组蛋白浓度,并调整浓度统一后制备成蛋白样品,分别以兔抗Bax 和兔抗Bcl-2(1∶500)为一抗,羊抗兔IgG-HRP(1∶4 000)为二抗,采用ECL 发光液显影后,通过western blot 检测Ts-p53 刺激HUVEC 对其线粒体凋亡通路中Bax 和Bcl-2 的影响。

表1 荧光定量PCR引物序列Table 1 The primer sequences of qPCR
1.7 Ts-p53 刺激HUVES 对凋亡通路中相关蛋白表达水平的影响 为了检测Ts-p53 刺激HUVEC 对线粒体凋亡通路中细胞凋亡关键因子Cytochrome C、Pro-Caspase-9、cl-Caspase-9、Pro-Caspase-3、cl-Caspase-3 蛋白表达量的影响,按照1.3 的方法分组及利用1.6 中所述western blot 方法进行检测。
1.8 Ts-p53 刺激HUVES 对ZO-1 及VE-cadherin转录及表达水平影响的检测为了检测Ts-p53 刺激HUVEC 对内皮细胞间连接蛋白ZO-1 及VE-cadherin转录水平及蛋白表达的影响,按照1.3 的分组及利用1.6 中所述qPCR 方法和western blot 方法检测。
1.9 统计学分析利用SPSS 20.0 软件对数据统计分析,Graphpad Prism 7.0 软件对数据作图,所有数值以平均数±标准差(±s)表示,组间比较采用单因素方差分析(one-way ANOVA)法,P<0.05 表示差异显著,P<0.01表示差异极显著;采用2-ΔΔCt方法分析结果,计算各基因转录水平的相对变化;利用Image-J 软件对western blot 结果经进行灰度值分析,目的蛋白的相对含量=目的蛋白灰度值/内参GAPDH灰度值。
2 结 果
2.1 Ts-p53 刺激HUVES 细胞的浓度优化结果将HUVES 与不同浓度的Ts-p53 共培养12 h,采用CCK-8 方法检测每组细胞的存活率。结果显示,与空白 对 照 组 相 比,当Ts-p53 浓 度 为0~20 μg/mL 时,HUVES的存活率均较高,差异不显著(P>0.05);当Tsp53浓度大于30 μg/mL 时,HUVES 的存活率呈浓度依赖性显著降低(P<0.01);当Ts-p53 浓度为60 μg/mL时,HUVES存活率约为60%。阳性对照组中HUVES的存活率约为50%,存活率显著降低(P<0.01)(图1)。综上,本实验选用浓度为60 μg/mL Ts-p53用于后续试验。

图1 Ts-p53刺激HUVES细胞浓度优化的结果Fig.1 Optimization of HUVES cell concentration stimulated by Ts-p53
2.2 Ts-p53对内皮细胞通透性影响的检测结果利用60 μg/mL Ts-p53刺激HUVES 3 h、6 h、12 h、18 h后,分别测定Transwell 小室上下层培养液的OD520nm值。随着刺激时间的延长,Pa 值呈上升趋势。与空白对照组相比,在Ts-p53 刺激HUVES 3 h 和6 h 时,Pa值增大,差异极显著(P<0.01);在刺激12 h 时,Pa值最高,为空白对照组的1.6倍(P<0.01);在刺激18 h时,Pa 值开始下降(P<0.01)。阳性对照组LPS 刺激HUVES 12 h时,Pa值约为空白对照组的1.9倍(图2)。结果表明Ts-p53 可以诱导HUVES 的通透性增加导致内皮屏障功能改变。

图2 Ts-p53对HUVES通透性影响的检测结果Fig.2 Effect of Ts-p53 protein on permeability of HUVES
2.3 Ts-p53 对Bax、Bcl-2 转录及表达水平的影响的检测结果通过qPCR 和western blot 方法检测Tsp53 刺激HUVES 对Bax、Bcl-2 转录及表达的影响。qPCR 结果显示,与空白对照组相比,刺激3 h、6 h时,Bax的转录水平呈时间依赖性增加,直到刺激12 h时达到峰值,刺激18 h时转录水平开始下降,且各组Bax转录水平均低于阳性对照组,差异极显著(P<0.01)(图3A)。与空白对照组相比,Bcl-2 的转录水平呈时间依赖性降低,在刺激3 h、6 h 时,转录水平持续下降,在刺激12 h 时转录水平最低,刺激18 h时转录水平升高,且阳性对照LPS组Bcl-2的转录水平极显著低于其他组(P<0.01)(图3B)。与空白对照组相比,Bax/Bcl-2 的比值在刺激3 h、6 h 和12 h 时呈时间依赖性下降,刺激12 h 时比值最低,刺激18 h 时上升,阳性对照组的该比值最高(P<0.01)(图3C)。Western blot 结果显示,与空白对照组相比,刺激3 h、6 h 时,Bax 蛋白表达量极显著增加(P<0.01),直到12 h 达到峰值,表达量约为空白对照组的2.4倍,在刺激18 h时表达量减少,阳性对照组的表达量则极显著高于空白对照组和实验组(P<0.01)(图3E)。Bcl-2的蛋白表达量呈下降趋势,在刺激3 h、6 h、12 h 时表达量逐渐降低,刺激12 h 时表达量最低,刺激18 h时表达量增加,阳性对照组Bcl-2 的表达量极显著低于空白对照组和实验组(P<0.01)(图3F)。综上表明,Ts-p53 蛋白刺激HUVES 后可激活该细胞线粒体中凋亡相关基因Bax和Bcl-2的转录和表达。
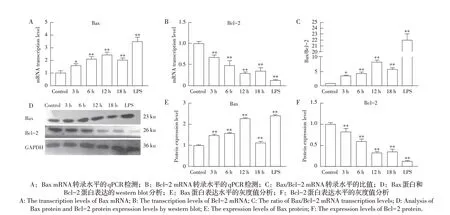
图3 Ts-p53对Bax和Bcl-2的转录及蛋白表达水平的影响Fig.3 Effect of Ts-p53 on transcription and protein expression of Bax and Bcl-2
2.4 Ts-p53 对凋亡通路凋亡相关蛋白表达水平的影响的检测结果利用western blot 方法检测Ts-p53刺 激HUVES 对Cytochrome C、Pro-Caspase-9、cl-Caspase-9、Pro-Caspase-3 及cl-Caspase-3 蛋白表达水平的影响。与空白对照组相比,Cytochrome C 表达量从刺激3 h 起开始增多,直到刺激12 h 时达到峰值(P<0.01),且约为空白对照组的2.2 倍,在刺激18 h时表达量下降,阳性对照组Cytochrome C 表达量极显著高于空白对照组和实验组(P<0.01)(图4B)。与空白对照组相比,Pro-Caspase-9的表达量在刺激3 h、6 h和12 h 均极显著降低(P<0.01),在12 h 时达到峰值,18 h 时表达量增加,阳性对照组Pro-Caspase-9表达量极显著高于空白对照组和实验组(P<0.01)。而cl-Caspase-9 的表达量则与之相反,在3 h、6 h 和12 h 表达量逐渐增加(P<0.01),12 h表达量达到空白对照组的1.8 倍,在18 h 表达量下降,阳性对照组cl-Caspase-9 表达量极显著高于空白对照组和实验组(P<0.01)(图4D)。与空白对照组相比,Pro-Caspase-3的表达量从3 h起开始下降,在12 h时最低(P<0.01),18 h表达量开始增多,阳性对照组Pro-Caspase-3 表达量极显著高于空白对照组和实验组(P<0.01)(图4E)。而cl-Caspase-3 的表达量在刺激3 h、6 h、12 h时均增加,12 h 表达量最高(P<0.01),18 h 表达量开始下降,阳性对照组cl-Caspase-3 表达量极显著高于空白对照组和实验组(P<0.01)(图4F)。表明,Ts-p53刺激HUVES,导致Cytochrome C 的表达量增加,Pro-Cas⁃pase-9与Pro-Caspase-3转化为cl-Caspase-9和cl-Cas⁃pase-3,激活了线粒体凋亡通路从而诱导细胞凋亡。
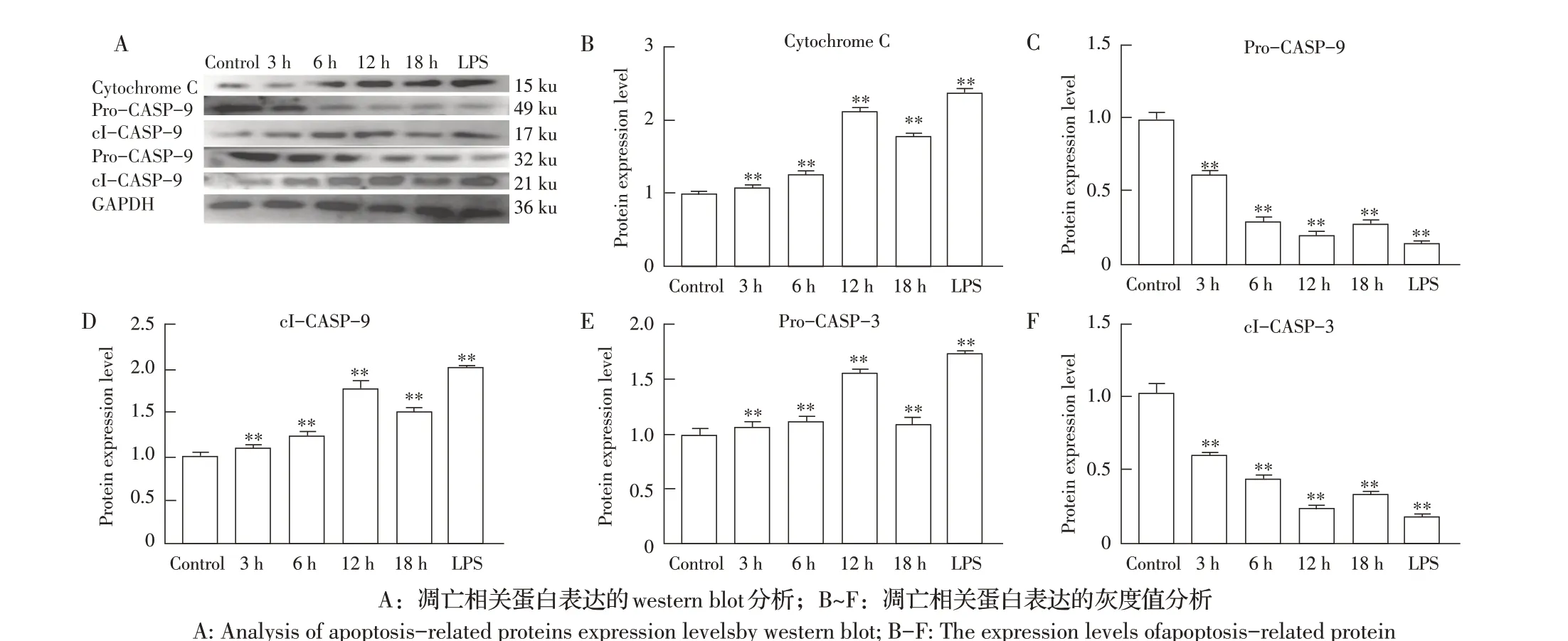
图4 Ts-p53对HUVEC线粒体凋亡相关蛋白表达影响的检测结果Fig.4 Effect of Ts-p53 on the expression of mitochondrial apoptosis-related proteins
2.5 Ts-p53 对ZO-1 及VE-cadherin 转 录及 表 达 水平影响的检测结果为了验证Ts-p53 诱导HUVES 细胞通透性增加与内皮细胞间连接蛋白表达异常有关,本研究利用qPCR 及western blot 方法检测ZO-1 及VEcadherin 的转录及表达水平。qPCR 结果表显示,与空白对照组相比,Ts-p53刺激3 h和6 h时,VE-cadherin的转录水平极显著下降(P<0.01),在刺激12 h 时转录水平最低,在刺激18 h时转录水平增高,阳性对照组中VE-cadherin 转录水平极显著高于空白对照组和实验组(P<0.01)(图5A)。与空白对照组相比,在刺激3 h和6 h 时,ZO-1 的转录水平极显著下降(P<0.01),在刺激12 h时转录水平最低,在刺激18 h时转录水平增加,阳性对照组中ZO-1转录水平极显著高于空白对照组和实验组(P<0.01)(图5B)。Western blot 结果显示,与空白对照组相比,在刺激3 h 和6 h 时,VE-cad⁃herin的表达量极显著下降(P<0.01),在刺激12 h时表达量最少,在刺激18 h时表达量增加,阳性对照组中VEcadherin 表达量极显著高于空白对照组和实验组(P<0.01)(图5D)。与空白对照组相比,在刺激3 h和6 h时,ZO-1的表达量极显著下降(P<0.01),在刺激12 h时表达量最少,刺激18 h时表达量增多,阳性对照组中ZO-1 表达量极显著高于空白对照组和实验组(P<0.01)(图5E)。表明Ts-p53 可以引起内皮细胞间连接蛋白的损伤,导致HUVES 细胞的通透性的增加。

图5 Ts-p53对Zo-1和VE-cadherin转录及蛋白表达水平影响的检测结果Fig.5 Effect of Ts-p53 on transcription and protein expression of Zo-1 and VE-cadherin
3 讨 论
感染旋毛虫后,宿主眼睑、面部、四肢等组织出现水肿,这是血管通透性增高的症状。表明感染旋毛虫会破坏血管内皮细胞屏障,引起血管通透性增高。Ts-p53 是旋毛虫ES 抗原的主要成分之一[9]。研究表明,旋毛虫ES 抗原中43 ku、49 ku、53 ku 混合蛋白中含有TLR4 的配体成分[4],推测混合蛋白作用原理与同样含有TLR4 配体的细菌LPS 相似。p53蛋白属于泰威糖[10],泰威糖是LPS 的一类,LPS 可引起血管内皮细胞通透性的升高[5]。由此推测,Ts-p53与LPS 的作用原理相似,即可以引起血管内皮细胞通透性升高。本实验利用Transwell 细胞渗透性实验证实,Ts-p53 会呈时间依赖性引起HUVES 通透性增高,导致血管内皮屏障破坏。
血管内皮屏障是维持跨内皮细胞蛋白浓度、维持组织液生成与回流的重要结构。目前的研究认为,血管内皮细胞的损伤和内皮细胞间连接蛋白表达的异常是影响血管内皮细胞通透性的两个重要因素[11]。血管内皮细胞结构和功能的稳定,是维持血管通透性的基础。研究表明,失血性休克引起细胞凋亡介质增加,然后启动内皮细胞凋亡和血管通透性增加[12]。细胞凋亡可以通过细胞内源途径的线粒体凋亡通路引起,也可以由细胞外源途径的“死亡配体”通路引起。凋亡发生时,促细胞凋亡(如Bak、Bax)基因和抗细胞凋亡基因(Bcl-2,Bcl-xL)的平衡发生改变。Bcl-2 家族蛋白可以控制线粒体膜的通透性,进而控制线粒体凋亡调节分子的释放[13]。Bcl-2 位于线粒体外膜的表面,调控线粒体膜的功能。Bax 位于细胞质基质中,在受到凋亡刺激后,附着在线粒体膜上的调节细胞凋亡。在本实验中,HUVES 受到Ts-p53刺激后,Bax 表达量增多,Bcl-2 表达量减少,Bax/Bcl-2 值升高,并具有时间依赖性。说明Ts-p53 的刺激破坏了HUVES 细胞中Bax 与Bcl-2 的平衡,引起了细胞凋亡。Bax/Bcl-2 的增加可以导致线粒体功能障碍,线粒体膜电位发生变化,Cytochrome C 通过膜电位转变孔转运至细胞质中,促使细胞发生凋亡并刺激Caspase 蛋白联级反应的发生。Caspase 蛋白是一系列在细胞凋亡过程中起重要作用的半胱氨酸蛋白酶,Caspase-3 和Caspase-9 蛋白裂解生成cl-cas⁃pase-3 和cl-caspase-9[14]。在内源性细胞凋亡途径中,Cytochrome C 与Aparf-1 结合形成多聚体并与Caspase-9 结合形成凋亡小体,Caspase-9 被激活成活化的Caspase-9。活化的Caspase-9 可以继续激活效应Caspase,Caspase-3 作为效应因子被激活为活化的Caspase-3。活化的Caspase-3 引起DNA 的复制和修复障碍,引起线粒体凋亡。在本实验中,Cytochrome C的表达量增多,Caspase-3 和Caspase-9 均被活化。活化的Caspase-3 是细胞凋亡的标志,可见Ts-p53 引起了线粒体途径的细胞凋亡。
内皮细胞间连接是通过紧密连接(TJs)、黏附连接(AJs)两个特定的结构调节血管通透性,同时也是内皮细胞通透性的重要结构基础[15]。ZO-1 是TJs 的一种,属于闭锁带蛋白(Zonula occludes,ZO)。ZO-1 是ZO 家族中研究最多的蛋白,广泛表达于所有上皮和内皮细胞中。本研究中,在Ts-p53 的刺激下,ZO-1蛋白表达随着时间的增加而减少,说明HUVES 的TJs已经遭到破坏。粘附连接蛋白(AJs)包括VE-cadherin等,抑制VE-cadherin的表达可使内皮细胞收缩并与内皮下基质暴露部分分离,破坏肺和心脏的血管内皮屏障[16],说明VE-cadherin 是一种重要的细胞连接蛋白,对血管内皮屏障的维持起到重要作用。在本实验中,VE-cadherin 的表达明显下降,说明Ts-p53 会对AJs造成损伤。
综上所述,本研究结果表明,Ts-p53 从引起HUVES 发生线粒体凋亡和减少内皮细胞间连接蛋白表达两个方面破坏血管内皮屏障,降低了HUVES 通透性。这为进一步研究旋毛虫导致机体水肿的发生提供理论依据。

