樟叶越桔根优势内生菌对宿主组培苗干旱胁迫生理的影响
安雪菲 罗旭璐 唐军荣 刘 云 杨晓琴 马焕成 赵 平
(1. 西南林业大学西南地区林业生物质资源高效利用国家林业和草原局重点实验室,云南 昆明650233;2. 西南林业大学西南地区生物多样性保育国家林业和草原局重点实验室,云南 昆明650233;3. 云南林业职业技术学院,云南 昆明650233)
内生真菌是指在其生活史中的一定阶段或全部阶段生活在健康植物的组织和器官内,对植物组织没有引起明显病害症状的真菌,具有促进宿主生长,提高宿主活性次生代谢产物,增强植物抗病、抗虫和抗干旱胁迫等能力等功能[1-7]。近年来,内生真菌对宿主植物影响的研究,尤其是抗旱方面逐渐成为研究热点之一[7-8]。刘晓珍等[9]发现内生葡萄孢菌(Botrytissp.)和球毛壳菌(Chaetomium globosum)有利于菊花(Chrysanthemum morifolium)耐旱性的提高,龚记熠等[10]报道从野生金钗石斛(Dendrobium nobile)内分离出的3种内生真菌通过提高超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)的活性,增加渗透调节物质脯氨酸(Pro)和可溶性糖含量,以增强金钗石斛的抗旱能力。邹晖等[11]发现铁皮石斛(D. officinale)瘤菌根菌属(Ephlorhzasp.)内生真菌可以提高宿主盆栽苗的存活率和抗旱能力。马碧花等[12]发现内生真菌通过提高寄主的渗透调节和活性氧清除系统进而提高寄主的抗旱性,李超等[13]从玉米(Zea mays)及小麦(Triticum aestivum)组织中的4 株内生真菌对玉米幼苗的促生作用明显,并增强玉米幼苗的抗干旱能力。宋方圆[14]从蓝莓根分离得到的1 株座囊菌纲(Dothideomycetes)内生菌株能够显著提高蓝莓苗的抗旱性。
樟叶越桔(Vaccinium dunalianum)为杜鹃花科(Ericaceae)越桔属(Vaccinium)野生植物,主要分布云南、四川、贵州和西藏等地,其全株具有祛风除湿、舒筋活络等功效[15]。Zhao 等[16]发现该植物富含咖啡酰熊果苷类物质,并先后建立了其组培苗快繁、扦插和细胞悬浮培养体系[17-22]。Fan 等[23]评价了樟叶越桔叶内生真菌的物种多样性,并发现大多数内生真菌对白菜黑斑病菌(Alternaria brassicae)等常见农作物病原真菌具有较强的拮抗活性[24-25]。罗旭璐[26]发现伞状霉科(Umbelopsidaceae)伞状霉属(Umbelopsis)二型伞霉(U. dimorpha)为樟叶越桔根部的优势内生真菌,徐超等[27]发现该菌株在提高铁皮石斛生长速度、抗旱能力等方面的作用效果显著,推测该菌在樟叶越桔中也具有类似的功能。因此,本研究将樟叶越桔根优势内生真菌二型伞霉回接于宿主植物樟叶越桔组培苗中,测定其对宿主组培苗干旱胁迫生理的影响,以期为进一步阐明二型伞霉对宿主植物的抗旱分子机制提供参考。
1 材料与方法
1.1 实验材料
供试菌株为分离鉴定自樟叶越桔根部的优势内生真菌二型伞霉[26],保存于西南林业大学西南山地森林资源保育与利用教育部重点实验室。植物材料为1 年生樟叶越桔组培苗[17]。
1.2 仪器和试剂
超净工作台(苏净集团苏州安泰空气技术有限公司,中国),ZHWY-211B 恒温培养振荡器(常州中诚仪器制造有限公司,中国),HVE-50KB高压蒸气灭菌锅(华粤行仪器有限公司,中国),荣盛GSP 医药专用冰箱(浙江华美冰箱有限公司,中国),ECLIPSE 80i 尼康生物数码显微镜(尼康仪器有限公司,日本)。琼脂(上海科雅生物科技有限公司,中国),分析纯冰醋酸、乙醇、氢氧化钾、浓盐酸、双氧水、茚三酮、脯氨酸、丙二醛等(西陇化工股份有限公司,中国)。
1.3 实验方法
1.3.1 二型伞霉菌液的制备
将樟叶越桔根部的优势内生真菌二型伞霉接到马铃薯葡萄糖琼脂培养基(PDA)上进行活化,用灭菌后的打孔器在菌落边缘处切取菌饼,接入100 mL 马铃薯葡萄糖培养基(PDB)中(250 mL锥形瓶),每瓶接入3 个菌饼,设置5 个重复以避免污染。置于摇床上,在27 ℃、140 r/min 条件下培养7~10 d。
1.3.2 二型伞霉的回接及定殖检测
用灭菌后的打孔器在二型伞霉活化菌落的边缘处切取菌饼,埋入樟叶越桔组培苗[17]的根附近,每盆接入3 块菌饼。用移液枪吸取制备好的菌液浇在樟叶越桔组培苗的根部,每盆接入10 mL菌液,对照组(CK)同时浇10 mL 未接菌的空白PDB 液体培养基。此后每隔3 d 浇1 次菌液,每次每盆浇10 mL,共接种5 次。15 d 后取樟叶越桔组培苗根系,用自来水冲洗干净,置入10% KOH水溶液中60 ℃水浴浸泡10~30 min,蒸馏水冲洗3~5 次后用2% HCl 水溶液室温浸泡10~20 min,蒸馏水冲洗3 次,然后用5% 醋酸墨水染色液60 ℃水浴上进行染色10~30 min 后,在蒸馏水中浸泡2~12 h 并保存。挑取处理好的根段置于载玻片中心,滴入1~2 滴蒸馏水,盖上盖玻片后置于40 倍显微镜下进行定殖检测,观察到有部分根细胞仍然保持鲜明的蓝色,表明这些根细胞受到了真菌菌丝的侵染,二型伞霉成功定殖的樟叶越桔组培苗供后续试验用。
1.3.3 分组实验
将接菌和未接菌的樟叶越桔组培苗分别分为2 组(水分正常组和干旱胁迫组),分别为:Ⅰ组(未接菌,未干旱)、Ⅱ组(未接菌,干旱)、Ⅲ组(接菌,未干旱)和Ⅳ组(接菌,干旱)。干旱胁迫处理即从试验的第0 天开始停止浇水,试验从干旱胁迫的第1 天开始取样,每隔3 d 取1 次,取样时间为干旱胁迫处理后的第1、5、9、13、17、21 天,每次于固定时间从植株的相同部位采取叶片用于生理指标的测定,同时同步检测叶片及土壤的含水率。4 组实验分别取3 组平行样品,每组样品3 个重复,样品采集后保存于-80 ℃超低温冰箱中备用,用于测量抗旱生理指标。
1.3.4 抗旱生理指标测定
SOD 活性采用NBT 核黄素比色法[28]、POD 活性采用愈创木酚比色法[28]、CAT 活性采用钼酸铵比色法[28]、丙二醛(MDA)含量采用TBA 比色法[28]、可溶性糖含量采用蒽酮比色法[28]、Pro 含量采用茚三酮比色法[29]分别进行测定。
2 结果与分析
2.1 干旱处理对土壤含水率和叶片含水率的影响
由图1 可知,未干旱胁迫的Ⅰ组和Ⅲ组的土壤含水率较为稳定,基本保持在60%左右。干旱胁迫的Ⅱ组和Ⅳ组的土壤含水率则随着干旱时间的增加而下降,在干旱的第21 天,接菌的Ⅳ组与未接菌的Ⅱ组的土壤含水率分别为8.64%和7.40%,基本一致。随着干旱时间增加的同时,叶片的含水量也在逐渐下降(图1b),但Ⅳ组的叶片含水率整体均比Ⅱ组叶片含水率高,在干旱胁迫的第21 天时,Ⅱ组叶片的含水率为35.56%,而Ⅳ组叶片的含水率则为45.68%,表明二型伞霉有助于樟叶越桔叶片保持水分。
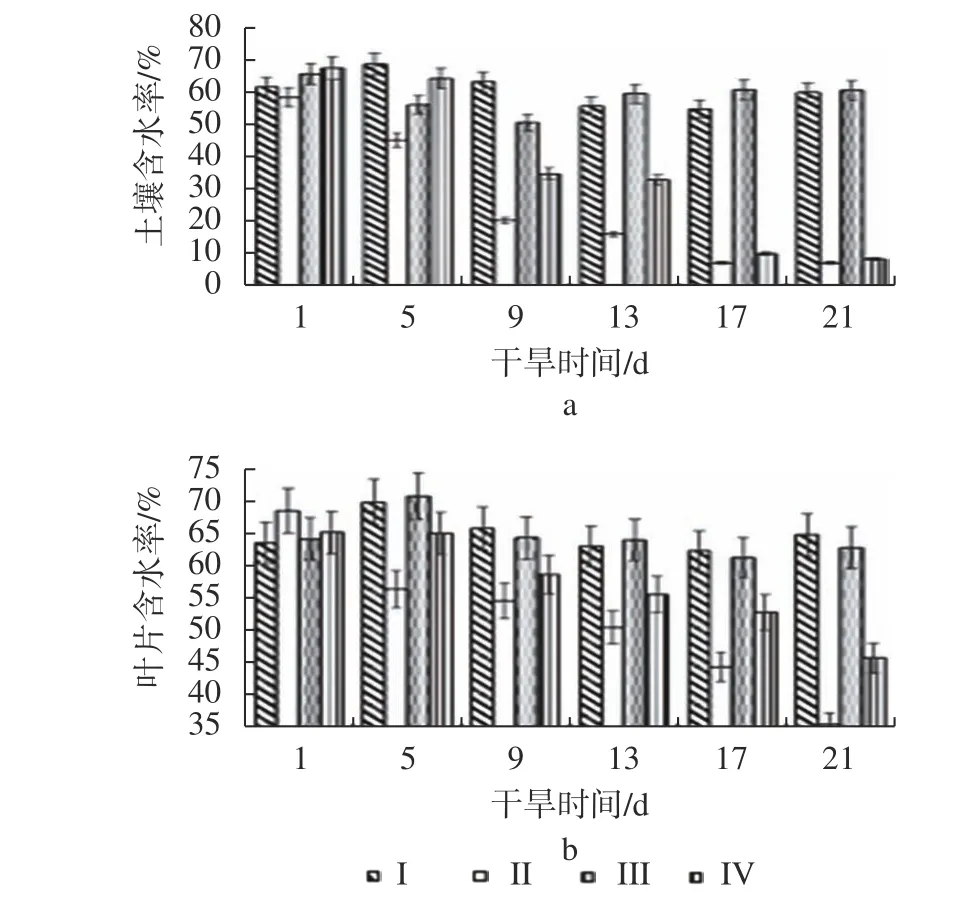
图1 土壤及叶片含水率随着干旱时间的变化Fig. 1 Changes of soil and leaf moisture contents with drought time
2.2 干旱处理对叶片CAT 活性的影响
由图2a 可知,在水分正常的情况下,Ⅰ组和Ⅲ组组培苗叶片的CAT 活性均呈波动状态,比较稳定,接菌组与未接菌组并无明显差异,表明二型伞霉在未干旱条件下对叶片CAT 活性没有明显的影响。

图2 干旱处理对组培苗叶片保护酶活性的影响Fig. 2 Effects of drought treatment on the activities of protective enzymes in tissue cultured seedlings leaves
干旱胁迫下,樟叶越桔组培苗叶片的CAT 活性呈现先上升后下降的趋势,未接菌Ⅱ组与接菌Ⅳ组的CAT 活性均在干旱胁迫的第5 天开始上升,从第5 天到第13 天迅速升高,接菌Ⅳ组的CAT 活性均明显高于未接菌Ⅱ组的活性,在第13 天到达最大值25.07 U/mL 后逐渐下降,第17天时CAT 活性下降至13.27 U/mL 后基本保持稳定,且明显高于未干旱组。因此,在干旱胁迫下,二型伞霉有利于组培苗迅速调节自身的CAT 活性,起到能够增强组培苗叶片中CAT 活性的作用。
2.3 干旱处理对叶片POD 活性的影响
如图2b 所示,在水分正常的情况下,未接菌Ⅰ组和接菌Ⅲ组组培苗叶片的POD 活性均呈波动状态,相对稳定,第Ⅲ组POD 活性波动稍大,先上升随后下降,最终活性相对于起始状态的酶活性总体有所增加,从37.22 U/g 上升为48.89 U/g。未接菌Ⅰ组的最终活性相对于起始状态的酶活性总体下降,从77.78 U/g 降至51.67 U/g,表明二型伞霉在水分正常的情况下有助于增强POD 的活性。
在干旱胁迫下,未接菌Ⅱ组和接菌Ⅳ组的POD 活性呈现先上升后下降之后整体上升的趋势。以叶片的含水量(图1b)作为基线指标来比较分析,接菌组与未接菌组的POD 活性波动几乎一致,未接菌Ⅱ组在干旱的第9 天时,叶片含水量为54.38%,POD 活性为52.78 U/g,位于最低位置并开始上升。而接菌Ⅳ组在干旱的第13 天时,叶片含水量为55.35%,POD 活性为40.56 U/g,同样位于最低位置并开始上升。未接菌Ⅱ组在干旱的第13 天时,叶片含水量为50.35%,POD 活性为79.44 U/g,接菌Ⅳ组在干旱的第17 天时,叶片含水量为52.63%,POD 活性为76.11 U/g,酶活性提升速度较快。未接菌Ⅱ组在干旱的第17 天时,叶片含水量为44.38%,POD 活性为98.89 U/g,接菌Ⅳ组在干旱的第21 天时,叶片含水量为45.68%,POD 活性为127.22 U/g,明显高于未接菌Ⅱ组。表明在干旱胁迫下,二型伞霉能够快速且明显的增强植物中POD 的活性。
2.4 干旱处理对叶片SOD 活性的影响
如图2c 所示,樟叶越桔组培苗叶片的SOD 活性整体呈现先上升后下降的趋势。在水分正常的情况下,各取样同时点的未接菌Ⅰ组和接菌Ⅲ组组培苗叶片的SOD 活性差别不大,在第21 天时,接菌Ⅲ组的SOD 活性下降至31.10 U/g,未接菌Ⅰ组下降至29.51 U/g。在干旱胁迫下,在第5 天时,未接菌Ⅱ组的SOD 活性从第1 d 的51.83 U/g大幅下降到34.44 U/g 的同时,接菌Ⅳ组的SOD活性从第1 d 的51.36 U/g 略增至57.11 U/g,2 组之间存在明显差异。除此之外,其余各取样同时点的未接菌Ⅱ组和接菌Ⅳ组的SOD 活性差别并无明显差异,表明在水分正常情况或是干旱条件下,二型伞霉对组培苗叶片的SOD 活性影响不大。
2.5 干旱处理对叶片Pro 含量的影响
如图3a 所示,在水分正常的情况下,未接菌Ⅰ组Pro 含量的波动相对比较稳定,接菌Ⅲ组Pro含量的波动相对较大,但与未接菌组并无明显差异,表明二型伞霉对组培苗Pro 含量的影响不大。

图3 干旱处理对组培苗叶片Pro、MDA 和可溶性糖含量的影响Fig. 3 Effects of drought treatment on the contents of proline, malondialdehyde and soluble sugars in tissue cultured seedlings leaves
干旱胁迫下,樟叶越桔组培苗叶片的Pro 含量总体呈现先上升后下降的趋势,随着干旱时间的不断增加,从干旱的第5 天到第13 天,未接菌Ⅱ组与接菌Ⅳ组的Pro 含量均迅速升高,未接菌Ⅱ组的Pro 含量由20.10 μg/g 增加至48.45 μg/g,而接菌Ⅳ组的Pro 含量由24.57 μg/g 增加至59.45 μg/g,接菌Ⅳ组Pro 含量的增加速率及增加总量均明显优于未接菌Ⅱ组。在干旱的第13 天时Pro含量到达最高点,然后在第13 天到第17 天期间呈现下降趋势,随着干旱时间的继续,一直到第21 天,Pro 的含量基本维持稳定,此时,接菌Ⅳ组Pro 含量为35.22 μg/g,未接菌Ⅱ组Pro 含量为27.67 μg/g,明显看出接菌Ⅳ组的Pro 含量总体上均高于未接菌Ⅱ组,表明在干旱胁迫下,二型伞霉能够更加快速且明显的增强组培苗叶片中Pro的含量。
2.6 干旱处理对叶片MDA 含量的影响
如图3b 所示,在水分正常的情况下,未接菌的Ⅰ组和接菌的Ⅲ组叶片的MDA 含量均呈现相对稳定的波动状态,表明二型伞霉对组培苗叶片MDA 含量的变化影响不大。
在干旱胁迫下,未接菌Ⅱ组和接菌Ⅳ组的MDA 含量前期较为平稳,从第9 d 开始略微下降,但在第13 天2 组MDA 含量均迅速上升,接菌Ⅳ组的MDA 含量为51.97 μmol/g,叶片含水量为55.35%,未接菌Ⅱ组的MDA 含量为48.66 μmol/g,叶片含水量为50.35%,接菌组与未接菌组的MDA含量均位于最低值并开始上升。在干旱的第17天,接菌Ⅳ组的叶片含水量为52.63% 时,MDA含量为72.65 μmol/g,未接菌Ⅱ组的叶片含水量为44.38%时,MDA 含量为87.06 μmol/g,表明随着干旱时间的增加,接菌组与未接菌组植株的MDA 含量均明显增加。当叶片含水量大致相同时,未接菌组的MDA 含量比接菌组的稍低,但处于干旱状态下时,接菌组MDA 含量的增加比未接菌组的低,在干旱的第17 天时,接菌干旱组MDA 含量(72.65 μmol/g)低于未接菌未干旱组MDA 含量(75.02 μmol/g),因此植株中的MDA含量波动较大,未能呈现很好的规律性。而接菌后的植株MDA 含量相对较稳定,表明接菌能够帮助植株更好的维持细胞膜稳定性,有助于增强植物的耐旱能力。
2.7 干旱处理对叶片可溶性糖含量的影响
如图3c 所示,在水分正常的情况下,未接菌的第Ⅰ组和接菌的第Ⅲ组组培苗的可溶性糖含量均呈现相对稳定的波动状态,总体含量也有所增加,表明在植物正常生长的情况下,接菌和未接菌对植株可溶性糖含量的变化影响不大。
在干旱胁迫下,与MDA 含量的趋势大致相似,接菌Ⅵ组和未接菌Ⅱ组可溶性糖含量前期较为平稳,波动不大,但均在干旱胁迫的第13 天开始含量迅速上升。在干旱的第13 天,接菌Ⅵ组可溶性糖的含量为256.06 μmol/g,叶片含水量为55.35%,未接菌Ⅱ组可溶性糖含量为252.70 μmol/g,叶片含水量为50.35%时,可溶性糖含量的调控开始响应。未接菌组在干旱的第17 天,叶片含水量为44.38%时,可溶性糖含量为418.40 μmol/g,而接菌组在叶片含水量为45.68% 时,可溶性糖含量为442.17 μmol/g,表明二型伞霉能够提高组培苗可溶性糖的调控响应速度,在干旱胁迫下有助于植物体中可溶性糖的累积。以叶片的含水量作为基线指标来比较分析,接菌组组培苗的可溶性糖响应调控速度明显优于未接菌组,当接菌组的叶片含水量为52.63% 时,可溶性糖含量为370.27 μmol/g,显著高于未接菌组相同叶片含水量时的可溶性糖含量(252.70 μmol/g),同样说明二型伞霉能够提高组培苗可溶性糖的调控响应速度。
3 结论与讨论
将樟叶越桔根中的优势内生真菌二型伞霉回接到组培苗中进行干旱胁迫实验,结果显示在水分正常的情况下,樟叶越桔根中优势内生真菌在植物正常的生长过程中有助于增强POD 的活性,在干旱胁迫下,樟叶越桔根中优势内生真菌能够快速且显著的增强植物中POD 的活性,有利于组培苗迅速调节自身的CAT 活性,起到能够增强组培苗中CAT 活性的作用。同时,二型伞霉能够更加快速且明显地增强植物中Pro 的含量和可溶性糖的累积。实验结果表明,樟叶越桔根中的优势内生真菌二型伞霉能够增强樟叶越桔抵御干旱的能力。
植物在受到干旱胁迫时,在细胞中过量的积累如过氧化氢、超氧阴离子和羟自由基等,会引发膜脂过氧化反应,使过氧化反应的产物MDA 增加,而产生的过多MDA会损害细胞膜系统,使膜丧失透性选择性,因此MDA 通常被作为衡量干旱程度的重要指标之一,以反映细胞膜氧化损伤程度和细胞膜结构的完整性[8,30-31]。在干旱胁迫的过程中,未接菌组的MDA含量波动性较大,而接菌后的MDA 含量稳定性较好,表明接种二型伞霉可以通过抑制膜脂过氧化反应,较好地维持细胞膜的稳定性,从而有助于增强宿主植物的抗旱能力。植物体中的POD、CAT、SOD等抗氧化酶能够帮助植物清除体内累积的活性氧,所以这类抗氧化酶的活性与植物干旱抗性紧密相关[7,32]。植物叶片中POD 酶活性的增加表明植物初期启动保护酶系统来清除体内相关自由基,以此来减少干旱初期体内这些自由基对植物的伤害。结果显示,二型伞霉在植物正常的生长过程中有助于增强POD 的活性,在干旱胁迫下,接菌后的植株能够快速且显著的增强POD 的活性,同时能够迅速地调节CAT 的活性,有助于帮助植物缓解和抵御干旱胁迫。
植物受到干旱胁迫时,同时还能够产生Pro、可溶性糖等渗透调节物质,使细胞的渗透压升高,减少水分流失,从而降低或消除干旱胁迫对植物造成的伤害[7-8,33-35]。实验结果同时显示,在干旱胁迫时,接菌的植株能够更加快速且明显的增强Pro 的含量,并提高可溶性糖含量的调控响应速度,接菌有助于Pro 和可溶性糖的累积,增加植株的抗旱性。本研究仅对樟叶越桔根中优势内生真菌二型伞霉的抗旱作用进行了探讨,发现该菌株有助于增强宿主植物的抗旱能力,与徐超等[27]的研究结果较为吻合。但樟叶越桔中其他的内生真菌及内生细菌是否具有类似功能有待进一步挖掘。由于内生菌株侵染宿主植物后,在宿主体内定殖呈现出一个动态的过程,不仅是在植物各组织间的定殖,还包括在植物体内定殖的时间轴上,其定殖量也呈现出消长的动态变化[36],有必要对二型伞霉在宿主中的定殖消长变化规律开展进一步的深入研究。内生菌在与宿主植物长期的协同进化过程中,在植物体内形成庞大的微生态系统,所产生的生物学效应是多种内生菌协同作用的结果。因此,进一步加强对多个菌种的混合接种即多菌株制剂的开发利用,或能使各个菌株的功能产生累加效应,将有助于更好地开发和利用内生真菌这一独特的功能性资源。

