藏药七味铁屑胶囊对CCL4大鼠肝纤维化程度的影响
王珊珊 李卫红 仁青加 李腾辉 解宇晴 李雅璇 杜庆红
〔摘要〕 目的 觀察藏药七味铁屑胶囊对CCL4诱导的肝纤维化大鼠肝纤维化程度的影响。方法 健康雄性SD大鼠60只,分为空白组(N组)、模型组(M组)、鳖甲软肝片组(Y组),以及七味铁屑胶囊高剂量组(QH组)、中剂量组(QM组)、低剂量组(QL组),每组10只。除N组外,其余大鼠建立大鼠CCL4肝纤维化模型。造模4周后,测定肝脾指数;全自动生化仪检测血清天冬氨酸氨基转移酶(aspartateaminotransferase, AST)、丙氨酸氨基转移酶(alanineaminotransferase, ALT)含量;采用ELISA法检测肝组织肿瘤坏死因子-α(tumornecrosisfactor, TNF-α)、白细胞介素-1β(interleukin, IL-1β)水平;定量检测肝组织羟脯氨酸(hydroxyproline, HYP)含量和谷胱甘肽过氧化物酶(glutathioneperoxidase, GSH-Px)活力。结果 与N组相比,M组肝脾指数明显升高(P<0.001);AST、ALT、HYP含量显著上升(P<0.001);TNF-α、IL-1β含量明显升高(P<0.05,P<0.01),GSH-Px活力显著降低(P<0.001)。与M组相比,各给药组肝脏指数均显著降低(P<0.01,P<0.001);QM组脾脏指数显著降低(P<0.01);Y组、QH组血清AST、ALT含量明显降低(P<0.05);Y组、QH组、QM组HYP含量显著降低(P<0.01,P<0.001),GSH-Px活力升高(P<0.01,P<0.001);Y组、QM组TNF-α水平明显降低(P<0.05),各治疗组IL-1β水平均显著下降(P<0.01,P<0.001);与Y组比,QH组GSH-Px活力明显升高(P<0.05)。结论 藏药七味铁屑胶囊可减轻CCL4诱导的大鼠肝纤维化程度,其机制可能与缓解炎症反应、抑制胶原生成、增强抗氧化能力有关。
〔关键词〕 藏药;七味铁屑胶囊;肝纤维化;炎症;抗氧化
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.02.009
Effect of Tibetan medicine Qiwei Tiexie Capsule on the degree of liver fibrosis rats induced by CCL4
WANG Shanshan1, LI Weihong1, REN Qingjia2, LI Tenghui1, XIE Yuqing3, LI Yaxuan1, DU Qinghong1*
(1. School of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China;
2. University of Tibetan Medicine, Lasa, Tibetan 850000, China; 3. Dongzhimen Hospital, Beijing University of
Chinese Medicine, Beijing 100700, China)
〔Abstract〕 Objective To observe the effect of Qiwei Tiexie Capsule on the degree of liver fibrosis in CCL4-induced liver fibrosis rats. Methods 60 healthy male SD rats were divided into blank group (N group), model group (M group), Biejia Ruangan Tablet group (Y group), high-dose (QH), medium-dose (QM) and low-dose (QL) groups of Qiwei Tiexie Capsule, with 10 rats in each group. The CCL4 liver fibrosis model of rats was established except N group. After 4 weeks of modeling, the liver and spleen indexes were measured; the content of serum aspartate aminotransferase (AST) and alanine aminotransferase (ALT) was detected by automatic biochemical analyzer; the levels of tumor necrosis factor (TNF-α) and interleukin-1β (IL-1β) in liver tissues were detected by ELISA; the content of hydroxyproline (HYP) and the activity of glutathione peroxidase (GSH-Px) in liver tissues was determined quantitatively. Results Compared with the N group, the liver and spleen index of the M group increased significantly (P<0.001); the content of AST, ALT, and HYP increased significantly (P<0.001); the content of TNF-α and IL-1β increased significantly (P<0.05, P<0.01); the activity of GSH-Px was significantly reduced (P<0.001). Compared with the M group, the liver index of each administration group significantly reduced (P<0.01, P<0.001); the spleen index of QM group significantly reduced (P<0.01); the content of serum AST and ALT of Y group and QH group significantly reduced (P<0.05); the content of HYP of Y group, QH group, QM group significantly reduced (P<0.01, P<0.001), the activity of GSH-Px significantly increased (P<0.01, P<0.001); the TNF-α level of liver tissue of Y group and QM group significantly reduced (P<0.05), the level of IL-1β decreased significantly in all treatment groups (P<0.01, P<0.001); compared with the Y group, the activity of GSH-Px of the QH group was significantly increased (P<0.05). Conclusion Tibetan
medicine Qiwei Tiexie Capsule can alleviate CCL4-induced liver fibrosis in rats, which may be related with reduced inflammation,
decreased collagen production, and enhanced antioxidant capacity.
〔Keywords〕 Tibetan medicine; Qiwei Tiexie Capsule; liver fibrosis; inflammation; antioxidant
肝纤维化的产生是不同诱因引发的肝损伤后期必经的病理阶段[1],其主要特点是肝细胞损伤、慢性炎症以及纤维组织增生3个环节的反复进行,其本质是肝脏对不明诱因引起的肝损伤进行的自我修复,在我国以及全球的发病率一直处于居高不下的状态,甚至呈上升趋势[2]。虽然近年来对肝纤维化的基础研究甚广,但在临床诊疗中对肝纤维化的治疗仍缺乏行之有效的药物[3]。七味铁屑胶囊是七味铁屑丸的改良剂型,属藏医经典名方,由铁屑(诃子制)、北寒水石(奶制)、藏木香、木香、甘青青蓝、红花、五灵脂膏组成,可活血行气、平肝清热止痛,临床常用以各种原因引发的肝区疼痛、肝脏肿大等。陈潇迪等[4]研究发现,七味铁屑胶囊可用于诊治非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD),但未见文献报道该药对肝纤维化程度存在的影响。本实验通过制备经典大鼠CCL4肝纤维化模型,研究七味铁屑胶囊对肝纤维化程度的影响,旨在为临床诊疗应用七味铁屑胶囊抗肝纤维化提供基础数据支持。
1 材料
1.1 实验动物
健康雄性SD大鼠60只,体质量(200±20) g,购自北京斯贝福生物有限公司[动物生产许可证号:SCXK(京)2019-0010],饲养于北京中医药大学实验动物中心,许可证号SYXK(京)2020-0033。本实验经北京中医药大学动物伦理委员会审查通过,审查号为BUCM-4-2020122005-4180。
1.2 药物、主要试剂与仪器
七味铁屑胶囊(批号:191001,西藏金哈达药业有限公司);复方鳖甲软肝片(批号:20200402,内蒙古福瑞医疗科技股份有限公司);四氯化碳分析纯(批号:20200902,福晨化学试剂有限公司);橄榄油分析纯AR(批号:0815210,上海麦克林生化科技有限公司);羟脯氨酸(hydroxyproline, HYP)检测试剂盒(批号:20200922)、谷胱甘肽过氧化物酶(glutathioneperoxidase, GSH-Px)检测试剂盒(批号:20200923)均购自南京建成生物工程研究所;TNF-α ELISA试剂盒(批号:715101420)、IL-1β ELISA试剂盒(批号:728101520)均购自美国Thermo公司;AH480型全自动生化分析仪(美国贝克曼库尔特公司);Epoch型全波长酶标仪(美国Bio Tek公司);5810R型高速冷冻离心机(德国Eppendorf公司);ME204E型电子分析天平(美国METTLER TOLEDO公司)。
2 方法
2.1 动物分组
将60只SPF级健康SD雄性大鼠随机分为6组,空白组(N组)、模型组(M组)、鳖甲软肝片组(Y组),以及七味铁屑胶囊高剂量组(QH组)、中剂量组(QM组)、低剂量组(QL组),各10只,并做相应编号,适应性喂养3 d后开始进行造模及给药处理。
2.2 造模及给药
将CCL4与橄榄油等比例融合,配成50% CCL4混合溶剂,采用灌胃法诱导肝的纤维病变[5],模型组与各治疗组均以2 mL/kg剂量造模(首次剂量4 mL/kg),2次/周,造模共用时4周[6]。第2周起除N组与M组外,其余各组灌胃给药治疗,1次/d,连续3周。Y组按6倍成人等效剂量即0.6 g/kg[7]给药,QH组、QM组、QL组剂量分别为0.4、0.2、0.1 g/kg,鱉甲软肝片与七味铁屑胶囊在灌胃前均用生理盐水溶解为混悬液,N组和M组同时分别给以等体积的生理盐水。期间所有大鼠正常进食,测重1次/周,以及时校对治疗用药剂量。
2.3 指标检测及方法
2.3.1 肝脾指数测定 各组大鼠末次给予治疗药物后禁食不禁水24 h,实验开始前称量各组大鼠体质量,10%的水合氯醛4 mL/kg进行腹腔注射麻醉。取完血后立即摘取肝、脾,经PBS冲洗后用滤纸吸干水分并及时测量湿重,计算肝脾指数脏器指数=脏器湿重(g)/大鼠体质量(g)×100%。
2.3.2 肝功能测定 腹主动脉收集全血后室温静置2 h,待血液出现分层后进行离心,3000 r/min,4 ℃,离心10 min(离心半径40 cm),取上清并及时按需分装,当天检测血清天冬氨酸氨基转移酶(aspartateaminotransferase, AST)、丙氨酸氨基转移酶(alanineaminotransferase, ALT)含量。
2.3.3 组织病理及炎症情况 每只大鼠取相同部位的肝右叶(约1 cm×1 cm×0.6 cm),并去掉边缘多余组织,4%多聚甲醛固定2 d,HE染色观察肝组织形态结构变化;采用ELISA法将组织匀浆加入到有抗体包被的96孔板中,洗涤,加生物素化抗体,洗涤,后加HRP标记的链霉亲和素,洗涤,加TMB底物,加终止液,在450 nm波长下经酶标仪读数,以检测肝组织中TNF-α、IL-1β的含量以反应炎症表达情况。
2.3.4 胶原纤维增生观察 做HE染色的肝组织一同用来做Masson染色,通过Image J软件半定量分析各组肝脏中胶原容积分数(collagen volume fraction, CVF),并用相应试剂盒测定肝组织HYP含量表达反应组织纤维增生情况。
2.3.5 抗氧化反应观察 取肝组织湿重30 mg,按1∶9比例加入0.27 mL生理盐水,制备10%组织匀浆,并按需稀释为最佳浓度,测定GSH-Px的活力。检测步骤与方法严格遵照相应试剂盒说明书进行。
2.4 统计学方法
使用SPSS 20.0软件进行数据整理分析,数据以“x±s”形式呈现,多组间比较采用One-way ANOVA方差分析检验;若数据资料不符合正态分布或方差不齐,则采用非参数检验。以P<0.05为差异有统计学意义。
3 结果
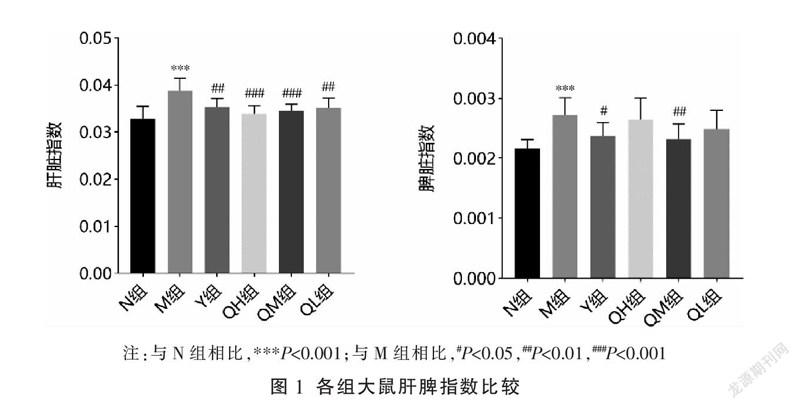
3.1 七味铁屑胶囊对肝脾指数的影响
相比N组,M组肝脾指数均显著升高(P<0.001);相比M组,给药各组肝脏指数均显著降低(P<0.01,P<0.001),Y组、QM组脾脏指数明显下降(P<0.05,P<0.01)。见图1。
3.2 七味铁屑胶囊对肝组织形态结构的影响
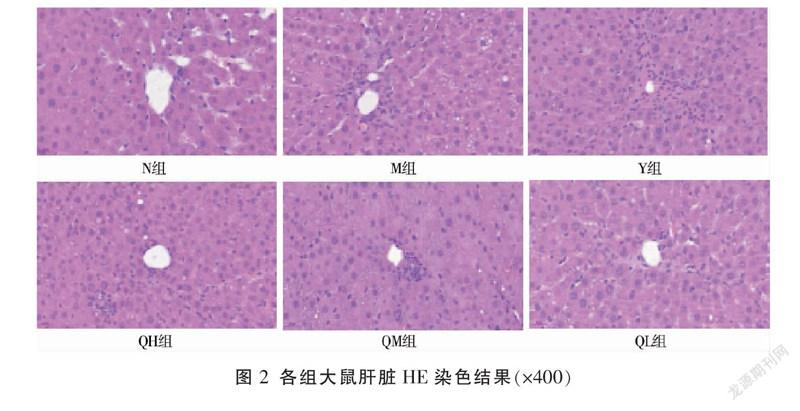
N组肝实质的生理结构状态基本正常,以中央静脉为中心的肝索及肝窦大致呈放射状排列在周围。M组肝实质受到严重损害,肝细胞发生大量脂肪变性及坏死,炎症细胞对肝脏的浸润程度明显加剧,肝小叶的结构发生严重紊乱。相比M组,各给药组肝细胞形态结构、炎症细胞浸润程度及胶原纤维增生情况均有所改善。见图2。
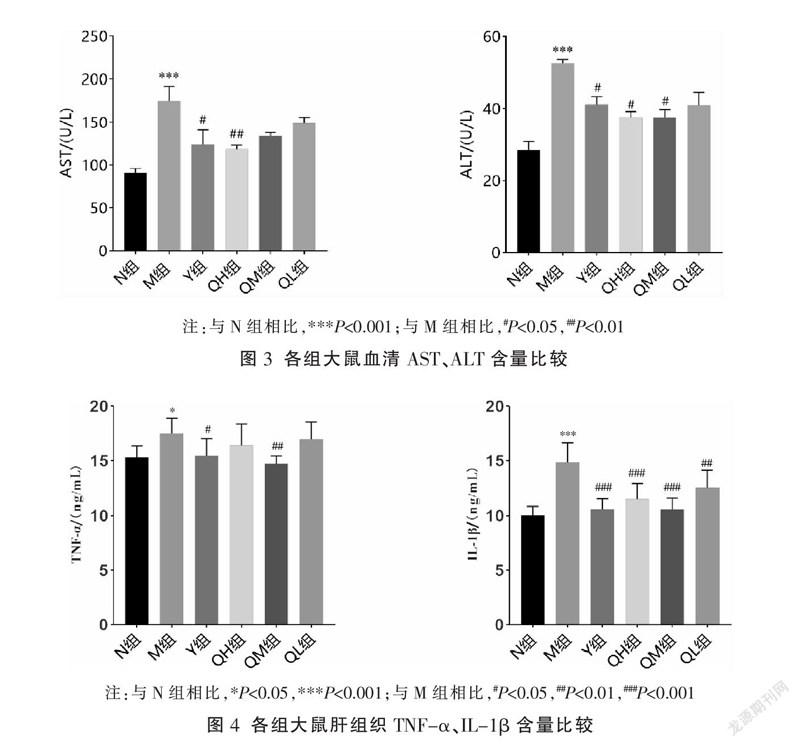
3.3 七味铁屑胶囊对肝功能的影响
相比N组,M组AST、ALT含量显著升高(P<0.001);相比M组,Y组、QH组AST含量明显下降(P<0.05,P<0.01),Y组、QH组、QM组ALT含量明显降低(P<0.05)。见图3。
3.4 七味铁屑胶囊对炎症因子的影响
相比N组,M组TNF-α、IL-1β含量明显升高(P<0.05,P<0.01);相比M组,Y组、QM组TNF-α含量明显降低(P<0.05,P<0.01),IL-1β含量在各个治疗组均显著降低(P<0.01,P<0.001)。见图4。
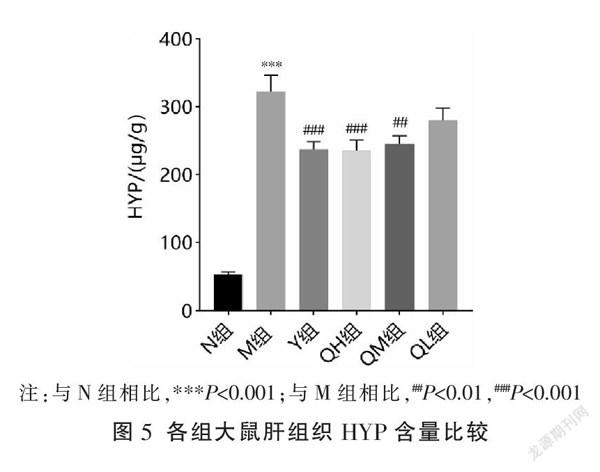
3.5 七味铁屑胶囊对HYP含量的影响
相比N组,M组HYP含量显著升高(P<0.001);相比M组,Y组、QH组、QM组HYP含量显著降低(P<0.01,P<0.001),QL组有下降趋势但差异无统计学意义(P>0.05)。见图5。
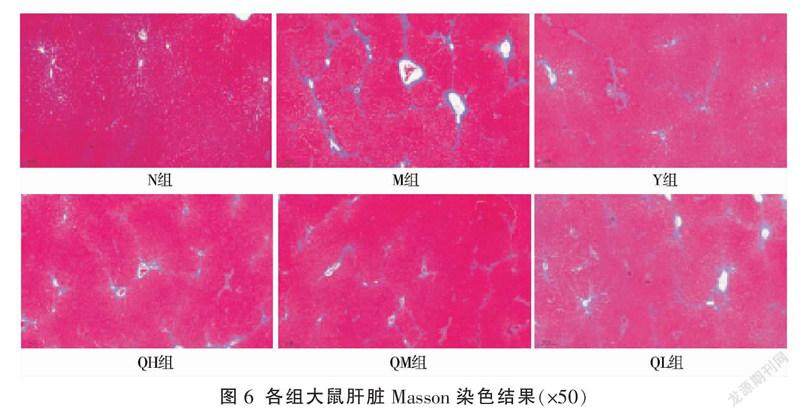
3.6 七味铁屑胶囊对胶原合成的影响
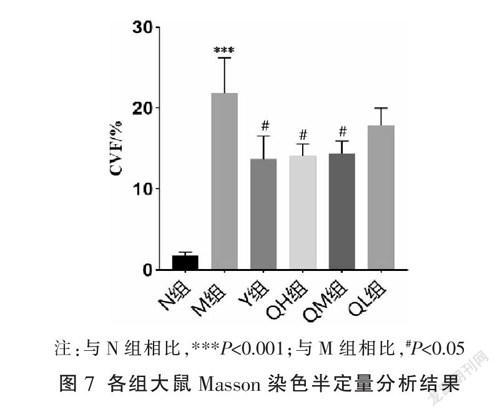
N组肝组织结构基本正常,仅在血窦和门管区周围见少量胶原纤维。M组可见血窦、肝索等结构严重紊乱,中央静脉、门管区及肝小叶周围均有大量胶原纤维生成,增生的胶原纤维连接门管区-门管区或门管区-中央静脉或中央静脉-中央静脉,形成桥接样纤维化。各给药组的胶原纤维与M组相比显著减少,见图6。相比N组,M组CVF显著增加(P<0.001);相比M组,Y组、QH组、QM组CVF明显下降(P<0.05),QL组有下降趋势但差异无统计学意义(P>0.05),且此结果与HYP所得结果相一致,见图7。
3.7 七味铁屑胶囊对GSH-Px活力的影响
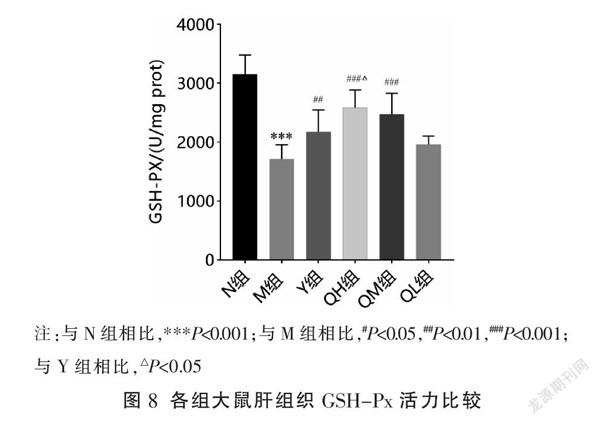
相比N组,M组GSH-Px的活力显著降低(P<0.001);相比M组,Y组、QH组、QM组GSH-Px的活力显著提高(P<0.01,P<0.001),QL组GSH-Px活力有下降趋势但差异无统计学意义(P>0.05);與Y组相比,QH组GSH-Px活力明显升高(P<0.05)。见图8。
4 讨论
目前,临床上抗纤维化治疗靶点的识别、评估慢性肝病纤维化进展的非侵入性方法和生物标志物等方面获得了很大程度的进展[8],但对抗药物较少,探究肝纤维化可逆性的机理及治疗药物贯穿该领域的始终[9]。由于青藏高原的特殊地理环境,藏族人民为了抵抗高海拔、低氧、高寒,世代形成了喜饮酒、喜高热量及富油脂食物、喜食肉类的饮食习惯,引发了各种慢性肝病,尤其是酒精性肝病[10]或NAFLD[11]。发源于青藏高原的藏医药学在治疗慢性肝病方面积淀了较为丰富的诊疗经验,形成诸多经典藏药成方[12],本实验研究中的七味铁屑胶囊即为经典方剂七味铁屑丸的改良剂型,其成分中的红花、五灵脂膏活血止痛,配伍木香以行气止痛,又配伍藏木香以健脾和胃、调气解郁、止痛,达到行气活血止痛的效果,甘青青蓝、北寒水石清肝胃之热,配伍铁屑(诃子制)解毒,减轻肝脏负担,达到益肝效果。本实验结果显示,七味铁屑胶囊可显著改善早期肝纤维化,其作用机制在很大程度上与肝脏功能的增强、炎症反应的降低、氧化应激的减缓等方面有关。
HYP广泛存在于人体的胶原蛋白中,胶原纤维作为肝脏纤维化主要添加剂所增加的一种纤维性成分,而HYP为胶原纤维的特有成分。本研究结果表明,QH组、QM组在降低HYP水平方面有显著优势,Masson染色也同样显示胶原增生情况明显下降,表明七味铁屑胶囊可显著降低肝组织HYP含量,抑制胶原合成或促进胶原的降解,有效改善肝纤维化程度。
Lee UE等[13]研究显示,肝组织纤维样变的进展与长期的炎症刺激、过度的氧化应激反应等有关。CCL4是作为肝毒素诱导剂,是外源性毒物导致肝细胞损害的最佳途径之一[14],有毒物质的持续损害导致肝细胞变性坏死,血中的AST、ALT等代表肝功能的转氨酶明显上升。本实验发现,七味铁屑胶囊QH组可显著降低血清AST、ALT水平,表明七味铁屑胶囊可在一定程度上保护肝细胞,改善肝脏功能。炎症反应是急性或慢性肝病患者病程进展的一个重要影响因素,在初期炎症反应中可作为预防和保护肝脏细胞的一种有效机制[15],但损伤因子的长期刺激可导致炎症细胞(如Kuppfer细胞)大量聚集,活化的Kuppfer细胞可分泌丰富的细胞因子(如TNF-α、IL-1β)[16],细胞因子的大量生成刺激窦周隙中的静止肝星状细胞(hepatic stellate cell, HSC)并促使HSC活化。活化的HSC失去储存维生素A的能力并产生大量胶原蛋白,引起细胞外基质(extracellular matrix, ECM)的大量堆积,最终导致肝纤维化的生成[17-18]。本研究结果显示,七味铁屑胶囊各组在降低TNF-α、IL-1β方面发挥显著优势,炎症因子浸润程度明显减轻,此结果与HE病理组织染色结果一致。Ji DG等[19]发现肝损伤时代表机体抗氧化反应的还原型谷胱甘肽及GSH-Px活力下降,且GSH-Px可保护细胞膜结构的完整和功能的正常发挥,增强机体抗氧化能力[20]。经检测,QH组、QM组可显著提升GSH-Px活力,且治疗效果优于Y组。
综上所述,七味铁屑胶囊可有效改善肝纤维化程度,减轻炎症反应刺激及大量细胞因子的分泌,提高肝细胞抗损、抗氧化能力,增强肝脏功能,这为七味铁屑胶囊用于肝纤维化临床提供了有力支撑,在后续研究中将对其药理机制作更深入的探索。
参考文献
[1] CHEN Q L, ZHANG J Q, ZHENG T, et al. The role of microRNAs in the pathogenesis, grading and treatment of hepatic fibrosis in schistosomiasis[J]. Parasites & Vectors, 2019, 12(1): 611.
[2] ASRANI S K, DEVARBHAVI H, EATON J, et al. Burden of liver diseases in the world[J]. Journal of Hepatology, 2019, 70(1): 151-171.
[3] 徐列明.《肝纤维化中西医结合诊疗指南(2019年版)》解读[J].上海中医药杂志,2020,54(3):29-31,52.
[4] 陈潇迪,王 军,熊 吉,等.七味铁屑胶囊对NAFLD大鼠的疗效观察及ERS相关因子的影响[J].中华中医药杂志,2012,27(9):2405-2408.
[5] 蔡碧莲,文亦磊,罗伟生.大鼠肝纤维化实验动物模型的构建[J].陕西医学杂志,2020,49(6):659-662.
[6] LIU H M, ZHANG Z F, HU H, et al. Protective effects of Liuweiw⁃
uling tablets on carbon tetrachloride-induced hepatic fibrosis in rats[J]. BMC Complementary and Alternative Medicine, 2018, 18(1): 212.
[7] 邱 实,程静屏.扶正化瘀片联合复方鳖甲软肝片对肝硬化患者肝纤维化及炎症指标的改善作用[J].中国医药,2021,16(12):1833-1836.
[8] PAROLA M, PINZANI M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues[J]. Molecular Aspects of Medicine, 2019, 65: 37-55.
[9] FRIEDMAN S L. Hepatic fibrosis: Emerging therapies[J]. Digestive Diseases, 2015, 33(4): 504-507.
[10] 王 豆,杨 颖,段颖骞.日喀则地区酒精性肝病流行病学调查研究[J].世界最新医学信息文摘,2018,18(78):210-211,217.
[11] 管红雨,蔡晓波,陆伦根.缺氧对非酒精性脂肪性肝病发病的影响[J].实用肝脏病杂志,2016,19(2):237-240.
[12] 王珊珊,杜庆红,仁青加,等.藏医对慢性肝病认识及治疗进展[J].辽宁中医药大学学报,2021,23(7):197-201.
[13] LEE U E, FRIEDMAN S L. Mechanisms of hepatic fibrogenesis[J]. Best Practice & Research Clinical Gastroenterology, 2011, 25(2): 195-206.
[14] MAHMOODZADEH Y, MAZANI M, REZAGHOLIZADEH L. Hepatoprotective effect of methanolic Tanacetum parthenium extract on CCl4-induced liver damage in rats[J]. Toxicology Reports, 2017, 4: 455-462.
[15] IGNAT S R, DINESCU S, HERMENEAN A, et al. Cellular interplay as a consequence of inflammatory signals leading to liver fibrosis development[J]. Cells, 2020, 9(2): 461.
[16] ZHANGDI H J, SU S B, WANG F, et al. Crosstalk network among multiple inflammatory mediators in liver fibrosis[J]. World Journal of Gastroenterology, 2019, 25(33): 4835-4849.
[17] DHAR D, BAGLIERI J, KISSELEVA T, et al. Mechanisms of liver fibrosis and its role in liver cancer[J]. Experimental Biology and Medicine, 2020, 245(2): 96-108.
[18] TAO Y, WANG N N, QIU T M, et al. The role of autophagy and NLRP3 inflammasome in liver fibrosis[J]. BioMed Research International, 2020, 2020: 7269150.
[19] JI D G, ZHANG Y, YAO S M, et al. Cav-1 deficiency promotes liver fibrosis in carbon tetrachloride (CCl4)-induced mice by regulation of oxidative stress and inflammation responses[J]. Biomedicine & Pharmacotherapy, 2018, 102: 26-33.
[20] 董 玲,黃 湘,覃陆慧,等.山栀子根提取物对四氯化碳诱导肝纤维化大鼠的作用研究[J].中药材,2019,42(4):897-901.

