根腐病对茅苍术根际微生物群落多样性的影响
刘 杰,林茂祥,肖 忠,李 娟,张万超,韩如刚,韩 凤,2*
(1.重庆市药物种植研究所,重庆南川408435;2.重庆市道地药材规范化生产工程技术研究中心,重庆南川408435)
苍术作为重要的植物药主要以多年生菊科苍术属(Atractylodes)草本植物根茎入药,在东亚地区被广泛应用。苍术的主要药用活性成分为挥发油,其中含量较高有苍术酮、茅术醇、榄香油醇、β-桉叶醇等倍半萜类和苍术素、苍术素醇等聚乙炔类[1-2]。苍术具有消炎止痛、治疗风湿、消化功能紊乱、急性肠炎、夜盲症、流感、抗肿瘤等作用[3-7],在新药研发方面具有较大的潜能。苍术不仅作为传统大宗中药材被收入中国国家药典[8],也被收入了日本药典[9]。
在我国,茅苍术[A.lancea(Thunb.)DC.]主产于江苏、浙江、山东、江西、广东、安徽、湖北、四川等地[10]。根部病害对茅苍术种植业的威胁巨大,以根腐病和白绢病最为常见[11]。根腐病主要危害植物的根及根茎,使其腐烂,引起植物地上部分叶片变黄、植株萎蔫,直至枯死[12]。目前,根腐病尚无有效的根治措施,是中药材栽培中最常见的毁灭性病害,已成为限制中药材生产的一大障碍。此外,包括茅苍术在内的根茎类药用植物在栽培中存在严重的自毒和连作障碍问题,生产上常表现为土壤理化性质改变、土传病害加重等[13]。土壤微生物和土壤酶活性均能敏感反映土壤生态系统的变化,表征土壤的健康水平。药用植物微生物的丰度和多样性对其产量和质量有着重要影响,研究药用植物和根际微生物的相互作用关系对药用植物的发展具有重要的实践和指导意义[14]。有关茅苍术根际土壤养分含量、酶活性和微生物群落结构对根腐病发生的影响尚未见报道。因此,本试验以未种植茅苍术土壤、茅苍术健康植株和病株根际土壤为研究对象,对不同土壤的理化性质、酶活性和细菌群落组成进行对比分析,旨在探讨土壤养分、酶活性和细菌群落的变化特征以及它们与根腐病之间的相互关系。
1 材料和方法
1.1 根际土壤样品的采集
土壤样品于2019年7月16日采自茅苍术种植试验地,位于三泉镇马嘴村(29°3′7.7′′N,107°18′26.4′′E),海拔1 130 m。采用多点式取样法,分别采集从未种过茅苍术的土壤(空白对照CZCK,距离茅苍术种植地样点50 m左右)、健康茅苍术根际土壤(CZJ)和根腐病根际土壤(CZB)。除去茅苍术根茎周围表面土壤,拔起整株茅苍术,去除、抖落茅苍术主体土壤,收集须根2 mm范围的土壤,此即为根际土壤。取后将土样直接装自封袋放入冰盒,带回实验室后过2 mm筛,去除土壤中的须根和石砾,充分混匀。一部分用于土壤样品DNA提取,一部分自然风干后,用于测定土壤理化性质和酶活性。
1.2 土壤理化性质测定
参考鲍士旦[15]的方法分别测定土壤pH、有机质、速效氮、速效磷和速效钾含量。
1.3 土壤酶活性测定[15-16]
土壤中脲酶活性采用靛酚蓝比色法测定;蔗糖酶采用3,5-二硝基水杨酸比色法测定;酸性磷酸酶采用磷酸苯二钠比色法测定;过氧化氢酶采用高锰酸钾滴定法;酸性蛋白酶活性测定采用茚三酮比色法测定。
1.4 土壤根际细菌和真菌的高通量测序
土壤DNA使用MPFast@DNA试剂盒(MPBio‑medicals,CA,USA)提取,按照试剂盒使用说明书进行操作,提取不同土壤样品的总DNA。采用北京普析TU-1810紫外分光光度计测定DNA质量与浓度,琼脂糖凝胶电泳检测DNA的完整性和相对浓度。以土壤总DNA为模板,细菌测定中,PCR扩增所用引物采用细菌通用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGA CTACHVGGGTWTCT AAT-3′)对16SrRNA基因序列的V3-V4高变区进行扩增;真菌测定中,PCR扩增所用引物为真菌ITS1引物ITS1F(5’-CTTG‑GTCATT T AGAGGAAGTAA-3’)和ITS2R(5’-GCTG‑C‑GTTCTTCAT‑CGA TGC-3’)对 真 菌ITS1 V3-V4区域进行扩增。PCR扩增产物经2%琼脂糖凝胶电泳检测后,利用凝胶回收试剂盒对目标片段进行回收,将回收产物送至北京百迈克生物科技有限公司,利用Illumina Hiseq 2500平台进行高通量测序和分析。
1.5 数据统计及分析
采用Qiime软件对原始测序数据进行去杂和优化,利用Upares软件对相似度在97%水平以上的有效数据进行生物信息统计分析,并基于细菌的Silva数据库和真菌的Unite数据库统计各样本在不同分类学水平上的群落组成。利用Mothur软件进行土壤微生物α-多样性指数分析,包括ACE指数、Chao1指数、香农指数、辛普森指数、覆盖率等;采用Excel 2010和SPSS18.0分别进行数据整理、作图和统计分析。
2 结果与分析
2.1 土壤养分
茅苍术根际土壤养分变化结果见表1。三种土壤样品在pH、有机质、速效氮、速效磷和速效钾等养分指标均存在显著差异(P<0.05)。与CZCK相比较,种植茅苍术后pH值逐渐降低,土壤逐渐酸化;CZB中有机质和速效磷含量显著增加,而CZJ中有机质和速效磷含量减少;CZJ、CZB中速效磷的含量显著升高(P<0.05);CZJ速效钾含量显著减少(P<0.05),CZB速效钾含量显著增加(P<0.05)。
2.2 土壤酶活性
三种土壤中所测酶活性均存在显著差异(表2)。与CZCK相比,种植茅苍术后土壤脲酶活性显著降低了(P<0.05)。而其余土壤酶活性则由于茅苍术是否感染根腐病而显著不同,与CZCK相比,CZJ过氧化氢酶、酸性磷酸酶和酸性蛋白酶活性显著升高(P<0.05),而蔗糖酶活性显著降低(P<0.05);CZJ过氧化氢酶、酸性磷酸酶和酸性蛋白酶活性显著下降(P<0.05),则蔗糖酶显著升高(P<0.05)。
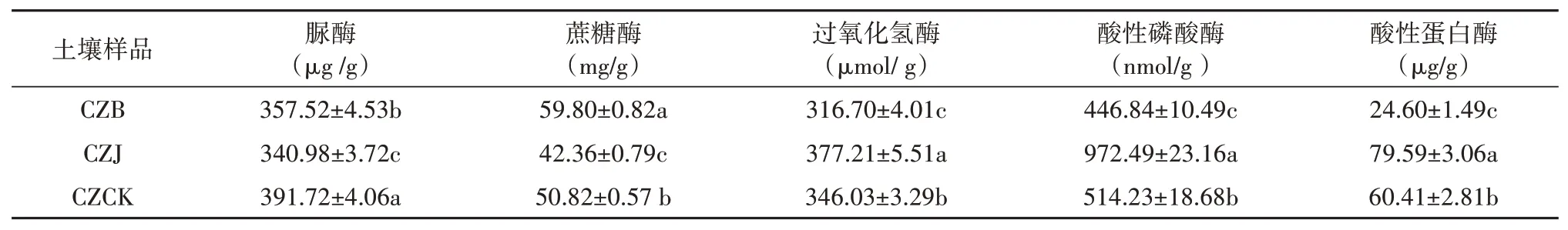
表2 土壤酶活性Table 2 Enzyme activity of soil
2.3 土壤微生物多样性特征
采用Chaol指数、Shannon指数和Simpson指数(表3)表征微生物的丰富度和群落多样性。结果表明:茅苍术健康植株根际土壤细菌OTU为1 529,丰富度最高;根腐病植株根际土壤细菌OTU为1 194,丰富度最低,两者之间的细菌OTU相差21.9%,细菌丰富度差异较大。根际土壤真菌OTU为CZCK(482)>CZJ(383)>CZB(218),表明种植茅苍术后,根际土壤真菌丰富度降低,而病株根际真菌进一步降低。Chaol指数和ACE指数反映样本中微生物丰富度,Shannon指数和Simpson指数反映样本中微生物的多样性。Shannon值越大和Simpson指数值越小,均说明群落多样性越高,反之亦然。本研究结果表明,茅苍术健康植株根际土壤的细菌多样性和丰富度均最高,而茅苍术根腐病植株根际土壤细菌多样性和丰富度均最低,而未种植茅苍术土壤细菌多样性则居于二者之间。真菌的多样性和丰富度均呈现种植茅苍术后降低,病株根际土壤进一步降低的趋势。Cov‑erage指数是指各样本文库的覆盖率,其数值越高,则样本中序列被测出的概率越高。样品的Coverage指数在细菌中大于0.996,在真菌中大于0.9 995,反映本次测序结果代表了样本中微生物的真实情况。

表3 细菌和真菌群落Alpha多样性指数Table 3 Alpha diversity indexesof bacterial and fungicommu‑nity
由不同土壤样品包含共有的微生物群落OTU数目生成的Venn图直观地展示样品相同、各自特有OTU数目以及样品间OTU的重叠情况(图2)。CZB、CZCK和CZJ三组共产生4 141个细菌OTUs,其中,CZJ组样品的OTUs最多,为1 529个;其次为CZCK组样品,为1 418个;CZJ组的最少,为1 194个,说明种植茅苍术后,土壤细菌种类增加,但感染根腐病后则细菌种类减少。三组土壤共有的OTUs数为1 046个,茅苍术健康植株根际土壤有43个特有的OTUs,未种植茅苍术土壤特有31个OTUs,而根腐病株根际土壤仅有23个特有的OTUs。CZB和CZCK共有13个OTUs,CZCK和CZJ共有328个OTUs,CZB和CZJ共有112个OTUs,两种土壤环境中共同含有的OTU数量越多说明两者的微生物群落组成相似度越高,以上数据说明CZCK和CZJ的细菌群落相似度较高。CZB和CZCK的细菌群落相似度较低,即与对照相比,根腐病苍术根际土壤细菌群落组成变化较大。

图1 不同土壤细菌和真菌群落OTUs Venn图(a.细菌;b.真菌)Fig.1 OTUs Venn diagramof soil bacteria and fungicommunities in different soil
CZB、CZCK和CZJ三组共产生652个真菌OTUs。其中,CZCK组样品的OTUs最多,为482个;其次为CZJ组样品,为383个;CZB组的最少,为218个,说明种植茅苍术后,真菌种类均有所下降,但感染根腐病后则真菌种类减少更多。三组土壤共有的OTUs为118个,茅苍术健康植株土壤有137个特有的OTUs,未种植茅苍术土壤特有179个OTUs,而根腐病病株土壤仅有23个特有的OTUs,表明染病植株导致其根际土壤真菌OTUs数目减少。CZB和CZCK共有67个OTUs,CZCK和CZJ共有118个OTUs,CZB和CZJ共有10个OTUs,说明CZB和CZJ的真菌群落相似度较高,CZCK与CZB及CZJ的真菌群落相似度较低,即与CZCK相比,种植茅苍术后根际土壤真菌群落组成变化较大,而病株与健株之间的真菌群落变化相对较小。
2.4 基于门类水平的根际土壤优势微生物的多样性分析
门水平下的细菌和真菌群落结构见表4。三类土壤的细菌有1.84%~4.98%的细菌(others)在GenBank中没有被明确的分类。按照相对丰度从高到低排名前10的优势门类中,门的组成没有变化,但各门的丰富度存在较大变化幅度。相对丰度超过2%的门类一共有10个,分别为变形菌门(Proteo‑bacteria,33.93%~51.98%)、拟杆菌门(Bacteroide‑tes,6.68%~20.82%)、酸 杆 菌 门(Acidobacteria,9.42%~25.27%)、放线菌门(Actinobacteria,3.13%~7.98%)、绿弯菌门(Chloroflexi,2.96%~8.33%)、疣微菌门(Verrucomicrobia,2.87%~6.17%)、芽单胞菌门(Gemmatimonadetes,2.78%~6.35%),厚壁菌门(Firmicutes,0.44%~3.03%)、己科河菌门(Rokubac‑teria,0.58%~2.35%)和髌骨细菌门(Patescibacteria,0.55%~3.59%)。与CZCK相比,CZJ细菌在酸杆菌门、绿弯菌门和髌骨细菌门有较大幅度增加,但在拟杆菌门则有较大幅度的减少。CZB在变形菌门、拟杆菌门和厚壁菌门增加较多。但在其余7个门类丰富度均有较大幅度的降低。
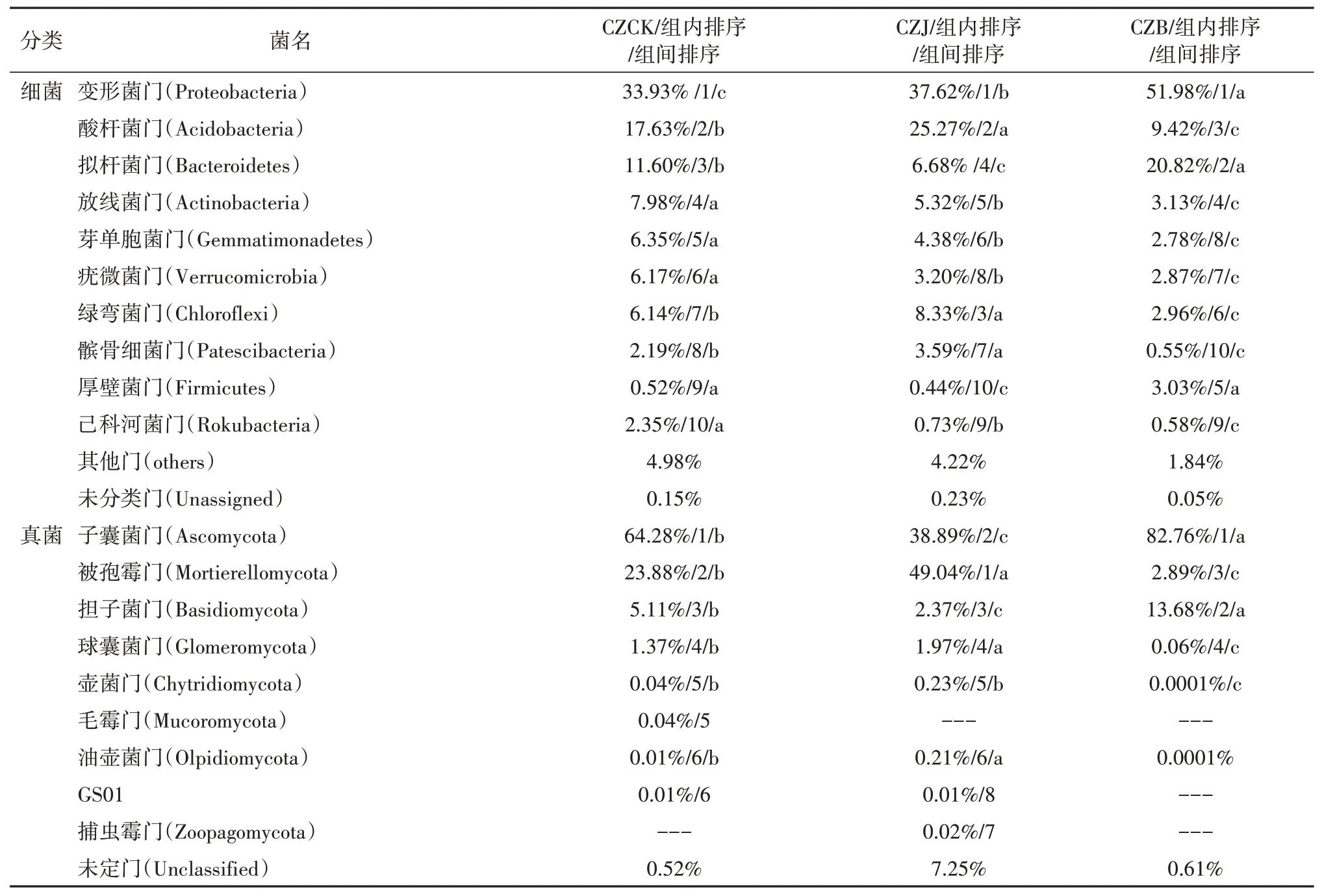
表4 土壤中细菌和真菌的门水平分布Table 4 Phylum distribution of bacteria and fungiin different soil
在三种类型的土壤中,真菌相对丰度以子囊菌门(Ascomycota,38.89%~82.76%)、担子菌门(Basid‑iomycota,2.37%~13.68%)和被孢霉门(Mortierello‑mycota,2.89%~49.04%)为主,均大于1%,而球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)、毛霉门(Mucoromycota)、油壶菌门(Olpidiomycota)、GS01和捕虫霉门(Zoopagomycota)相对丰度低。与CZCK和CZJ相比,CZB在子囊菌门和担子菌门相对丰度增加显著,而被孢霉门、球囊菌门和壶菌门有较大降幅。
2.5 基于属水平的根际土壤优势微生物的多样性分析
在属水平上(表5),未鉴定出的细菌相对丰度为58.78%~74.90%。相对丰度排名前十的细菌而言,3个土壤样品中细菌的组成没有实质性改变,但丰度存在较大幅度变化。具体来说,感病茅苍术根际土壤在金黄杆菌属(Chryseobacterium)、新鞘氨醇杆 菌 属(Novosphingobium)和Burkholderia-Cabal⁃leronia-Paraburkholderia3个属较未种植茅苍术和茅苍术健株土壤有显著的增加,而Bryobacter、uncul⁃tured_bacterium_f_Gemmatimonadaceae、RB41和un⁃cultured_bacterium_f_Microscillaceae则大幅度降低。此外,相较于CZCK,在种植茅苍术后,Pseudomonas相对丰度增加,而病株土壤则出现明显减少的趋势。

表5 土壤中细菌和真菌的属水平分布Table 5 Genusdistribution of bacteria and fungiin different soil
在属水平上,三种类型的土壤中未鉴定出的真菌变化很大,CZCK、CZJ和CZB分别为60.31%、23.20%和7.75%。已鉴定的属中,丰度排名在不同土壤之间也存在较大变化,CZB被孢霉属(Mortierel⁃la)丰度降低,而踝节菌属(Talaromyces)、镰刀菌属(Fusarium)、Tausonia、Tetracladium和木霉属(Trich⁃oderma)增幅较大,青霉属(Penicillium)相较于CZJ丰度也降低。阿太菌属(Athelia)则为病株根际土壤所特有,且丰度排名第5,高达8.63%。值得注意的是,与CZCK相比,致病性较强的镰刀菌属真菌的丰度在种植茅苍术后大幅度增加,健康植株根际土壤增幅达两倍,根腐病病根植株根际土壤增幅达三倍之多。
3 讨论
土壤理化性质与酶活性和植物根际土壤微生物的变化密切相关。土壤酶能够参与土壤各种生物化学反应,与土壤养分转化能力密切相关[16]。一般而言,脲酶主要是促进土壤中氮素的转化;蔗糖酶可以降解蔗糖为果糖和葡萄糖,从而对土壤中碳素营养起着重要的作用;过氧化氢酶可以分解过氧化氢,从而减轻过氧化氢对植物的毒害;磷酸酶主要是促进土壤中磷素的转化;蛋白酶参与土壤中存在的氨基酸、蛋白质等有机氮的转化。本研究中,茅苍术病株根际土壤有机质、速效氮、速效磷和速效钾含量,脲酶和磷酸酶活性显著高于健株,这些结果表明病株根际土壤肥力相较于健株根际土壤肥力显著增加。在西洋参根腐病根际土壤中,有机质、速效氮、速效磷显著增加[17],而在黄连根腐病病株根际土壤速效磷、速效氮、蔗糖酶显著高于健株根际土壤,过氧化氢酶显著低于健株根际土壤[18]。另一方面,病株根际土壤pH和过氧化氢酶则显著低于健株,意味着病株根际土壤面临酸性和高氧化环境双重胁迫。土壤pH调节土壤养分和改变土壤微生物多样性的主要驱动因子[19]。此外,病株土壤酸性磷酸酶和脲酶、蔗糖活性显著下降,在三七根腐病研究中亦有报道[20]。总之,这些结果表明,土壤种植茅苍术与否,健株和病株之间的营养物质,可利用氮、磷、钾等元素,以及土壤酶活性都与根腐病的发生密切相关。
土壤微生物对自然和农业生态系统中植物的营养和健康状况具有重要影响。在植物根腐病的研究中,比较健康植株和病株根际土壤微生物的多样性和丰度组成往往是根腐病防控研究的首要步骤[17]。本研究中,茅苍术感染根腐病后细菌和真菌的多样性和丰度都迅速降低。在植物根腐病研究中,细菌和真菌多样性的变化在不同的研究中结论不尽相同,如西洋参研究发现根腐病导致细菌多样性增加而真菌多样性减少[17],但亦有相反的报道[21],黄连根腐病的研究中则发现细菌多样性显著降低[18],而真菌多样性变化不显著[22]。不一致的研究结果可能和土壤的类型、土壤理化性质、气候条件和耕作制度等因素有关。
本研究采用高通量测序技术对茅苍术根际土壤群落进行了多样性分析。结果表明,茅苍术健康植株和感病植株根际土壤细菌和真菌的群落结构发生了明显的变化。土壤特异微生物如病原微生物和拮抗微生物的变化导致微生物群落不平衡,可能是诱发茅苍术根腐病的主要原因。本研究中,镰
刀菌属(Fusarium)真菌丰度增幅较大,而阿太菌属(Athelia)真菌则为病株根际土壤所特有,且丰度较大。另一方面,假单胞菌属(Pseudomonas)细菌、被孢霉属(Mortierella)和青霉属(Penicilin)真菌丰度却大幅度减少。镰刀菌属(Fusarium)病原菌能引发多数作物根腐病的发生,给作物生产带来严重损失。在人参[23]和三七[24]根腐病土壤中均发现其丰度显著增加,镰刀菌通过抑制植物产生水杨酸的产量从而降低其抗病性,在北苍术[25]接种镰刀菌后,出现根腐病典型症状。阿太菌属(Athelia)同样会诱导植物根腐病的发生,研究发现阿太菌属病原菌诱导了乌头[26]、大豆[27]和豌豆[28]根腐病的发生。被孢霉属(Mortierella)广泛存在于温带和热带农林系统根际土壤中,其可以通过产生抗生素和竞争养分,抑制多种土传病原微生物的生长,对维持微生态平衡具有重要作用[29]。青霉属(Penicilin)常常能够激活多种植物防御信号,从而促进植物生长[30-31]。在人参根腐病的研究中也发现,假单胞菌(Pseudomonas)和被孢霉可以作为优良的根腐病拮抗菌进行使用[32]。
4 结论
本研究中,茅苍术感染根腐病后,根际土壤中的有机质、速效氮、速效磷和速效钾含量,脲酶和磷酸酶活性显著高于健康植株;通过Illumina高通量测序分析明确了根腐病侵染对茅苍术根际土壤真菌和细菌群落结构及多样性的变化,被孢霉属、青霉属和假单胞菌属丰度等病原微生物拮抗菌的减少,为致病菌如镰刀菌属和阿太菌属的生长提供了空间,导致微生态平衡被打破,可能是诱发茅苍术根腐病的主要原因。

