2,4-二硝基氯苯诱导BALB/c小鼠特应性皮炎模型的建立
郑心茹 张晓清 杨 洋 王吉魁 韩 雪
(1.中国医科大学医学基础实验教学中心,沈阳 110122)(2.辽宁电力中心医院普外科,沈阳 110057)
特应性皮炎(atopic dermatitis,AD)是一种常见的瘙痒性炎症性皮肤病,其主要临床表现为皮肤红斑、斑块。在过去的几十年中,特应性皮炎的发病率逐年增加,它已成为全球性的健康问题。AD发病原因复杂,涉及皮肤局部及全身的免疫系统失衡、皮肤屏障功能障碍、环境因素以及神经心理因素等。因此目前特应性皮炎的治疗仍具有一定的难度和挑战性。
小鼠特应性皮炎模型已经成为研究此疾病发病机制、评价研发药物安全性与有效性等生物医药研究不可取代的模式动物。一个成功的动物模型应该具有尽可能多的与人体疾病相似的特点,迄今为止,小鼠的AD模型建立主要有以下几种方法,科学家发现了一类能够自然发展为AD样皮损的近交系小鼠模型,如Nc/Nga小鼠及Flaky Tail小鼠等,这类模型主要与保障皮肤完整性的相关基因缺失或者突变相关;过表达或缺失目的基因的基因工程小鼠模型,这类模型仅是在单一通路上活化或抑制,在疾病表现上与人类AD临床表现仍有一定的出入,并且仍需要特定抗原诱导,这使其在AD研究中的使用受到限制;最常见的一类小鼠模型是通过皮肤局部致敏物质诱导的AD模型,如DNCB、DNFB、TNCB及OXA等,这类半抗原更易穿透皮肤,相比较之下利用致敏物质诱导的方法显得更为经济及方便。
近些年来有文献报道,以半抗原2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)致敏激发小鼠可成功建立特应性皮炎模型。本研究利用DNCB作为致敏原,探讨不同的给药浓度以及给药时间之间的差异,以寻求DNCB诱导AD模型的最适条件,为研究AD的发病机制及治疗方法提供依据和帮助。
1 材料和方法
1.1 实验动物
雌性SPF级BALB/c小鼠(8~10周),由辽宁长生实验动物有限公司提供,实验动物生产许可证号【SCXK(辽)2020-0001】,使用许可证号【SYXK(辽)2018-0008】。饲养于清洁级环境中,环境温度为22 ℃~25 ℃,湿度为50%~65%,利用12 h∶12 h昼夜间断照明,小鼠食用标准饲料,随意饮水进食。小鼠进行一周适应性饲养后再进行实验。
1.2 主要实验试剂与仪器
2,4-二硝基氯苯(DNCB)(Sigma公司);细胞因子ELISA试剂盒(R&D公司);IgE ELISA试剂盒(Invitrogen公司);基质溶液为丙酮和橄榄油4∶1的比例配制而成;酶标仪iMark、RT PCR仪CFX96 TOUCH(伯乐公司)。
1.3 方法
1.3.1动物分组及模型建立:造模前一天对所有小鼠背部皮肤进行剃毛处理,范围约2 cm×4 cm。将实验组小鼠分为A~D 4组,每组6只。初期涂抹200 μL DNCB溶液致敏(基质液丙酮∶橄榄油=4∶1),间隔几天后200 μL DNCB溶液激发,对照组小鼠涂抹相同剂量的基质溶液。末次激发给药后24 h处死小鼠取材。完整摘取小鼠脾及体质量,用电子天平称脾重量,并计算小鼠脾指数【脾指数=脾重量(mg)/体质量(g)】。各组给药浓度及涂抹的时间见表1。

表1 各实验组致敏阶段、激发阶段给药浓度及给药时间
1.3.2皮肤组织炎症评分:小鼠末次给药后,肉眼观察每只小鼠皮肤炎症程度,根据以下几种症状进行判定:水肿、红斑/出血、溃烂/表皮脱落、结痂/干燥。每种症状按照0分(无)、1分(轻度)、2分(中度)和3分(严重)进行评分,最终评分按照几种症状评分相加之和进行统计。
1.3.3皮肤组织病理学检查:取小鼠的背部皮肤组织,加入4%多聚甲醛固定,进行乙醇梯度脱水、二甲苯透明及石蜡包埋,制作4 μm厚切片,分别进行HE染色和甲苯胺蓝染色。显微镜下观察皮损处皮肤组织病理结构及上皮层厚度、细胞水肿、炎细胞以及肥大细胞浸润水平。
1.3.4ELISA法检测小鼠血清IgE水平:小鼠眼球取血,4 ℃放置2 h,10 000 r/min离心10 min。吸取上层血清放入-80 ℃冷冻备用。参照ELISA试剂盒说明书步骤检测小鼠血清中IgE分泌水平。
1.3.5皮肤匀浆液细胞因子表达水平的检测:取小鼠背部皮肤100 mg,加入1 mL PBS匀浆,1 500 r/min离心5 min。吸取匀浆上清液放入-80 ℃冷冻备用。参照ELISA试剂盒说明书检测皮肤匀浆液中IL4、IL5及IL13分泌水平。
1.4 统计学分析

2 结果
2.1 各组小鼠皮肤表现
激发浓度最后一次给药24 h后,选用最具代表性的病变进行评分。空白对照组小鼠背部皮肤外观正常。与空白对照组相比A组可以发现小鼠背部皮肤水肿、有明显红斑、伴有少量溃烂。B组小鼠背部皮肤水肿,伴有部分表皮脱落。C组小鼠背部皮肤轻度水肿。D组小鼠背部皮肤明显出现水肿、红斑、粗糙、溃烂及结痂表现(图1)。与空白对照组相比,A、B及D组皮炎评分显著升高(P<0.01,P<0.001),与A、B及C组相比,D组小鼠皮肤改变严重程度明显升高(P<0.001),C组与空白对照组相比P>0.05,无统计学差异(图2)。

图1 对照组和各模型组小鼠背部皮肤

注:与空白对照组相比,#P<0.01,##P<0.001;各模型组之间相互比较,*P<0.01, **P<0.001
2.2 各组小鼠脾指数比较
处死小鼠后测量小鼠脾及体质量,根据脾指数计算得出以下结果(图3),在模型A组及D组小鼠中可见脾明显增大,脾指数明显升高(P<0.05,P<0.01),差异具有统计学意义。B组及C组脾指数无明显增加(P>0.05),差异无统计学意义,与模型A组相比,模型D组脾指数升高明显(P<0.05)。

注:与空白对照组相比,#P<0.05, ##P<0.01;各模型组之间相互比较,*P<0.05
2.3 各组小鼠皮肤病理学改变
组织病理结果(图4)显示:HE染色可见空白对照组背部皮肤结构完整,无细胞水肿及炎性细胞浸润,模型A组小鼠皮肤棘层增厚,细胞内水肿,炎性细胞浸润。B组小鼠皮肤棘层增厚,少量细胞水肿。C组小鼠皮层未见明显增厚,仅可见少量细胞水肿及炎性细胞浸润。D组小鼠皮肤棘层明显增厚,细胞内水肿明显,大量炎性细胞浸润,皮肤结构不完整。甲苯胺蓝(toluidine blue staining,TB染色)显示肥大细胞浸润水平,空白对照组背部皮肤未见明显肥大细胞浸润,模型组中均出现不同程度的肥大细胞浸润,模型A及D组尤为明显。
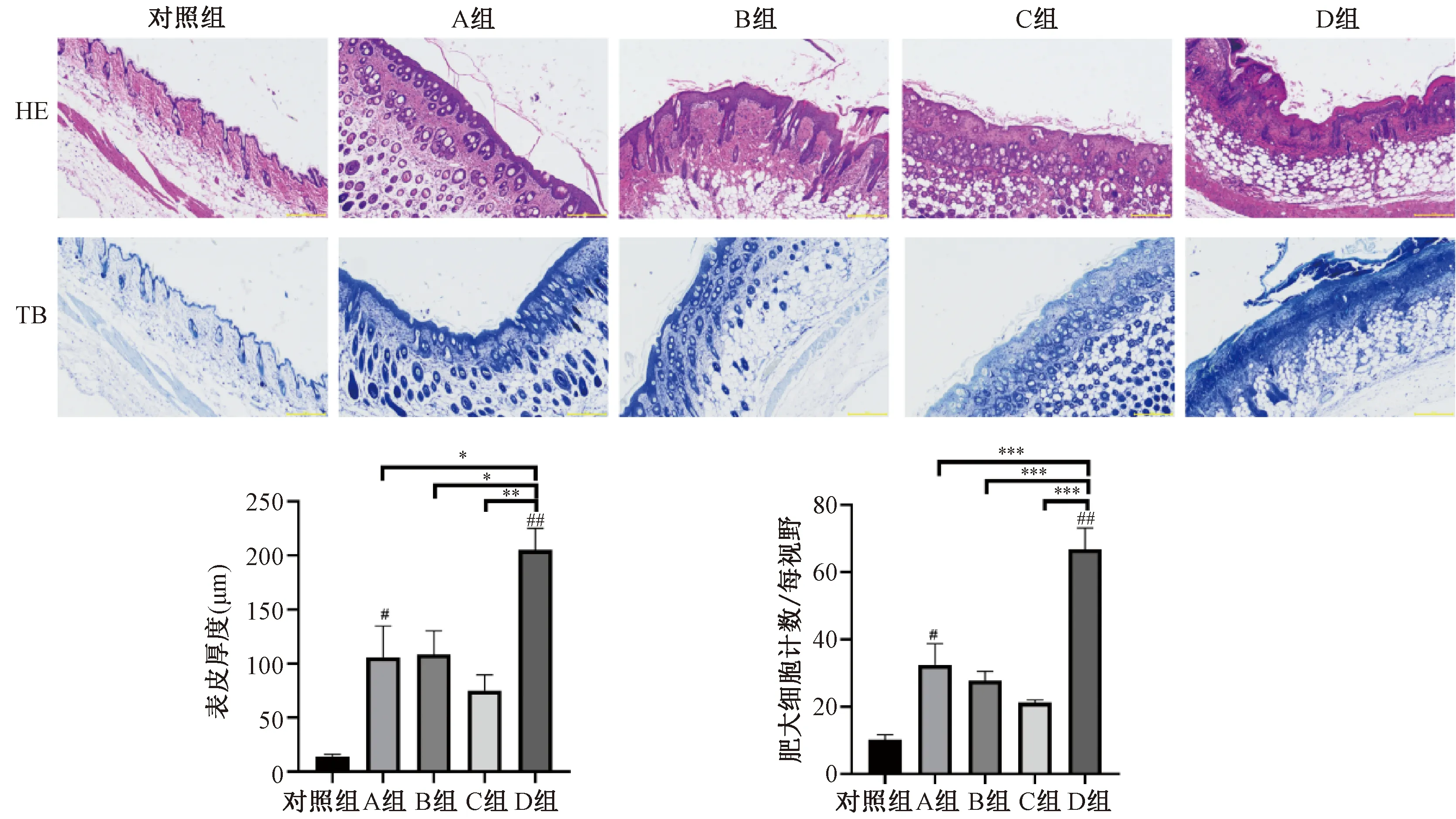
注:与空白对照组相比,#P<0.05, ##P<0.001;各模型组之间相互比较,*P<0.05,**P<0.01,***P<0.001
2.4 各组小鼠血清IgE水平比较
通过ELISA检测了小鼠外周血中总IgE的水平。空白对照组小鼠血清IgE为(68.09±26.59)ng/mL,模型A组小鼠血清总IgE为(242.00±67.77)ng/mL,模型B小鼠血清总IgE为(227.26±26.13)ng/mL,模型C小鼠血清总IgE为(216.56±54.75)ng/mL,模型D小鼠血清总IgE为(337.53±70.19)ng/mL。4组模型组小鼠IgE水平均明显高于空白对照组(P<0.05,P<0.01),模型D组与模型B组及C组相比IgE明显升高(P<0.05,P<0.01),差异有统计学意义(图5)。

注:与空白对照组相比,#P<0.05, ##P<0.01;各模型组之间相互比较,*P<0.05, **P<0.01
2.5 各组小鼠皮肤匀浆液细胞因子表达水平比较
由于AD是一个Th2型为主的免疫反应,在DNCB诱导的小鼠模型中,Th2型细胞因子也会出现明显升高,通过ELISA检测小鼠背部皮肤组织匀浆液中IL-4、IL-5、IL-13的水平,结果发现,IL-4在模型A、B、D组中浓度明显高于空白对照组,IL-5、IL-13在4组模型组中浓度均明显高于空白对照组(P<0.05,P<0.01,P<0.001)。对各模型组间的细胞因子也进行了统计分析(图6)。

注:与空白对照组相比,#P<0.05, ##P<0.01, ###P<0.001;各模型组之间相互比较,*P<0.05, **P<0.01, ***P<0.001
3 讨论
近年来,我国对于化学物质诱导形成特异性皮炎动物模型的已有较多研究报道。在动物模型的建立过程中,不同的动物品系、年龄、体质量和不同处理方式对建模成功与否以及指标检测结果均有不同程度的影响[1]。为研究特异性皮炎的发病机制以及开发新的治疗方法,迫切需要建立成功的AD动物模型,这对得出正确的实验结论与服务更好的临床治疗具有重要意义。
特异性皮炎是一种以瘙痒为特征的慢性炎症性疾病,其发病因素与遗传、皮肤屏障功能障碍、免疫失调、皮肤微生态改变息息相关[2]。其临床表现主要为皮肤出现明显干燥,继而出现红斑、丘疹和水疱为表现,几周后由于瘙痒引起搔抓反应进而皮肤出现糜烂或出现黄色痂皮,炎性反应色素减退现象。在外源性AD的急性期,由于外周血Th2水平增高[3],细胞因子IL-4、IL-5、IL-13表达水平增高,促使B细胞产生过量IgE,嗜酸粒细胞数量也增多,激活Toll样受体,激发机体先天性免疫[4]。
在建立AD模型过程中,通常可使用卡泊三醇[5]、粉尘螨[6]和半抗原等物质进行诱导。本实验中采用DNCB试剂,DNCB具有半抗原属性,当其进入动物体内后,可与上皮蛋白的可溶部分进行共价结合,使其结合为完全抗原。完全抗原使机体产生致敏淋巴细胞。当DNCB再次进入体内时,致敏的淋巴细胞与其接触便会产生过敏反应[7]。此过程在用于检测细胞免疫功能的同时,也可以用来建立AD模型[8]。根据DNCB作用机制,本实验中使用不同浓度的DNCB致敏及激发BALB/c小鼠背部,给药天数也不同,根据小鼠致敏处皮肤炎症程度及相关指标的检测来判定小鼠特异性皮炎模型建立的最佳方法。
在末次激发浓度给药24 h后,观察可见致敏处皮肤出现不同程度的水肿、红斑或出血、溃烂或表皮脱落、结痂或干燥。对比可见模型D组造模效果最好,其余A、B、C 3组效果依次较差。病理学检测结果也与典型的特应性皮炎改变最为接近,相比与其他组改变也最为显著。研究证实大多数AD患者血清IgE浓度高于健康人群,IgE浓度升高程度与AD皮损严重程度和广度基本平行[9]。因此,血清IgE浓度常被作为AD动物模型评价的重要指标之一。本实验通过ELISA法可测定小鼠血清IgE,通过对比可见,4组模型IgE浓度较空白对照组均有升高,模型D组的血清IgE浓度升高也最为明显。由于细胞因子IL-4、IL-5、IL-13浓度也可呈现AD严重程度,本实验也测定了这3项浓度,对比可见模型D组小鼠细胞因子IL-4、IL-5、IL-13表达水平最高[10-11]。
本实验通过给予4组模型不同浓度及给药时间,证实了初期涂抹0.5%DNCB溶液200 μL 3次,后期每次6 d间歇涂抹1%DNCB溶液200 μL,可实现较好的造模效果,与实际AD的疾病特点更为贴近。建立更加合适的动物模型可以帮助临床更充分的认识AD对机体带来的损害,更有利于分析及预测可出现的病理生理反应,对全面认识疾病的本质及对疾病的治疗有重要意义。

