呼伦贝尔地区牛体表寄生蜱中羊种布鲁氏菌的分离与鉴定
黄天鹏,郭旭,孙长云,陈经雕,朝木丽格,武婕,格日勒图✉
1内蒙古农业大学兽医学院,呼和浩特 010018;2额尔古纳市动物疫病预防控制中心,内蒙古额尔古纳市 022250;3广东省疾病预防与控制中心,广州 511430
0 引言
【研究意义】布鲁氏菌病(Brucellosis)是由布鲁氏杆菌感染而引起的人畜共患传染病。布鲁氏菌病的影响及危害较为严重,据报道世界上每年大约新增布鲁氏菌病患者达50万人,被WHO称之为“再度肆虐”的传染病之一[1-2]。目前,全国有23个省份(自治区)均都有人间布鲁氏菌病阳性病例的发生,特别是近期甘肃省兰州市发生了一起大规模人感染布鲁氏菌的事件,内蒙古地区是我国布鲁氏菌病发病流行最为严重的疫区之一[3-5]。随着内蒙古畜牧养殖业规模的形成,促使牛羊养殖模式发生改变,市场上畜产品加工和流通都发生了变化。其中值得一提的是,布鲁氏菌病的宿主范围较为广泛,除了家畜牛、羊以外还包括野生动物、鸟类、鱼类、两栖类甚至人类等[6-9]。更为有趣的是据文献报道,一些吸血节肢动物如蜱虫等也可能成为布鲁氏菌的适宜宿主,增加了布鲁氏菌病在不同动物之间的传播风险[10]。【前人研究进展】布鲁氏菌病的持续存在和死灰复燃的流行态势可能与储存宿主的数量有关,在多种储存宿主中蜱虫也是重要的组成部分。1943年,ZOTOVA等[11]通过体外试验证实,边缘璃眼蜱(Hyalomma marginatum)属于布鲁氏菌病的传播媒介,其可以储存并传播该病原给健康动物。1951年,ZOTOVA等[12]再次通过实验室的检测证实,边缘璃眼蜱(Hyalomma marginatum)可以作为布鲁氏菌的寄生宿主。【本研究切入点】将采集的蜱虫放置在患有布鲁氏菌病的豚鼠体表进行吸血,随后取下饱血蜱虫进行研磨,并将研磨后的组织液注入豚鼠体内,而培养一段时间后的蜱虫研磨成乳浊液,将乳浊液注射给健康的豚鼠,一段时间后检测豚鼠血清学显示布鲁氏菌阳性。该结果表明边缘璃眼蜱和萨氏璃眼蜱可以作为布鲁氏菌的贮存媒介,并存在传播布鲁氏菌病的潜在风险。【拟解决的关键问题】本文为了确定呼伦贝尔地区主要分布的蜱虫种型以及阐明牛体表寄生草原革蜱与牛羊布鲁氏菌病的相关性。通过传统形态学及分子生物学相结合的方法鉴定出该地区的优势蜱种。同时,首次在呼伦贝尔地区蜱体内成功分离到4株布鲁氏菌,其中2株菌为羊种2型,2株菌为羊种3型布鲁氏菌。本试验为内蒙古地区布鲁氏菌的溯源和有效防控提供基础数据。
1 材料与方法
1.1 蜱虫样本的采集
2020年4至5月,在内蒙古呼伦贝尔盟的新巴尔虎右旗选择两个牧区点(包括贝尔苏木和克尔伦苏木)进行蜱虫的采集工作。从40只自然放牧的牛体表共采集191只蜱虫,每头牛体表采集寄生蜱虫3—5只。
1.2 蜱虫传统形态学观察
应用解剖显微镜对采集的蜱虫分别进行形态观察与记录。观察部位主要包括假头基、盾板、须肢、生殖孔、足转节、肛沟和气门板等。参照邓国藩等[13]、HORAK等[14]和巴音查汗等[15]的方法,完成蜱虫的初步鉴定。
1.3 蜱虫的分子生物学鉴定
1.3.1 蜱虫线粒体16S rRNA基因和CO І基因引物的设计 在Genbank数据库中下载不同蜱种类(主要包括草原革蜱、森林革蜱和全沟硬蜱等)的线粒体 16S rRNA基因序列,经过Genetyx生物软件对下载序列进行同源性比对分析,确定16S rRNA基因序列中相对保守的区域。借助Primer 5.0软件,设计16Sf和16Sr引物对。针对蜱虫的CO І基因,参考FOLMER等[16]报道的引物对(包括LCO1490和HCO2198)。上述两对引物委托上海桑尼生物科技有限公司合成,引物序列如下所示(表1)。

表1 蜱线粒体PCR引物设计序列Table 1 Primers sequences for PCR of mitochondria
1.3.2 蜱虫线粒体16S rRNA基因和CO I基因的克隆设定 PCR 反应体系为 50 μL:2×Taq PCR Mix 25 μL,上、下游引物各2 μL,模板DNA 4 μL,剩下用双蒸水补足50 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸 10 min。取10 μL PCR产物进行1.5%琼脂糖凝胶电泳检测结果。将PCR产物送至生工生物工程(上海) 股份有限公司进行基因测序,并将测序结果于NCBI数据库中进行对比分析,用MEGA 7.0软件建立系统发育树。
1.4 布鲁氏菌分离培养与鉴定
1.4.1 布鲁氏菌分离培养 收集虫卵和消毒的蜱虫,放于1.5 mL无菌EP管中,用灭菌研磨棒进行研磨,加200 μL生理盐水进行混匀,将混合液加入到布氏肉汤培养基,放入37℃恒温箱进行培养3 d。将培养物划线于布鲁氏菌选择性培养基中,并放入37℃恒温箱中进行培养,隔日观察,持续培养30 d以上。对分离的菌落进行观察,并对该菌落进行革兰氏染色和柯氏染色。
1.4.2 布鲁氏菌Bcsp31和Omp22检测及序列分析参考QUEIPOORTUNO等[17]针对布鲁氏菌Bcsp31序列设计的特异性引物,和参考TANG等[18]针对布鲁氏菌Omp22序列设计的特异性引物,委托上海桑尼生物科技有限公司合成。引物序列如表2所示。
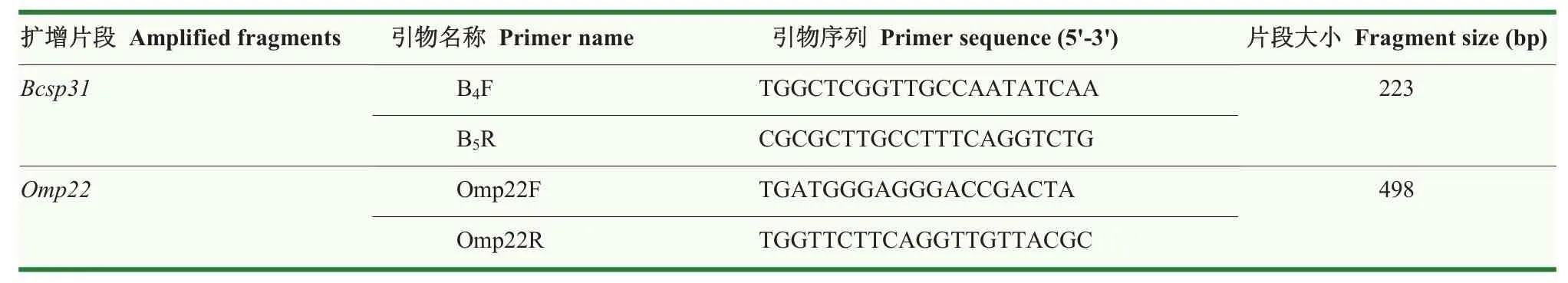
表2 引物序列Table 2 The primer sequence
1.5 布鲁氏菌分型鉴定
1.5.1 布鲁氏菌常规分型鉴定 布鲁氏菌血清凝集、染料抑菌以及噬菌体裂解试验属于布鲁氏菌常规鉴定内容。其中血清凝集试验包括布病阳性血清凝集和A、M和R单因子血清凝集;染料抑菌试验包括碱性复红和硫瑾抑菌试验;噬菌体裂解实验包括 BK2、104Tb 和 Tb 3种噬菌体裂解试验。另外,还有硫化氢产生试验、CO2需要。试验采用双层琼脂平板法,具体操作按照布鲁氏菌常规鉴定标准方法执行。
1.5.2 AMOS-PCR布鲁氏菌分型鉴定 AMOS-PCR引物参照参考文献[19],委托上海桑尼生物科技有限公司合成,引物序列如表3所示;扩增参数为:预变性96 ℃ 5 min,变性96 ℃ 50 s,退火60 ℃ 50 s,延伸72 ℃ 90 s;35个循环;终末延伸72 ℃ 7 min,产物经2.0%的琼脂糖凝胶电泳检测。

表3 AMOS-PCR引物序列Table 3 The primer sequence of AMOS-PCR
2 结果
2.1 蜱虫的形态学鉴定
经解剖显微镜(OLYMPUS SZ51)观察,雄性草原革蜱:虫体为卵圆形、假头短且呈矩形、须肢外缘呈弧形、盾板有较淡的珐琅彩、有缘垛且缘垛上有珐琅斑,还有混杂不均一的银白色花斑、雄蜱腹面无几丁质板、各足基节顺序增大,4对足粗短,第1对足基节内外距近相等,第4对足基节最大且其外距不超过该节后侧缘,肛门后部有明显的肛沟围绕。雌性草原革蜱:虫体为卵圆形、孔区较大、有浓厚的珐琅彩、背缘无几丁质增厚部、其它形状与雄性蜱虫一样(图1)。

图1 草原革蜱的形态学鉴定Fig.1 Morphology of identification D.nuttalli specimens
2.2 草原革蜱的分子生物学鉴定
草原革蜱的 16S rRNA基因序列遗传进化树结果利用 MEGA 7.0软件成功构建了草原革蜱 16S rRNA基因和CO І基因序列的系统进化树。根据草原革蜱16S rRNA基因的系统进化树可见,呼伦贝尔地区采集的蜱虫与 NCBI中已注册的俄罗斯地区、新疆地区和河北地区草原革蜱在同一个进化分支上(图2)。根据草原革蜱CO І基因的系统进化树可见,呼伦贝尔地区采集的蜱虫与NCBI中已注册的内蒙古、新疆、吉林、河北和甘肃地区的草原革蜱在同一进化分支上,且与内蒙古地区草原革蜱进化关系最近,而与其他种属的蜱虫形成分支(图3)。上述结果也表明,本试验采集的蜱虫种型为草原革蜱。

图2 基于16S rRNA 基因序列NJ法种系发育进化树Fig.2 Evolutionary relationships by NJ methods analysis in 16S rRNA gene sequences
2.3 细菌分离培养与形态学观察
成功在饱血蜱虫中分离4株布鲁氏菌,分别命名为 B.melitensis IMHT5、B.melitensis IMHT6、B.melitensis IMHT7、B.melitensis IMHT8。经血平板培养基和布鲁氏菌选择性培养基中培养出针尖状小菌落,菌落呈无色半透明,边缘湿润光滑(图 4)。经革兰氏染色,细菌呈革兰氏阴性短杆菌。经柯氏染色后菌体呈红色(图5)。

图4 分离菌的菌落形态Fig.4 Colony morphology of isolated bacteria
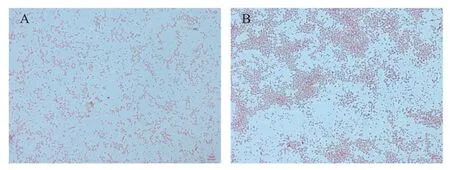
图5 分离菌革兰氏染色及柯氏染色镜检Fig.5 Gram staining and Kirschner staining microscopic examination of isolated bacteria(×100)
2.4 分离菌株的Omp22序列遗传进化树结果
根据布鲁氏菌的Omp22构建的进化树可见,此次分离的4株布鲁氏菌株聚集在同一末端分支上,与新疆的分离菌聚类在同一分支上,而与西班牙、德国和印度的分离株相对距离较远(图6)。

图6 基于布鲁氏菌Omp22构建的系统进化树Fig.6 phylogenetic tree based on Omp22 of Brucella
2.5 牛种布鲁氏菌的AMOS-PCR分型
经AMOS-PCR方法鉴定后发现,分离的4株布鲁氏菌与羊种布鲁氏菌处于同一预期大小,条带大小为731 bp。而且电泳检测结果显示牛种和猪种布鲁氏菌分别在498 bp和285 bp处扩增出预期条带,阴性对照未见扩增结果(图7)。该结果表明分离的4株菌均属于羊种布鲁氏菌。
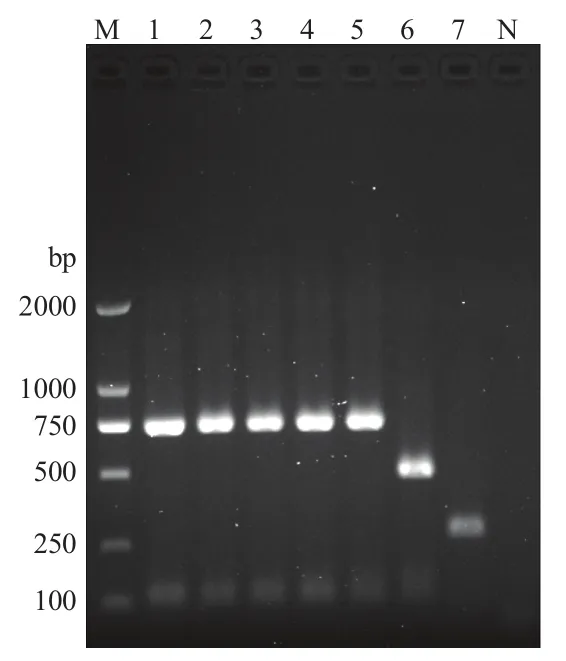
图7 布鲁氏菌 AMOS-PCR鉴定Fig.7 Identificated of Brucella by AMOS-PCR
2.6 布鲁氏菌常规分型试验
经常规分型试验证实2株分离布鲁氏菌为羊种3型菌株(表4),具有以下特征:CO2(-)、H2S(-);单项特异性血清凝集A(+)、M(+)、R(-);染料抑菌硫堇和碱性品红(+)、噬菌体裂解BK2(+)、Tb(-)、104Tb(-)。而其它2株菌为羊种2型布鲁氏菌,具有以下特征:CO2(-)、H2S(-);单项特异性血清凝集 A(+)、M(-)、R(-);染料抑菌硫堇和碱性复红(+)、噬菌体裂解BK2(+)、Tb(-)、104Tb(-)。
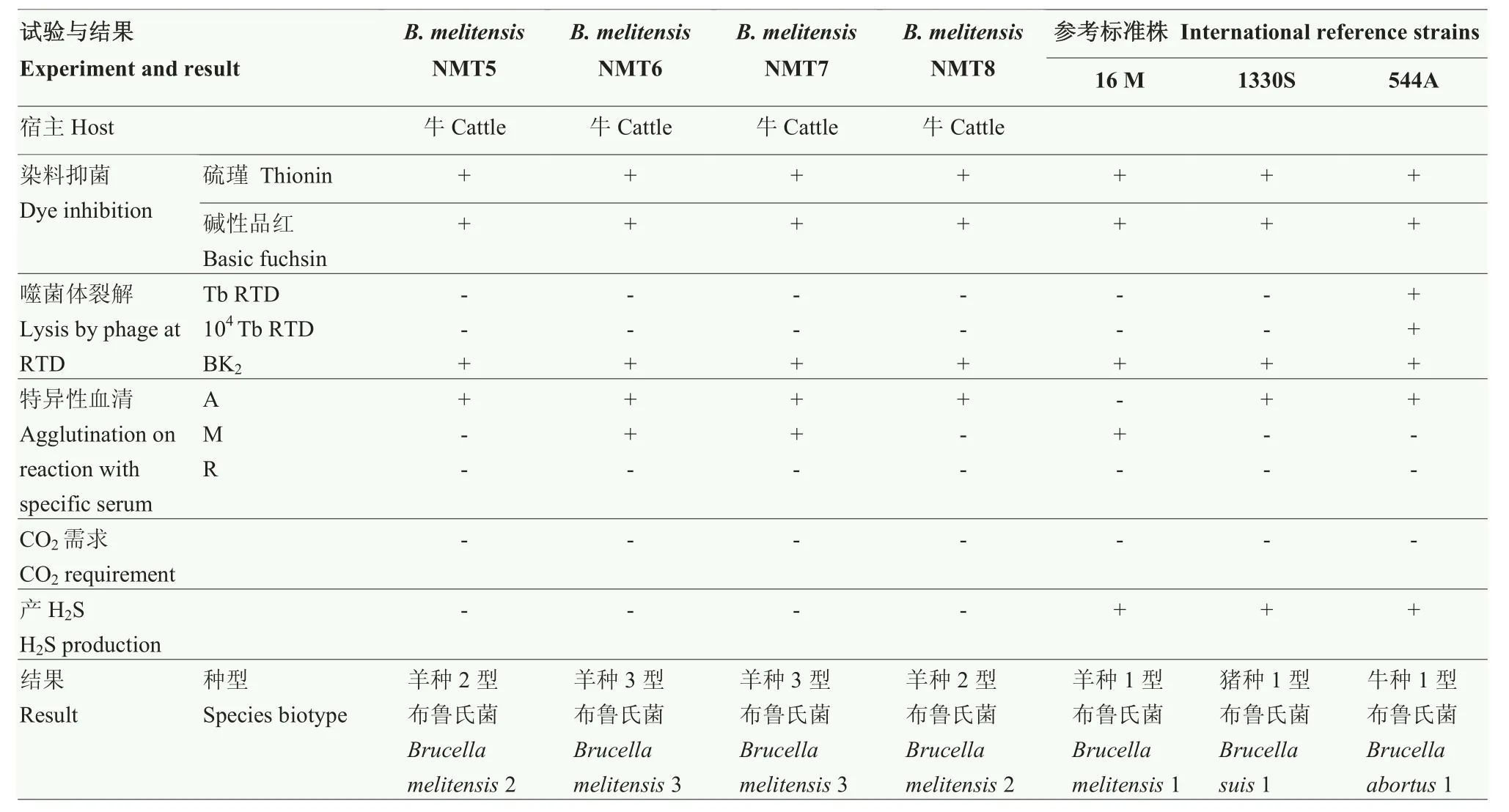
表4 布鲁氏菌分型鉴定Table 4 The results of classification and identification of Brucella
3 讨论
近十年以来,随着气候变化内蒙古各个地区的家畜严重遭受蜱虫攻击。不仅给家畜带来皮肤等组织的直接损伤,而且增加了蜱传疾病发病流行的风险。据王建军等报道[20],认为呼伦贝尔地区仅存在长角血蜱(Haemaphysalis Iongicornis)和全沟硬蜱(Ixodes persuleatus)。在近几年调研结果中发现,呼伦贝尔地区蜱虫种类的变化相当突出,不只存在上述两种硬蜱。2020年4—5月,笔者选择内蒙古呼伦贝尔盟的新巴尔虎右旗两个牧区点进行蜱虫的采集工作。在40只自然放牧的牛体表共采集191只蜱虫,每头牛体表采集寄生蜱虫3—5只。借助解剖镜对采集蜱虫的特殊器官进行观察和图像采集,根据邓国藩等[13]对蜱虫的形态学描述方法进行鉴定,发现在这个季节呼伦贝尔地区活跃的优势蜱种为草原革蜱(D.nuttalli)。这结论与笔者 2015年以来所得到的蜱虫种型信息相吻合[21]。虽然传统形态学方法一直是研究者们对蜱虫种型鉴定工作中采取的主要手段之一,但这种鉴定方法不仅容易受到主观因素的影响,而且对蜱虫的多样性和遗传进化研究存在局限性[22]。基于上述因素考虑,本研究选择了蜱虫遗传保守性基因16S rDNA和CO I基因,进行种型和遗传进化分析[23]。2种靶基因序列经过克隆和测序后再与GenBank上注册的参考序列比对后发现,与已知的草原革蜱相同序列同源性均达到99%以上。用Mega 7.0软件分析根据2种基因绘制出的遗传进化树发现,我们鉴定的草原蜱虫种与俄罗斯地区、新疆地区和河北地区草原革蜱的参考序列处在同一个进化分支上,而与其他种属的蜱虫相距甚远。该结果可能提示,上述3个地区存在同一种草原革蜱来源的祖先蜱虫,这一发现对蜱传疾病的溯源具有重要的意义。
众所周知,布鲁氏菌病是一类古老的人畜共患病。早在1943年,ZOTOVA等[11]阐述通过体外试验的方法证明,边缘璃眼蜱(H.marginatum)可以储存布鲁氏菌并能够将该病原传播给健康动物。最近,HOSSEINI等[24]应用分子生物技术检测到微小牛蜱(Boophilus microplus)中的布鲁氏菌基因产物,认为微小牛蜱在布鲁氏菌病传播过程中可能发挥媒介作用。目前,文献报道的PCR检测布鲁氏菌的方法很多,在布鲁氏菌属的水平检测一般选用单对引物PCR,其中主要是以Bcsp31、Omp22和IS711等作为靶基因设计引物[17-18,25]。本试验在呼伦贝尔地区的牛体表上采集191只蜱虫,以常规方法率先成功分离出4株羊型布鲁氏菌。然后选择了Bcsp31和Omp22对分离菌进行鉴定,而后在种及生物型水平的鉴定则选用多对引物的多重PCR方法,比如AMOS-PCR和多位点串联重复序列分析方法(MLVA)等[26-28]。结果显示4株分离菌与羊源、牛源和猪源布鲁氏菌的Bcsp31同源性为99%以上。而且,根据布鲁氏菌的Omp22构建的进化树中可见,本试验分离的4株布鲁氏菌株聚集在同一末端分支上,与新疆的分离菌聚类在相同分支,而与西班牙、德国和印度等国外的布鲁氏菌分离株也不甚远。该结果表明,4株布鲁氏菌分离株均属于相同布鲁氏菌属成员,均为我国国内主要流行菌株,但并非国外输入菌株。
AMOS-PCR是布鲁氏菌种型鉴定的常规方法之一,文献报道该方法可鉴定羊种1、2、3型布鲁氏菌,牛种1、2、4型布鲁氏菌,猪种1型布鲁氏菌和绵羊附睾种布鲁氏菌[29]。本试验经 AMOS-PCR方法鉴定了4株分离菌的生物型,并与常规分型鉴定试验结果进行了比较。结果发现4株布鲁氏菌分离株分别鉴定为2株符合羊种3型布鲁氏菌和2株符合羊种2型布鲁氏菌特点,2种方法鉴定结果符合率为100%。本试验成功分离到的4株布鲁氏菌来源于3头牛体表的寄生蜱体内,其中两株布鲁氏菌(B.melitensis NMT6和B.melitensis NMT7)来源于同一头牛体表的寄生蜱体内,其余两株布鲁氏菌(B.melitensis NMT5和 B.melitensis NMT8)分别来源于不同的牛体表的寄生蜱体内。该试验结果提示,在牧区流行的羊种3型布鲁氏菌和羊种2型布鲁氏菌不仅可以在牛羊等家畜体内存在[30],而且可以在草原革蜱体内存活。这对动物布鲁氏菌的溯源研究具有重要意义。
4 结论
通过传统形态学和分子生物学相结合的办法,鉴定出呼伦贝尔地区4—5月优势蜱种为草原革蜱。并首次从牛体表采集的草原革蜱样本中分离到4株羊种布鲁氏菌。为内蒙古地区布鲁氏菌病传播媒介调查以及溯源研究提供科学的基础数据。

