4种脾虚造模法的横向对比研究*
王启航,陆瑞敏,陈萌,张冬梅
(1.北京中医药大学中医学院,北京 100029;2.北京中医药大学东直门医院,北京 100700)
随着社会的发展,人们压力增大、饮食不规律等问题日益增多,结合暖期多虚寒的疾病谱特征[1],致当代脾胃疾病多发。而脾气的健运与否也很大程度决定了人体健康与否。在越来越重视“治未病”的今天,展开脾胃生理功能、脾虚发生机制的研究,无疑有着重要的时代意义。中医造模实验是一种现代形式的“比类取象”,它使整个生物科学成为了中医学发展的基础[2],研究脾虚动物模型是研究脾胃理论的理想切入点。有关脾虚模型的复制方法逐渐多样化、复杂化[3],但是缺少模型间的横向对比及导致脾虚的病因探讨。有鉴于此,笔者复制了苦寒泻下、饮食失节、劳倦过度、利血平注射4种经典脾虚模型,并从宏观、免疫、消化、血液、线粒体功能角度进行系统评价以比较模型损伤程度及适用性,希冀为脾虚的发生机制提供研究价值。
1 材料与方法
1.1 动物 SPF级雄性昆明小鼠100只,体质量18~22 g,购于斯贝福(北京)生物技术有限公司,许可证编号SYXK2019-0010。常规饲养于北京中医药大学SPF级动物房。
1.2 药物与试剂 番泻叶配方颗粒150 g,北京康仁堂药业有限公司生产,购于北京中医药大学东直门医院;利血平粉末(RH45599-1)购于北京百诺威生物科技有限公司;冰乙酸(20180911)购于天津市富宇精细化工有限公司;血清D-木糖检测试剂盒(20180504)购于南京建成生物工程研究所;Trizol(A8404-1)购于 Invitrogen公司;SYBR Premix EX TaqII Kit(AK2901)、Prime Script TMR Treagent Kit(AK2003)购于 TaKaRa公司;DEPCH2O(20190811)、磷酸盐缓冲液(20190522)、PCR 引物(20190818)、TIA Namp Genomic DNA Kit(201900526)、DNaseI(20190928)、Promega(M610A)购于北京晶莱生物有限公司。
1.3 仪器设备 DK-8D型电热恒温水浴锅(上海一恒科技有限公司)、MB10Kpw型电子天平(上海海康电子仪器厂)、BC-2300型血液分析仪(深圳迈瑞生物医疗电子股份有限公司)、精密电子天平(JA2003 SHP07003,上海恒平科学仪器有限公司)、TU-1800S型紫外分光光度计、Scanspeed1730R型低温离心机(Labogene公司)、Rotor-Gene 3000 Realtime PCR仪(Orbett Research公司)、EDTA抗凝血管(博士德生物工程有限公司)。
1.4 模型制备 将小鼠适应性喂养3 d后,按如下分组,见表1。

表1 各组小鼠造模方法Tab.1 Modeling methods of mice in each group
记录各组小鼠进食量、体质量。造模持续10 d后,随机取10只小鼠做相关指标检测,10只小鼠自然恢复10 d,观察各组宏观指标的稳定性。
1.5 宏观指标评价 记录各组小鼠进食量、体质量变化,观察小鼠是否出现懒动、拱背、扎堆、眯眼、毛色枯黄、毛色稀少、耳尾色白、腹面被毛憔悴、抓取无力挣扎、受惊动时无神、软便、便溏、泄泻、受激排便率增高等症状,出现某一症状记1分,对各组小鼠得分进行统计学分析,比较宏观体征得分[5]。
1.6 宏观指标稳定性评价 分别记录脾虚模型造模结束后和自然恢复10 d后各组小鼠体质量、进食量变化。然后,采用绑尾迫使小鼠强制游泳至力竭,游泳水温为22℃,小鼠游泳以连续“冒泡”5次为力竭标志,记录游泳时长。
1.7 理化指标检测 造模结束后,小鼠摘眼球取血,血液分析仪检测红细胞(RBC)、白细胞(WBC)、血红蛋白(HGB)。4℃静置2 h后,以5 000 r/min,4℃离心5 min,离心半径18 cm,取上清,比色法测定血清D-木糖水平,操作按试剂盒说明进行。碘-淀粉酶比色法测定小鼠血清淀粉酶活性。记录胸腺、脾脏质量,计算胸腺、脾脏指数。脏器指数=脏器质量(mg)/体质量(g)。
1.8 mtDNA拷贝数及线粒体自噬相关蛋白Pink1、Parkin mRNA的表达 采用实时荧光定量PCR法进行检测。取1 mm3大小的新鲜肝组织若干块,按TIA Namp Genomic DNA Kit说明书提取总DNA。根据SYBR Premix EX TaqII Kit说明书进行扩增,扩增程序为:95 ℃×60 s,(95 ℃×15 s,60 ℃×60 s)×40 个循环,以 β-actin 为内参照,所得 CT 值按照 2-ΔΔCt的方法进行均一化处理后再进行统计分析,得出相对mtDNA拷贝数。引物序列如下,见表2。

表2 ND1 及 β-actin 引物序列(3′-5′)Tab.2 ND1 and β-actin primer sequences(3′-5′)
取适量组织,按Total RNA Extraction Kit说明书提取总RNA,DNaseI去基因组并用紫外分光光度仪检测纯度与完整性。根据Prime Script TMR Treagent Kit说明书进行反转录,cDNA-20℃保存。按照mRNA/lncRNA qPCR Kit说明书进行扩增,扩增程序为:95 ℃×60 s,(95 ℃×10 s,58℃×30 s)×39 个循环,以β-actin为内参照,将所得CT值按照2-ΔΔCt的方法进行均一化处理再进行统计分析,得出线粒体自噬相关蛋白Pink1、Parkin mRNA水平。引物序列如下,见表3。

表3 Pink1、Parkin 及内参引物序列(3′-5′)Tab.3 Pink1,Parkin,and the internal reference primer sequences(3′-5′)
1.9 统计学方法 实验数据用SPSS 24.0软件处理。计量资料以均值±标准差(±s)表示,数据正态且方差齐多组间比较采用单因素方差分析,组间两两比较采用LSD法,非正态或方差不齐组间比较采用非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠宏观指标比较 与空白对照组相比,各组宏观体征均有显著变化(P<0.05)。其中,利血平组宏观体征得分最高,饮食失节组最低。与空白对照组相比,各造模组小鼠造模后体质量与进食量平均值均有所下降(P<0.05),差异具有统计学意义,以利血平组差异明显。综上利血平组小鼠脾虚症状表现、进食量与体质量变化最为显著,饮食不节法因造模方法冲突故不参与统计。见表4。
表4 脾虚小鼠宏观指标比较(±s)Tab.4 Comparison of macroscopic indicators in spleen deficiency mice(±s)
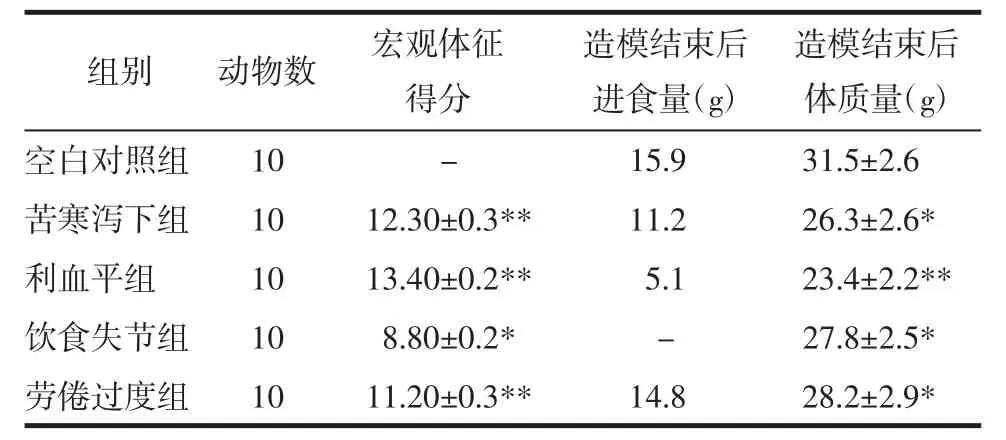
表4 脾虚小鼠宏观指标比较(±s)Tab.4 Comparison of macroscopic indicators in spleen deficiency mice(±s)
注:与空白对照组比较,*P<0.05,**P<0.01。
造模结束后体质量(g)空白对照组 10 - 15.9 31.5±2.6苦寒泻下组 10 12.30±0.3** 11.2 26.3±2.6*利血平组 10 13.40±0.2** 5.1 23.4±2.2**饮食失节组 10 8.80±0.2* - 27.8±2.5*劳倦过度组 10 11.20±0.3** 14.8 28.2±2.9*组别 动物数 宏观体征得分造模结束后进食量(g)
2.2 各组小鼠宏观指标稳定性比较 自然恢复10 d后,与空白对照组相比,苦寒泻下组、利血平组、饮食失节组体质量仍未达到正常水平(P<0.05),差异具有统计学意义,劳倦过度组体质量水平无统计学差异(P>0.05);各模型组小鼠进食量恢复并超出空白对照组水平,进食量发生“报复式”增长。其中,利血平组增长最多,苦寒泻下组增长最少;造模结束后,苦寒泻下组、饮食失节组、劳倦过度组小鼠游泳至力竭的时长均降低(P<0.05),以利血平组与苦寒泻下组差异显著(P<0.01),差异均具有统计学意义。自然恢复10 d后,苦寒泻下组与饮食失节组小鼠仍有低于对照组的趋势(P<0.05),差异具有统计学意义。综上苦寒泻下组与饮食失节组小鼠症状更稳定,饮食不节组与劳倦过度组因造模方法冲突故不参与统计。见表5。
表5 脾虚小鼠宏观指标稳定性比较(±s)Tab.5 Comparison of macroscopic index stability in spleen deficiency mice(±s)

表5 脾虚小鼠宏观指标稳定性比较(±s)Tab.5 Comparison of macroscopic index stability in spleen deficiency mice(±s)
注:与空白对照组比较,*P<0.05,**P<0.01。
自然恢复10 d后游泳时长(min)空白对照组 10 30.6±2.4 35.7±2.4 16.4 17.3 9.2±2.4 11.3±4.3苦寒泻下组 10 24.6±3.6* 30.6±2.4* 10.3 17.9 4.1±1.3** 7.9±3.4*利血平组 10 22.7±2.2** 29.9±3.2* 5.3 18.7 14.5±3.1** 11.5±4.6饮食失节组 10 25.2±3.0* 29.6±3.5* - - 6.1±2.8* 8.9±3.6*劳倦过度组 10 26.9±2.1* 34.3±2.6 16.2 18.6 - -组别 动物数造模结束后体质量(g)自然恢复10 d后体质量(g)造模结束后进食量(g)自然恢复10 d后进食量(g)游泳至力竭时长(min)
2.3 各组小鼠理化指标比较 与空白对照组相比,各模型组小鼠血清D-木糖水平低于正常组(P<0.05),说明各组造模成功;劳倦过度组胸腺指数下降最显著(P<0.05),其次是利血平组(P<0.05),苦寒泻下组变化最小(P<0.05),差异均具有统计学意义;利血平组脾脏指数下降最显著(P<0.05),苦寒泻下组次之(P<0.05),饮食失节组有所上升(P<0.01),差异均具有统计学意义;血清淀粉酶活性均有所降低,变化以利血平组最为显著(P<0.01);利血平组 RBC 下降最为明显(P<0.01),其次为苦寒泻下组(P<0.01),劳倦过度组有所上升(P<0.05),差异均具有统计学意义;利血平组 WBC 下降最明显(P<0.05),其次为苦寒泻下组(P<0.05),差异均具有统计学意义;利血平组HGB下降最为显著(P<0.05),其次为苦寒泻下组(P<0.05),劳倦过度组有所上升(P<0.01),差异均具有统计学意义。综上,利血平组小鼠理化指标变化明显,其次为苦寒泻下组。见表6。
表6 脾虚小鼠理化指标比较(±s)Tab.6 Comparison of physical and chemical indexes of spleen deficiency mice(±s)

表6 脾虚小鼠理化指标比较(±s)Tab.6 Comparison of physical and chemical indexes of spleen deficiency mice(±s)
注:与空白对照组比较,*P<0.05,**P<0.01。
外周血指标RBC(×1012/L) WBC(×109/L) HGB(g/L)空白对照组 10 5.14±0.12 2.98±0.27 4.96±0.19 718.94±15.49 7.37±0.59 6.42±0.93 139.47±13.74苦寒泻下组 10 2.84±0.22** 2.72±0.34* 4.39±0.57* 633.28±17.58* 6.23±1.08* 5.73±1.29* 128.16±10.42*利血平组 10 2.12±0.26** 2.63±0.47* 4.17±0.62* 603.19±19.73** 5.93±1.16** 5.13±1.67* 120.95±11.73*饮食失节组 10 3.79±0.19* 2.80±0.41 5.87±0.51** 622.17±20.15** 6.43±0.93 6.23±0.85 126.45±14.94劳倦过度组 10 3.93±0.16* 2.54±0.33* 4.82±0.83 667.87±17.94 8.94±0.97* 5.43±1.36 148.74±12.69**组别 动物数 血清D-木糖水平(Inmol/L)胸腺指数(mg/g)脾脏指数(mg/g)血清淀粉酶(U/100 mL)
2.4 各组小鼠mtDNA拷贝数、Pink1、Parkin mRNA表达水平比较 与空白对照组比较,饮食失节组mtDNA 拷贝数下降最为显著(P<0.01),其次苦寒泻下组(P<0.05),劳倦过度组下降较少(P<0.05),差异均具有统计学意义;苦寒泻下组Pink1mRNA转录水平降低最为显著(P<0.01),其次饮食失节组(P<0.05),差异均具有统计学意义;利血平组Parkin mRNA转录水平上升(P<0.05),差异具有统计学意义,其他组差异无统计学意义(P>0.05)。综上,饮食失节与苦寒泻下组小鼠线粒体功能改变明显。见表7。
表7 脾虚小鼠mtDNA相对拷贝数比较(±s)Tab.7 Comparative copy number comparison of mtDNA in spleen deficient mice(±s)

表7 脾虚小鼠mtDNA相对拷贝数比较(±s)Tab.7 Comparative copy number comparison of mtDNA in spleen deficient mice(±s)
注:与空白对照组比较,*P<0.05,**P<0.01。
组别 动物数mtDNA相对拷贝数 Pink1 mRNA Parkin mRNA空白对照组 10 1.140±0.120 1.024±0.068 1.049±0.156苦寒泻下组 10 0.840±0.220* 0.612±0.083**1.028±0.172利血平组 10 1.120±0.260 0.973±0.126 1.319±0.165*饮食失节组 10 0.790±0.190** 0.893±0.097*1.057±0.176劳倦过度组 10 0.930±0.160* 0.997±0.164 1.059±0.247
3 讨论
中医在临床诊断中常常是司外揣内的,常以乏力懒言,语声低微,四肢沉重,形体消瘦,食欲不振,便溏或泄泻等表现作为衡量患者是否是脾虚证的重要参考,并以症状的突出与否来判断脾虚的轻重及亚型,故在中医的实验研究中,宏观指标也是动物模型评价的重要组成部分[6]。4种造模法都能成功复制脾虚症状,但是各个模型的症状轻重存在差异,利血平模型组症状重且覆盖全面,但自然恢复快,模型稳定性差;苦寒泻下组症状表现方面次之,但模型稳定性好;饮食不节模型组症状覆盖同样较为全面,症状稳定但较为轻浅,可造模至20 d,劳倦过度模型组的脾虚症状轻浅且覆盖不全面。
脾胃为气血生化之源,脾的运化作用于血液质量息息相关[7],故脾虚证动物模型会出现血液质量改变。近年来对脾虚模型评价的血液指标主要包括:WBC、淋巴细胞、红细胞比容、RBC平均血红蛋白量等。脾主运化,脾虚证的主要表现之一为消化系统的功能低下,其中较为公认的是D-木糖代谢水平,该指标可以衡量模型的吸收功能[8]。此外,血清淀粉酶也与消化功能关系密切。“四季脾旺不受邪”,脾气健运与否很大程度上决定了人体是否健康,脾与人体免疫功能密切相关[9],脾脏指数与胸腺指数的降低不仅直接表明脾家损伤模型小鼠的免疫功能降低,也间接说明了其淋巴细胞与巨噬细胞产生数目的减少。实验表明,各模型组小鼠血清D-木糖水平和血清淀粉酶活性均下降,说明造模成功,脾虚小鼠存在消化功能低下的表现,以利血平与饮食失节组小鼠消化系统功能障碍突出。利血平组与苦寒泻下组小鼠外周血的RBC、WBC、HGB显著下降,说明利血平造模法和苦寒泻下造模法对小鼠的血液质量影响广泛,而劳倦过度造模法对小鼠血液质量的影响较小。利血平组和苦寒泻下组小鼠脾脏指数和胸腺指数均下降非常显著,说明利血平造模法和苦寒泻下造模法对小鼠的细胞免疫和体液免疫功能均有显著影响。饮食失节组小鼠脾脏指数上升,可能是脾家损伤小鼠表现出的病理性的脾肿大。劳倦过度组小鼠则只有胸腺指显著下降,说明其细胞免疫功能降低。饮食失节造模法和劳倦过度造模法只对动物的部分免疫功能有影响。
脾主运化为生命活动提供能量,中医脾的状态影响生命活动状态。而线粒体为细胞生命活动提供能量,这与脾的功能在某种程度上是相似的。有学者[10]认为脾主运化就是营养物质在线粒体内进行的一系列氧化代谢所代表的“内运化”过程。线粒体功能与mtDNA的数量密切相关,mtDNA下降超过阈值则发生线粒体功能障碍,介导线粒体自噬或诱发细胞凋亡[11]。Pink1、Parkin是介导并启动线粒体自噬的关键蛋白[12]。实验结果显示,除利血平组外,其他3种模型小鼠的mtDNA相对拷贝数下降,说明模型小鼠存在线粒体功能异常,以饮食失节组小鼠线粒体损伤程度最重。在线粒体损伤的进程中,mtDNA相对拷贝数会先升高再降低,利血平组小鼠的mtDNA相对拷贝数变化不显著,可能是由于其线粒体损伤程度较轻,处于mtDNA相对拷贝数变化的中间阶段。除劳倦过度组和利血平组外,其他两种模型小鼠的Pink1 mRNA水平下降,表明脾虚损伤小鼠存在线粒体自噬功能的抑制,损伤的线粒体无法被及时清除,线粒体疾病和细胞凋亡发生的概率增加。与对照组相比,除利血平组外,其他3种模型小鼠的Parkin mRNA水平差异无统计学意义,推测脾虚损伤主要影响Pink1 mRNA水平,因为Pink1位于Parkin的上游,推测随着脾虚损伤加重,模型小鼠的Parkin mRNA水平也将受到影响。与对照组相比,利血平组Parkin mRNA水平上升,可能是因为利血平组小鼠存在线粒体损伤,但是线粒体自噬功能未受到影响,Parkin mRNA过表达以清除损伤线粒体,维持细胞稳态。
综上,4种造模方法都可以在不同程度上造成脾虚损伤。脾虚的形成可能是饮食失节、过食寒凉、劳倦过度等多种复合因素导致的胃肠道消化吸收异常,进而影响到人体循环系统、免疫系统,甚至线粒体异常,但是这些联系的具体机制尚未阐明,有待于进一步的研究。

