巨龙竹实生苗对干旱胁迫的形态及生理响应
朱书红 赵秀婷 刘蔚漪 辉朝茂
(西南林业大学林学院/竹藤科学研究院/丛生竹工程技术研究中心 昆明 650224)
巨龙竹(Dendrocalamus sinicus) 是禾本科竹亚科牡竹属的大型丛生竹种,主要分布于云南南部和西南部[1],是目前世界上所知秆型最高大的竹种,具有巨大的开发价值和利用前景[2]。目前,国内外对巨龙竹的研究多集中在培育[3]和竹材性质[4]等方面,对其抗旱性方面的研究较少,开展巨龙竹的抗旱性研究对巨龙竹的引种和推广具有十分重要的意义。
干旱是自然界常见的环境胁迫之一[5],它会使植物体丧失水分,从而影响植物的生长发育[6]。通常情况下,植物会通过各种生理活动以及生化反应来抵御干旱带来的伤害,从而增强植株的抗旱能力[7]。以超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX) 等为代表的抗氧化酶类组成的酶系统在植物抗旱中扮演着重要角色,可以清除干旱带来的大量活性氧,避免膜脂过氧化,使各种生理代谢活动正常进行[8]。目前,国内外已经开展了许多关于植物抗旱性方面的研究,并取得较多成果[9-10]。研究发现,植物的水分生理指标、代谢指标、酶和渗透调节物等都可以用来评价植物的抗旱性[11-12]。周少卿等[13]通过对4 种珍稀竹种的抗旱性研究发现,维持竹种正常生长的最低土壤含水量为6%。应叶青等[14]研究了干旱胁迫对毛竹的影响,发现干旱胁迫对毛竹的各项生理指标都会造成一定的影响,抑制了毛竹生长。但由于干旱胁迫对植物影响的复杂性,还需要采用隶属函数法对各项生理指标进行综合评价,避免个别指标的片面性[15]。本研究以分别在孟连(源生地) 和昆明(引种地) 两地育苗的巨龙竹实生苗为研究对象,分析干旱胁迫对其生理特性的影响,探讨巨龙竹实生苗对干旱胁迫的适应性及耐受性,为巨龙竹的引种和育苗提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为同一批种子分别在昆明和孟连两地培育的2 年生巨龙竹实生苗(以下分别简称为“昆明苗”和“孟连苗”)。孟连培育的巨龙竹实生苗总体比较高大,高2~3 m,枝干直径约2~3 cm;叶剑形,长13~15 cm,宽5~6 cm。昆明培育的巨龙竹实生苗比较矮小,高0.75~0.85 m,枝干直径约1.0~1.5 cm;叶剑形,长9~10 cm,宽3~4 cm。
1.2 试验方法
2021 年7 月上旬,选取在昆明和孟连两地培育的长势均匀的2 年生巨龙竹实生苗各20 盆,移至塑料大棚中,盆栽土壤为腐殖质与红壤以3 ∶7配制而成。试验根据土壤含水量确定干旱胁迫强度,设置了5 个持续胁迫水平[16](表1),试验期间用土壤水分测定仪确定土壤水含量。

表1 干旱胁迫处理水平Tab.1 Treated levels of drought stress
试验于2021 年10 月2 日开始,于试验开始前1 d 浇透水,之后不再浇灌。在干旱胁迫第0、3、6、9、12 d 上午9:00 取新鲜的成熟叶片,共取样5 次,重复3 次,用于各项生理生化指标的测定。
1.3 指标测定
在干旱胁迫下,植物会在外在形态上发生改变,主要表现为叶片卷缩或出现落叶等。因此形态学指标的观测主要是叶片形态指标观测,即主要观察叶片的生长势和叶片状况。根据叶片每天的生长表现,记录形态指标。
叶片含水量采用烘干法测定[17],叶片细胞膜透性采用电导率仪法测定[18],可溶性蛋白含量采用考马斯亮蓝G-250 染色法测定[11],叶绿素含量采用丙酮提取法测定[5],丙二醛(MDA) 含量采用硫代巴比妥酸法测定[8],超氧化物歧化酶(SOD) 活性采用氮蓝四唑法测定[15],抗坏血酸过氧化物酶(APX) 活性和过氧化氢酶(CAT)活性采用紫外吸收法测定[19]。
1.4 抗旱性综合评价方法
用隶属函数法对孟连苗和昆明苗的抗旱性进行综合评价。隶属函数值计算公式如下:
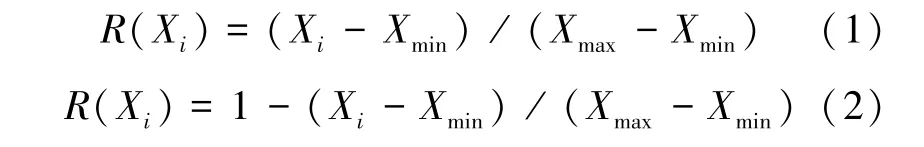
式 (1) 和式 (2) 中:Xi为指标测定值,Xmax表示孟连苗和昆明苗第i个指标的最大值,Xmin表示第i个指标的最小值。如果所测指标与竹苗的耐旱性呈正相关关系,用式(1) 计算;如果所测指标与竹苗的耐旱性呈负相关关系,则用式(2) 计算。对竹苗各项生理指标的抗旱隶属值进行累加,并计算出平均值,平均值越大,表示其抗旱性越强[20]。
1.5 数据处理
数据采用Excel 2003 进行数据分析与制图,并采用SPSS 25.0 软件进行方差分析。
2 结果与分析
2.1 干旱胁迫下巨龙竹实生苗形态指标的变化
在持续干旱胁迫下,巨龙竹实生苗地上部分的形态变化情况见表2。干旱胁迫下孟连苗和昆明苗的形态变化差异较大,主要体现在叶片颜色、卷曲、干枯的程度不同。

表2 干旱胁迫下巨龙竹实生苗叶片形态变化Tab.2 The leaf morphological changes of D. sinicus seedlings under drought stress
2.2 干旱胁迫对巨龙竹实生苗叶片相对含水量的影响
叶片相对含水量可以直接反映出植物在干旱环境下水分的亏缺程度[5],常用来衡量植物的保水能力[21]。由图1 可知,孟连苗和昆明苗的叶片相对含水量随干旱胁迫强度的增加,呈先升高后下降的变化趋势,但两者的变化趋势不同。孟连苗的叶片含水量在前期上升较快,在第2 胁迫水平到达峰值后开始急剧下降,且下降幅度较大;昆明苗在前3个胁迫水平上呈缓慢上升趋势,在第4 胁迫水平上快速上升后到达峰值,然后开始下降,下降幅度比孟连苗小,说明其持水能力较强。
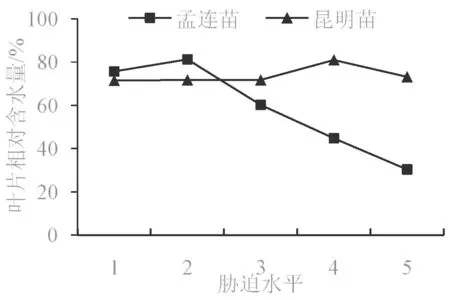
图1 干旱胁迫下巨龙竹叶片相对含水量变化Fig.1 The relative water content changes of D. sinicus seedlings under drought stress
2.3 干旱胁迫对巨龙竹实生苗叶绿素含量的影响
叶绿素是植物体内重要的光合色素之一[8],其含量可以反映出叶片的水分状况和衰老程度,常被作为评判植物干旱缺水的指标[22]。由图2 可知,孟连苗和昆明苗叶绿素含量均呈现随着胁迫水平增强而下降的变化趋势,但两者下降的速率不同。孟连苗叶绿素含量在前4 个胁迫水平上下降的速率较快而后趋于平缓,叶绿素含量下降了17.00 mg/cm2;昆明苗则与之相反,在前4 个胁迫水平上下降较为平缓到第5 胁迫水平后急剧下降,叶绿素含量下降了14.20 mg/cm2。由此可以看出,孟连苗的叶绿素含量变化较大,抗旱性较弱。
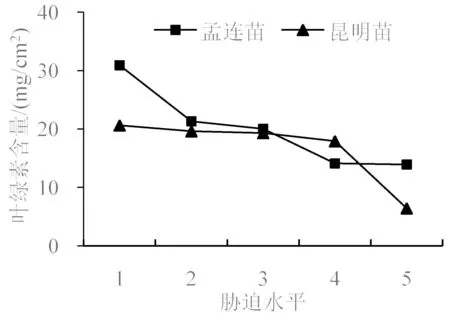
图2 干旱胁迫下巨龙竹实生苗叶片叶绿素含量变化Fig.2 The chlorophyll content changes in leaves of D. sinicus seedlings under drought stress
2.4 干旱胁迫对巨龙竹实生苗细胞膜透性的影响
细胞膜是植物细胞与外界交流的通道,在干旱胁迫下细胞膜透性可以反映出细胞膜受损的程度,从而体现植物的抗旱能力[23]。由图3 可知,在持续干旱过程中,孟连苗和昆明苗的细胞膜透性总体呈上升趋势,说明干旱强度越强,细胞膜受损伤的程度越大。与第1 胁迫水平相比,孟连苗从第2 胁迫水平到第5 胁迫水平细胞膜透性的增幅分别为6.77%、16.73%、18.71%、53.16%;昆明苗从第2 胁迫水平到第5 胁迫水平细胞膜透性的增幅分别为1.04%、8.64%、12.59%、35.30%。由此可以看出,在同一个胁迫水平上,孟连苗的细胞膜透性大于昆明苗,说明孟连苗细胞膜损伤的程度更大,抵御干旱的能力较低。
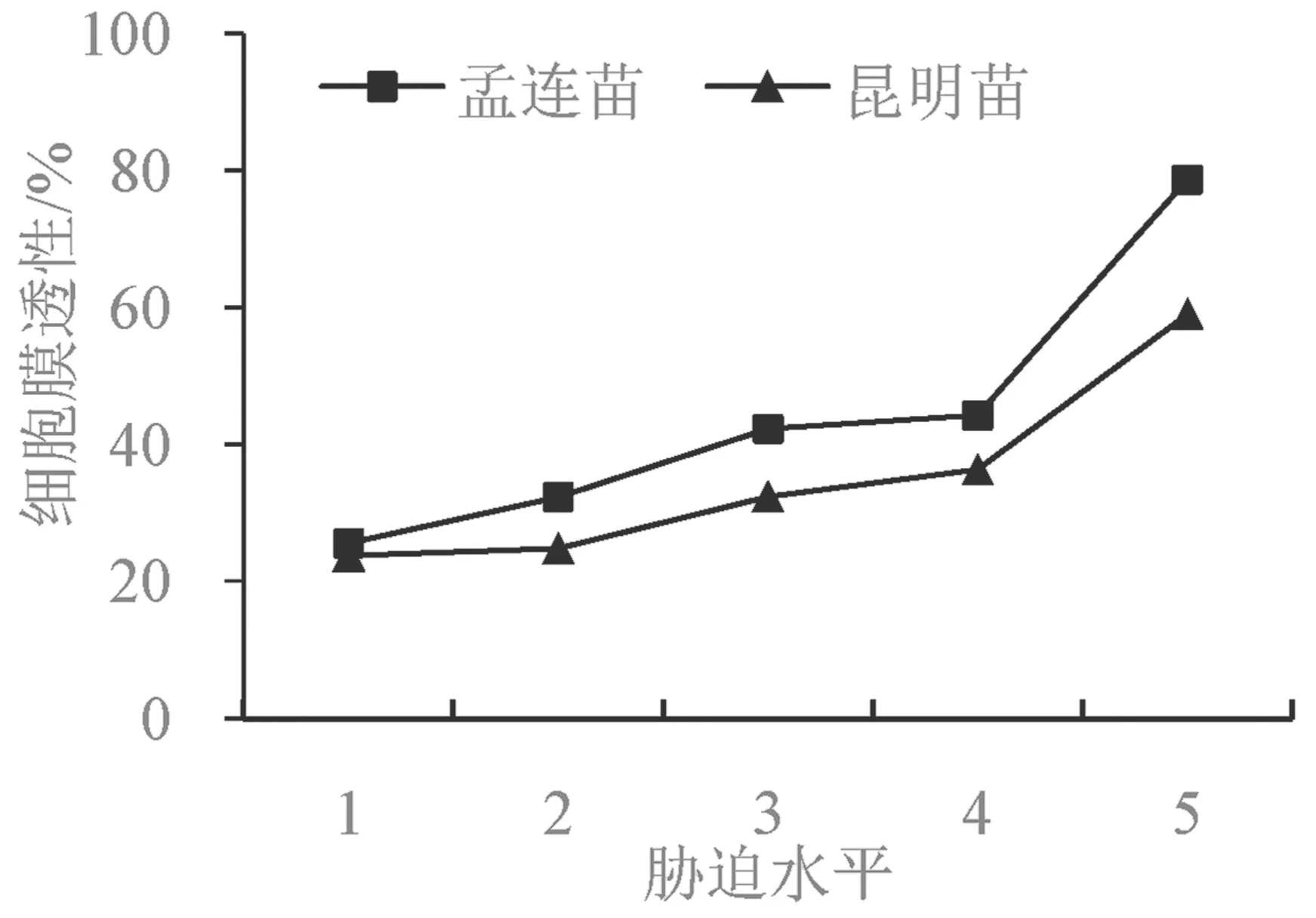
图3 干旱胁迫下巨龙竹实生苗细胞膜透性变化Fig.3 The cell membrane permeability changes of D. sinicus seedlings under drought stress
2.5 干旱胁迫对巨龙竹实生苗可溶性蛋白含量的影响
可溶性蛋白是一种重要的有机渗透调节物质,在缺水情况下可以减少细胞内的水分丧失[19],其含量的高低还可以反映各种代谢活动的强弱,是衡量叶片保水能力的重要生理指标[24]。由图4 可以看出,在持续干旱过程中,孟连苗和昆明苗的可溶性蛋白含量总体呈先下降后升高的变化趋势,第2 胁迫水平两者的可溶性蛋白含量最低。从整体上看,从第1 胁迫水平到第5 胁迫水平,孟连苗的可溶性蛋白含量增加了11.75 mg/g (FW);昆明苗的可溶性蛋白含量增加了15.28 mg/g (FW)。由此可以看出,昆明苗的可溶性蛋白含量比孟连苗的高,说明其保水能力较好[17]。
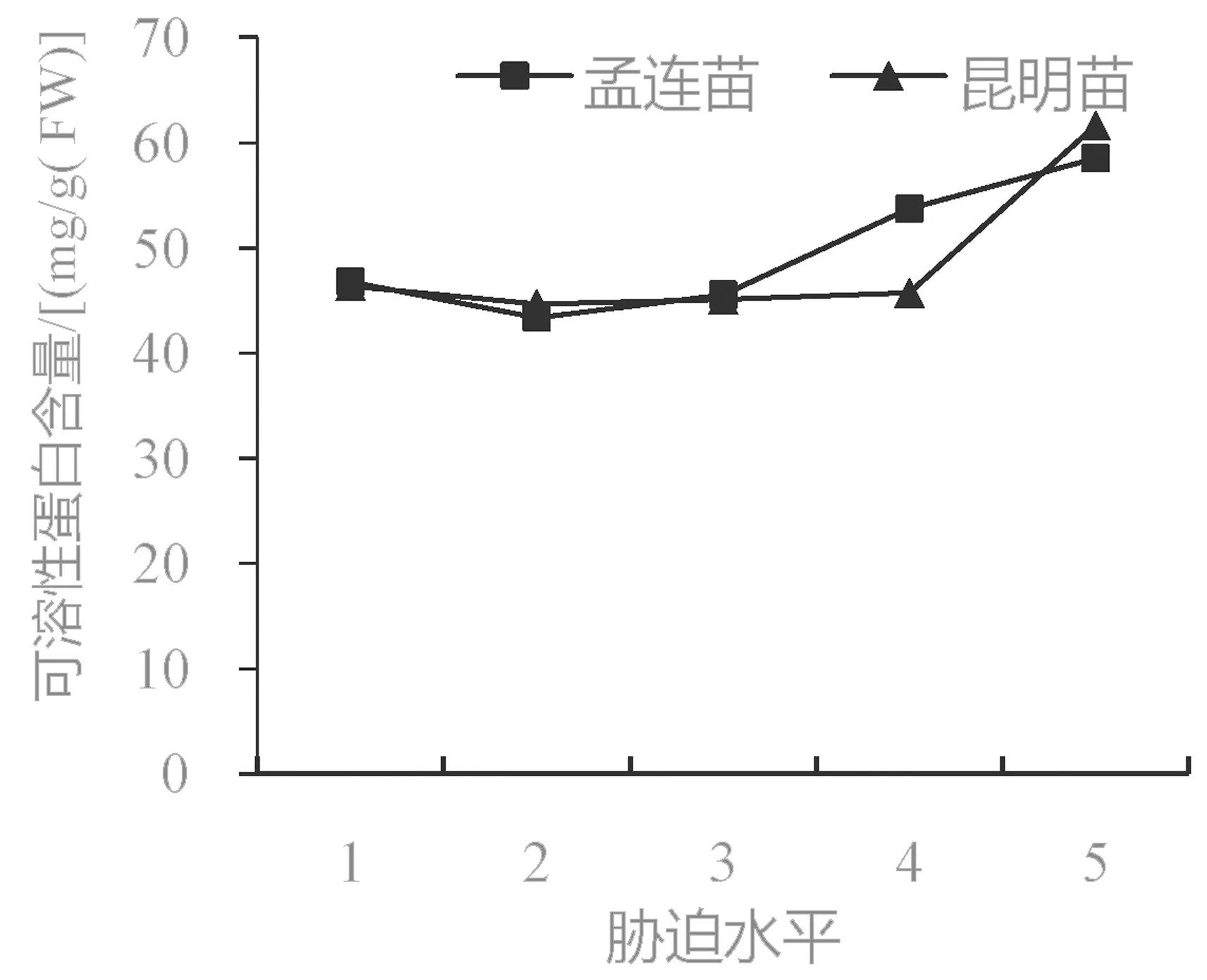
图4 干旱胁迫下巨龙竹实生苗可溶性蛋白含量变化Fig.4 The soluble protein content changes of D. sinicus seedlings under drought stress
2.6 干旱胁迫对巨龙竹实生苗丙二醛含量的影响
在干旱胁迫下,植物膜脂会发生过氧化反应,从而产生大量的丙二醛(MDA)[6]。因此,MDA 含量可以反映出叶片膜脂的受损程度[24],其数值越大表示植物所受干旱胁迫越严重[20]。如图5 所示,孟连苗和昆明苗的MDA 含量与干旱强度呈正相关,随干旱胁迫的增强而逐渐上升。在同一干旱水平下,孟连苗的MDA 含量大于昆明苗,说明昆明苗细胞膜受损程度较小,膜脂过氧化程度低。
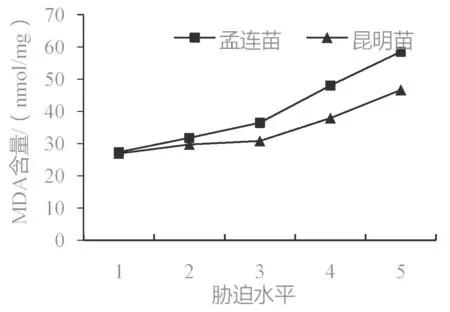
图5 干旱胁迫下巨龙竹实生苗MDA 含量变化Fig.5 The MDA content changes of D. sinicus seedlings under drought stress
2.7 干旱胁迫对SOD、APX、CAT 酶活性的影响
2.7.1 干旱胁迫对巨龙竹SOD 活性的影响
超氧化物歧化酶(SOD) 是植物体内的重要保护酶之一,是植物抵抗氧化侵袭的第1 道防线[21]。当植物受到干旱胁迫时,SOD 能在一定程度上减缓、抵御活性氧对细胞造成伤害。相关研究表明,耐旱的植物SOD 活性较高。因此,SOD活性可以作为一个抗旱的指标[25]。从表3 中可以看出,干旱胁迫对孟连苗与昆明苗的SOD 活性有显著影响,但两者变化的幅度不同。随着干旱胁迫的增强,孟连苗叶片的SOD 活性呈现先升高后下降再升高变化的“S”曲线(P<0.05);昆明苗叶片的SOD 活性变化则为先缓慢升高又缓慢下降然后逐渐升高,在第4 胁迫水平到达峰值后又迅速降低。两者的SOD 活性除在第2 胁迫水平上差异不显著(P>0.05) 外,其他水平均有显著差异(P<0.05)。从整体上看,昆明苗的SOD 活性在整个干旱胁迫过程中相对较高,说明其清除自由基和抗氧化能力较强,抗旱性也较强[26]。
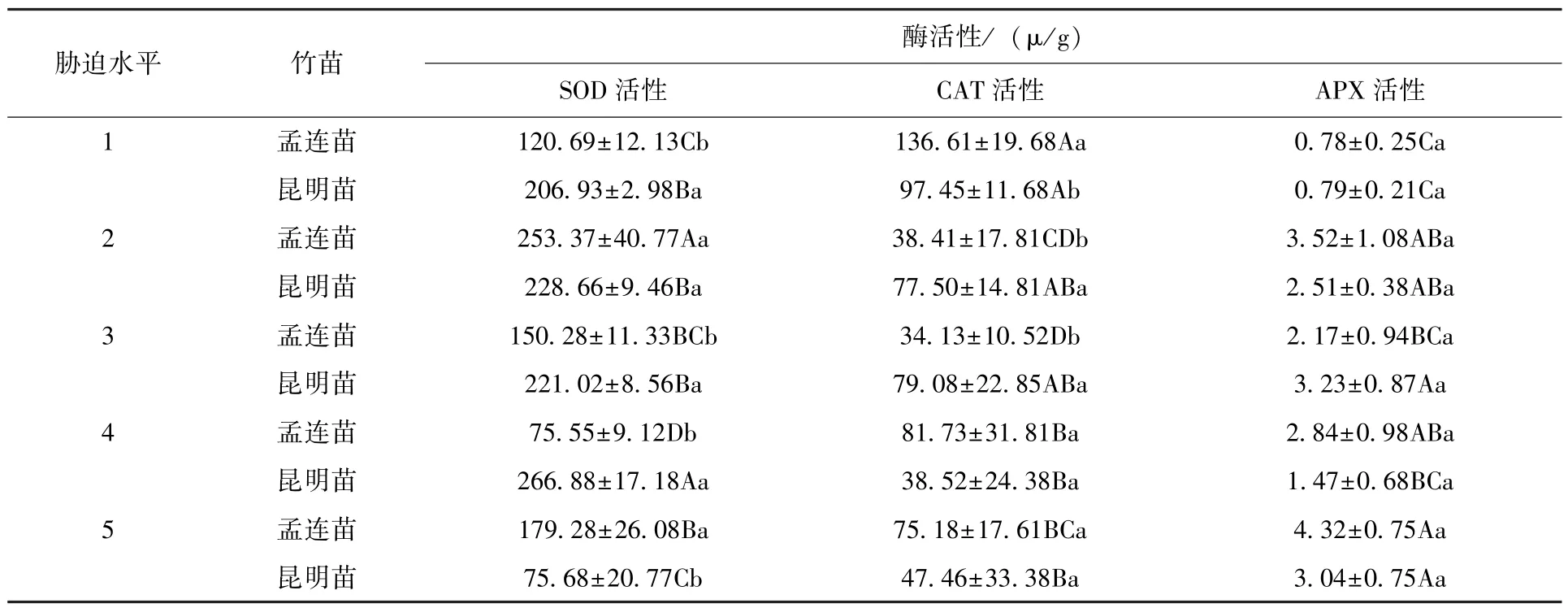
表3 干旱胁迫下巨龙竹实生苗酶活性变化Tab.3 The enzyme activity changes of D. sinicus seedlings under drought stress
2.7.2 干旱胁迫对巨龙竹CAT 活性的影响
过氧化氢酶 (CAT) 存在于过氧化物体中[24],是抗氧化酶系统的重要组成成分[27],对清除细胞内的H2O2有重要作用。从表3 中可以看出,孟连苗和昆明苗的CAT 活性在前3 个胁迫水平上存在显著差异(P<0.05),在后2 个胁迫水平上差异不显著(P>0.05)。随着干旱胁迫的增强,孟连苗叶片的CAT 活性变化为先急速下降后逐渐升高又缓慢下降,不同胁迫水平之间有显著差异(P<0.05);昆明苗叶片的CAT 活性呈缓慢下降―缓慢升高―快速下降―缓慢升高的变化趋势,但上升幅度小,总体呈下降趋势,说明随着干旱胁迫的增强,需要消耗大量CAT 用于清除H2O2。
2.7.3 干旱胁迫对巨龙竹APX 活性的影响
抗坏血酸过氧化物酶(APX) 是叶绿体中清除H2O2的关键酶[28]。由表3 可以看出,孟连苗和昆明苗的APX 活性在水分适宜的第1 胁迫水平时含量较低,说明此时细胞体内的H2O2浓度较低。随着干旱胁迫的增强,两者的APX 活性呈先上升后下降又上升的变化趋势,不同胁迫水平之间均有显著差异(P<0.05),但同一胁迫水平下两者无显著差异 (P>0.05)。由此可以看出,H2O2的产生能够诱导APX 的表达,胁迫后期H2O2含量的增多使APX 活性不断升高。
2.8 耐旱性综合评价
在持续干旱胁迫下,孟连苗和昆明苗各项指标的隶属函数值及均值如表4 所示。可以看出,昆明苗的隶属函数值均值大于孟连苗的隶属函数值均值,说明昆明苗的抗旱性比孟连苗强。
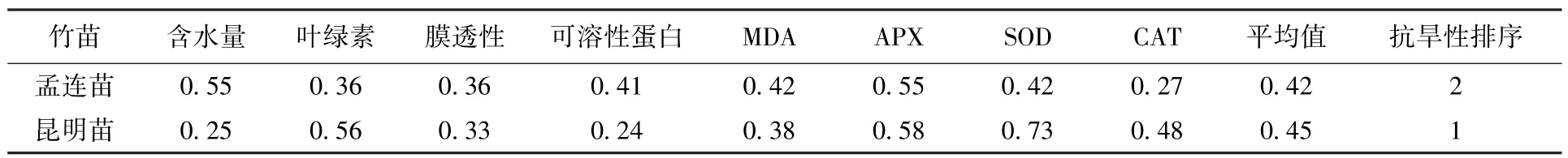
表4 巨龙竹实生苗各项指标隶属函数值Tab.4 The membership function values of each index for D. sinicus seedlings
3 讨论与结论
干旱胁迫会对植物的生长发育和生理生化活动造成一定的影响,最直观的表现是从形态上开始衰老,甚至死亡。本研究结果表明,干旱胁迫导致了孟连苗和昆明苗自身水分调节能力变弱,随着干旱胁迫的增强,两者的叶片相对含水量变化先升高后下降,这是因为在较低的干旱水平下,叶片会通过提高水分利用率或减少蒸腾作用等来减少水分的丧失,这与干旱胁迫对香樟幼树生理特性的影响相一致[29]。但两者的下降幅度不一样,孟连苗叶片相对含水量下降幅度较大,表明它的叶片保水能力较昆明苗差,这可能与其较大的叶面积有关。这与任磊等[15]对4 种茶菊的研究结果相一致。
细胞膜是保护植物细胞不被外界侵蚀的屏障,能保持细胞内环境的相对稳定,使细胞内的各项生理活动有序进行[8]。相关研究表明:在干旱胁迫下,植物由于持续脱水,导致细胞膜的功能或结构受损,相对膜透性持续增大[23],叶绿素合成受阻或分解加快,从而使叶绿素含量降低[22]。本试验所得结论与上述观点一致。随着干旱胁迫的增加,膜脂过氧化程度增强,MDA 作为该反应的最终产物可以作为衡量膜脂受损程度和植物抗旱性强弱的指标[24]。本研究结果表明:孟连苗和昆明苗的MDA 含量均随着干旱强度的增加而增加。说明两者的膜系统均受到了一定程度的损伤,这与季杨等[19]对鸭茅叶的研究结果一致。可溶性蛋白可以参与调节植物细胞的渗透势,抵抗干旱胁迫带来的伤害[18]。本研究表明,随干旱胁迫的增强,孟连苗和昆明苗的叶片可溶性蛋白质含量逐渐增加,体现出了较强的抗旱性,这与张卫红等[17]对垂穗披碱草的研究结果一致。
干旱胁迫会增加植物体内的活性氧[27],为了防御、减少氧化的损害,植物会发动体内的抗氧化酶和非酶系统来清除或减轻活性氧带来的伤害,SOD、CAT、APX就属于这一系统中的关键酶[19]。本研究结果表明,孟连苗和昆明苗的SOD活性和APX 活性均随干旱胁迫的增强呈现先上升后下降再上升的变化趋势,而昆明苗在严重干旱胁迫时SOD 活性急速下降,可能是因为植物体内的SOD 对干旱有一定的抵抗能力,当干旱胁迫超出了它的抵抗范围,其抗干旱的能力就会下降,导致活性降低[20];在重度干旱和严重干旱的情况下,孟连苗和昆明苗的APX 活性都较高,说明巨龙竹在遭受到高强度的干旱胁迫时APX 是发挥主要作用的酶[7],这与前人的研究结论相一致[30]。但在CAT 活性的研究结果中,孟连苗和昆明苗的CAT 活性变化趋势不同,这可能是因为两者对干旱的敏感程度不同和分解H2O2的速率不一致[8]。
根据孟连苗和昆明苗的各项生理指标和综合分析可以看出,昆明苗的耐旱性大于孟连苗。但本研究仅采用盆栽苗在大棚内进行试验,不能完全地反映出两者在田间的抗旱能力,且昆明苗表现出的较强抗旱性,可能与其适应了昆明的环境有关。因此,若要综合评价孟连苗和昆明苗的抗旱能力需进一步结合两者在田间环境下的生长发育状况和各项生理指标等来评判,以便更加科学全面地评价两者的抗旱性,为今后扩大巨龙竹的栽培范围、科学引种提供可靠的理论依据。


