水稻侧根突变体Oslrd2的表型分析和基因克隆
朱俊兆 陈宇杰 吕沈阳 陈星月 杨愈之 郑文娟 朱世华 丁沃娜,*
(1 宁波大学科学技术学院, 浙江 宁波 315212;2 宁波大学海洋学院,浙江 宁波 315211)
根系是植物获取养分、水分以及稳固植株的重要器官。根系构型(root system architecture, RSA)具有高度可塑性,在植物物种之间和物种内部存在很大的差异[1]。侧根(lateral roots, LRs)是RSA的一个重要组成部分,起源于中柱鞘细胞[2]。LRs在根系中占有较高的比重,提供大部分根系养分吸收的能力[3]。在水稻根系中,LRs约占总根系长度的97%、总根系体积的30%和总根系表面积的78%[4]。因此,侧根的发生发育一直是水稻根系发育研究的重要方向。
目前,在水稻中已分离并遗传鉴定了一些侧根发育相关的突变体,其中已克隆的许多基因与生长素信号通路相关[5]。如生长素输入载体OsAUX1[6],生长素信号负调控因子IAA基因OsIAA3[7]、OsIAA11[8]和OsIAA13[9],生长素输出载体OsPIN2[10]等。OsAUX1的T-DNA插入突变体和RNAi敲除转基因植株侧根的起始均减弱[6];OsIAA3基因的突变体对生长素不敏感,侧根数量显著减少[7];OsIAA11基因突变后中柱鞘细胞分裂缺陷,阻断了侧根原基的起始[8];OsIAA13控制水稻侧根启动,突变体Osiaa13侧根数量显著减少[9];OsPIN2通过调控生长素分布参与侧根形成[10]。此外,水稻复制起始识别复合体亚族基因OsORC3[11]、铵转运体OsAMT1[12]、肌醇多磷酸激酶OsIPK2[13]、亲环蛋白基因OsCYP2[14]等都对水稻侧根的起始发育起着重要作用。还有少数水稻侧根突变体如RM109[15]、hts1[16]和k209[17]的基因尚未克隆。
本研究以从甲基磺酸乙酯(ethyl methyl sulfonate, EMS)诱变的籼稻品种Kasalath突变体库中筛选得到的侧根突变体Oslrd2(Oryzasativalateralrootdefective2)为材料,对其进行表型和遗传分析、图位克隆、候选基因测序及转基因互补验证,旨在为深入解析水稻侧根发生发育的分子机制奠定基础。
1 材料与方法
1.1 试验材料
从EMS诱变的籼稻(indica)地方品种Kasalath突变体库(种子来源:宁波大学科学技术学院植物分子生物学实验室)中筛选获得水稻侧根突变体Oslrd2,连续自交得到稳定遗传的纯合株系。将Oslrd2突变体和粳稻野生型品种Nipponbare(种子来源:宁波大学科学技术学院植物分子生物学实验室)杂交,F1代自交产生的F2代用于遗传分析和图位克隆。在所有的溶液培养试验中,植物生长环境由温室控制,具体条件为:12 h光照周期(30℃)/12 h黑暗周期(22℃)、光照强度3 000 lux、相对湿度70%。
1.2 表型分析
野生型(wild type, WT)与突变体幼苗使用《国际水稻所标准营养液配方》[18]进行溶液培养,对培养7 d的幼苗进行表型测量,包括主根长、苗高、不定根长、侧根数和侧根长,对野生型及突变体分别随机统计10株。
将溶液培养21 d的水稻幼苗转移至大田土培,待成熟时选取生长状况良好且无病害的野生型和突变体,对全株拍照,并记录株高、分蘖数、每穗实粒数等农艺性状,对野生型及突变体分别随机统计10株。
1.3 侧根原基形成的观察
取溶液培养3 d的野生型和突变体Oslrd2主根,参考Wang等[19]的方法进行亚甲基蓝染色:将切下的根固定在4℃的无水乙醇∶冰醋酸(3∶1,v/v)溶液中24 h以上,取出后用蒸馏水冲洗5 min,用0.01%的亚甲基蓝对根进行染色。体视镜观察侧根原基的发生情况。
取溶液培养5 d的野生型和突变体Oslrd2主根,按照以下方法进行解剖观察:蒸馏水冲洗后,截取主根伸长区到成熟区的区段,用解剖针剥去表皮和大部分皮层,使侧根原基显露出来。将处理后的根系置于载玻片上,添加一滴水合氯醛透明剂(4 g水合三氯乙醛、1 mL甘油、2 mL H2O),盖上盖玻片于显微镜下观察并采集图像。
1.4 突变基因的图位克隆
1.4.1 分子标记的选择和设计 根据Gramene网站(http://www.gramene.org/)中已公布的简单重复序列(simple sequence repeat, SSR)分子标记,选择水稻12条染色体上的多态性SSR引物,对OsLRD2突变基因进行初定位。确定突变基因所在染色体大致位置后,逐步扩大群体,以粳稻Nipponbare和籼稻Kasalath间的序列差异为基础,设计该区间内具有多态性的插入缺失标记(insertion-deletion, InDel),进行精细定位。
1.4.2 基因定位 取Kasalath、Nipponbare、F1和F2分离群体的水稻叶片,使用水稻基因组DNA快速微量提取法(TPS法)[20]提取DNA。筛选F2分离群体具有侧根突变性状株系的DNA,后通过PCR扩增靶基因。PCR总体系为20 μL:2×Es Taq MasterMix 10 μL,ddH2O 7.0 μL,10 μmol·L-1上游引物1.0 μL,10 μmol·L-1下游引物1.0 μL,模板DNA 1.0 μL。PCR程序为:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环;72℃终延伸5 min。再用聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis, SDS-PAGE)检测PCR产物,通过硝酸银染色后鉴定带型,分析突变位点和分子标记的连锁关系,验证疑似连锁的标记。根据水稻基因组数据库网站(http://rice.plantbiology.msu.edu/cgi-bin/gbrowse/rice/)和EST数据库(http://www.ncbi.nlm.nih.gov/)分析定位区间内的候选基因,测序验证其突变位点。
1.5 转基因互补验证
根据OsLRD2基因编码区序列(coding sequence, CDS),设计分别包括XbaⅠ和KpnⅠ酶切位点(下划线表示)的上下游引物:OsLRD2-F(5′-A A AG G T A C CC G C C A T G A G G G A G T G C AT-3′)和OsLRD2-R(5′-A A AT C T A G AA G A T A G A A G C C C A C A C G G A C AG-3′)。以野生型叶片的cDNA为模板进行PCR扩增,PCR总体系为50 μL:2×PCR buffer for KOD FX 25 μL,ddH2O 10 μL,2 mmol·L-1dNTPs 10 μL,10 μmol·L-1上游引物1.5 μL,10 μmol·L-1下游引物1.5 μL,模板DNA 1.0 μL,1.0 unit·μL-1KOD FX DNA Polymerase 1.0 μL。PCR程序:94℃预变性2 min;98℃变性10 s,55℃退火30 s,68℃延伸90 s,30个循环;68℃终延伸5 min。将扩增得到的CDS片段与超表达载体pCAMBIA1300连接,通过农杆菌将已构建好的超表达载体导入突变体Oslrd2成熟胚诱导的愈伤组织中,经过植物组织培养分化成苗。选择生长情况良好且根系表型正常的转基因植株进行繁种,获得纯合株系后进行表型分析。
2 结果与分析
2.1 突变体Oslrd2的表型鉴定
对培育7 d的野生型(WT)和突变体Oslrd2幼苗进行表型观察(表1),发现Oslrd2的地上部和根系发育均存在缺陷,苗高只有野生型的45.52%(图1-A),主根和不定根的长度都受到明显抑制,分别只有野生型的73.65%和51.34%(图1-B)。Oslrd2侧根的生长存在严重缺陷,体视镜观察并测量发现Oslrd2的侧根长度只有野生型的9.04%(图1-C~D、表1),侧根数目也极显著减少,只有野生型的36.49%。
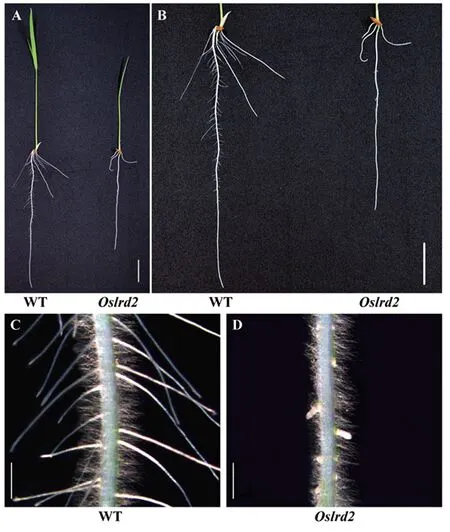
注:A:WT和突变体Oslrd2全株表型,标尺为2 cm;B:WT和突变体Oslrd2根部表型,标尺为2 cm;C:WT主根的体视镜照,标尺为1 mm;D:突变体Oslrd2主根的体视镜照,标尺为1 mm。Note: A: Seedlings of the WT and Oslrd2, bar=2 cm. B: The root of the WT and Oslrd2, bar=2 cm. C: The primary root of the WT under the stereoscope, bar=1 mm. D: The primary root of Oslrd2 under the stereoscope, bar=1 mm.图1 野生型和突变体Oslrd2水培7 d幼苗表型Fig.1 The phenotype of 7-day-old hydroponic seedlings of the WT and mutant Oslrd2
进一步通过亚甲基蓝染色方法对生长3 d的侧根原基进行观察(图2-A、B),发现突变体Oslrd2侧根原基的数量较野生型明显减少,只有野生型的63.40%(图2-C),表明Oslrd2侧根数目的减少与侧根原基发生相关。
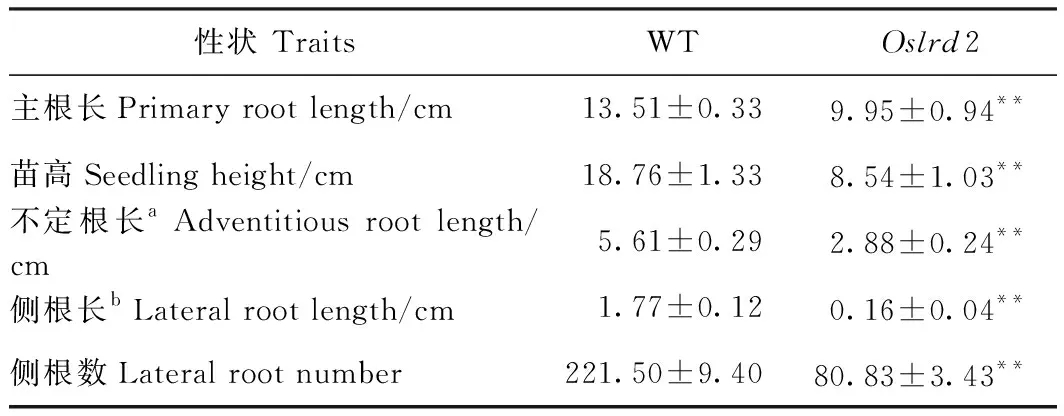
表1 野生型和突变体Oslrd2水培7 d幼苗表型比较Table 1 Characteristics of 7-day-old hydroponic seedlings of the WT and mutant Oslrd2
2.2 突变体Oslrd2侧根原基的解剖观察
通过解剖学方法对野生型和突变体Oslrd2生长5 d的侧根原基进行观察(图3-A、B)。野生型的侧根原基在整个发育过程中细胞排列较为紧密,细胞大小均一,连贯性较好,且较为圆润(图3-A);而突变体Oslrd2的侧根原基随着发育进程推进,形状逐渐不规则,膨胀较为明显,形成侧根的直径比野生型粗,侧根原基的细胞排列混乱(图3-B),侧根的伸长受到明显抑制。
2.3 突变体Oslrd2的农艺性状分析
比较成熟期农艺性状可知,Oslrd2的株高只有野生型的52.97%(图4-A、C、E),叶片宽度明显变窄(图4-B);有效穗数、每穗实粒数和千粒重都显著或极显著降低,分别为野生型的26.09%、30.08%和85.21%(图4-E);突变体种子长度与野生型相比无明显差别,但宽度较野生型窄(图4-D)。
2.4 突变体Oslrd2的遗传分析
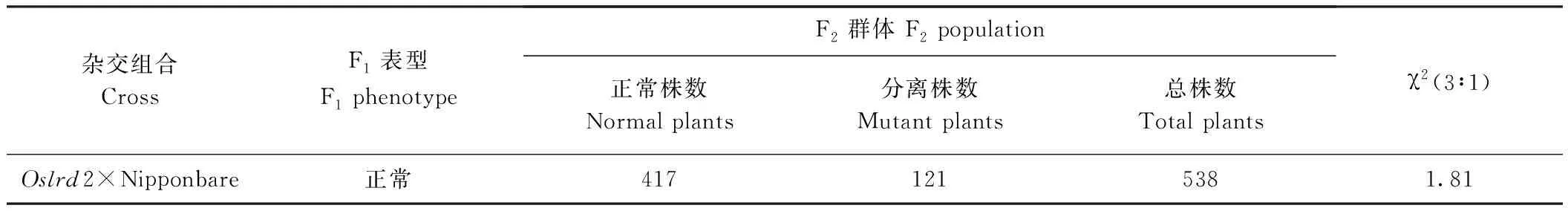
表2 突变体Oslrd2的遗传分析Table 2 Genetic analysis of mutant Oslrd2
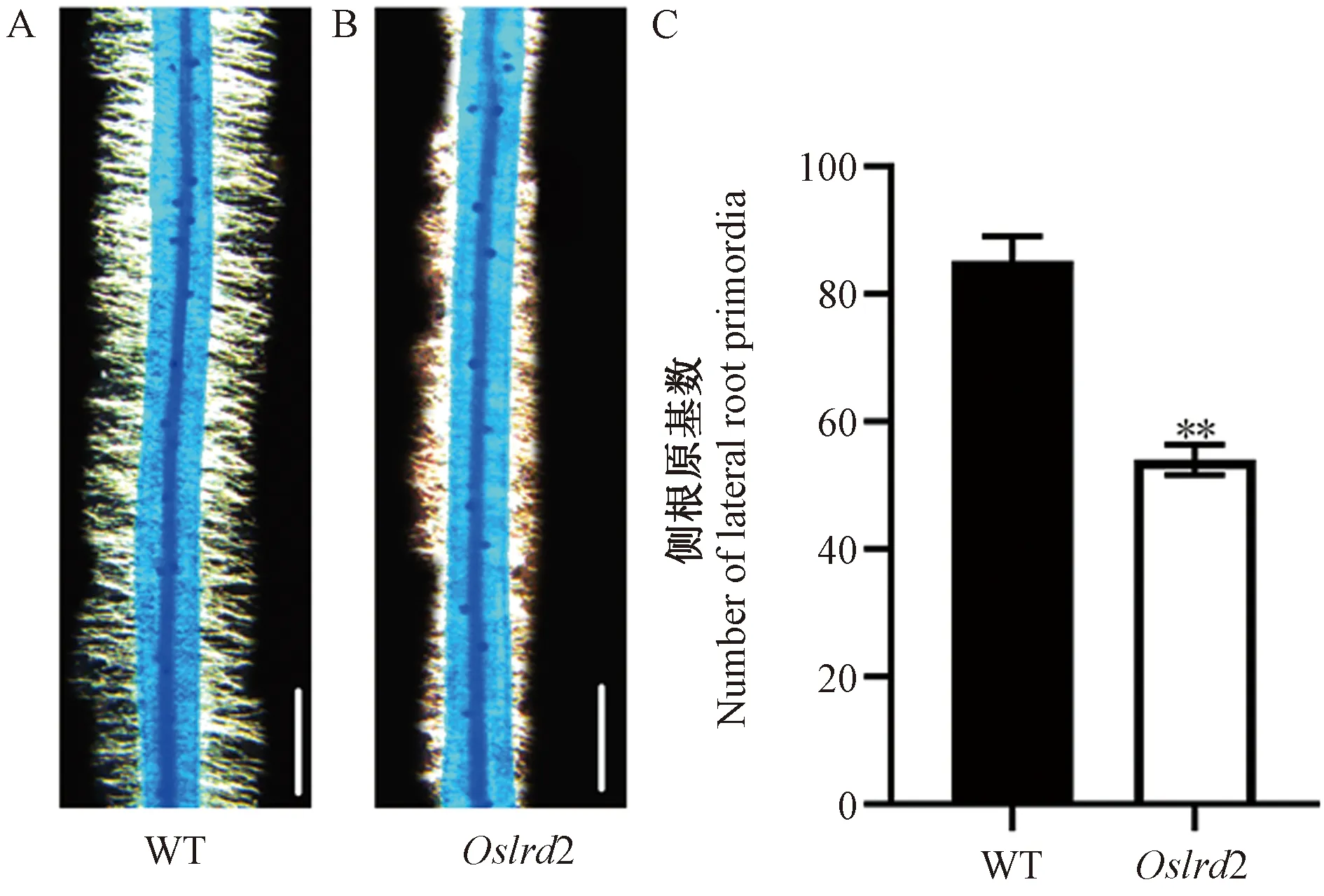
注:A:3 d苗龄的WT侧根原基形成图,标尺为1 mm;B:3 d苗龄的突变体Oslrd2侧根原基形成图,标尺为1 mm。C:WT和突变体Oslrd2侧根原基数比较。*表示在0.05水平上差异显著; **表示在0.01水平上差异极显著。Note: A: Lateral root primordia formation of 3-day-old WT, bar=1 mm. B: Lateral root primordia formation of 3-day-old Oslrd2, bar=1 mm. C: Comparison of lateral root primordia between the WT and Oslrd2. * indicate significant difference at 0.05 level. ** indicate significant difference at 0.01 level.图2 野生型和突变体Oslrd2水培3 d幼苗的侧根原基观察Fig.2 Lateral root primordia of 3-day-old hydroponic WT and mutant Oslrd2 seedlings
2.5 OsLRD2基因的图位克隆
利用Kasalath、Nipponbare、F1和F2分离群体,通过水稻12条染色体上均匀分布的SSR引物对OsLRD2基因进行初步定位,将突变基因定位在第11条染色体上SSR标记RM120与RM3701之间。在此区间内设计4对多态性的InDel标记(InDel 1~4,附表1),同时扩大群体到1 330个,最终将突变基因锁定在InDel 3和InDel 4之间约10 kb的区间内(图5-A)。候选基因测序发现,基因号为LOC_Os11g14220的CDS序列中1 176 bp处(位于第4个外显子)缺失了一个胞嘧啶(C)以及在1 179 bp处的胞嘧啶(C)突变为腺嘌呤(A)(图5-B),导致氨基酸序列中第392位的天冬氨酸(D)变成了谷氨酸(E)和第393位的异亮氨酸(Ⅰ)变成终止密码子TAA,导致翻译提前终止(图5-C),编码产物只有392个氨基酸。LOC_Os11g14220基因编码α-微管蛋白,DNA全长2 885 bp,CDS全长1 356 bp,编码451个氨基酸,含4个外显子和3个内含子。经过生物信息学分析发现该基因含有两个结构域:Tubulin和Tubulin_C(图5-C),其中的Tubulin属于Tubulin/FtsZ 家族的GTP酶结构域,在第49~第246位氨基酸区间,是核苷酸结合位置。Tubulin_C属于Tubulin/FtsZ家族的C末端结构域,包含第248~第393位氨基酸区间,是微管结合蛋白结合的位置,突变体Oslrd2的突变位点在此结构域中。
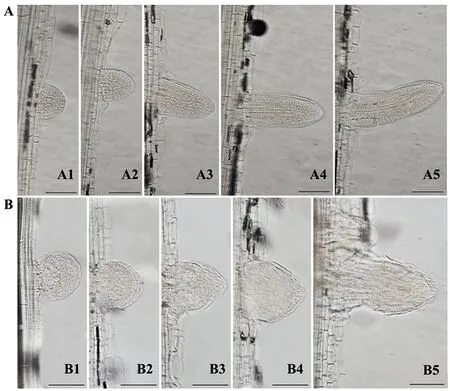
注:A:5 d苗龄的WT侧根原基,A1~3为未突破主根表皮的侧根原基,A4为侧根原基顶端刚刚突破主根表皮,A5为开始伸长的侧根,标尺为100 μm;B:5 d苗龄的突变体Oslrd2侧根原基,B1~3为未突破主根表皮的侧根原基,B4为侧根原基顶端刚刚突破主根 表皮,B5为开始伸长的侧根,标尺为100 μm。Note: A: Lateral root primordia at 5-day-old WT. A1~3 are the lateral root primordia that have not broken through the primary root epidermis, A4 is the lateral root primordium whose top just broke through the primary root epidermis, A5 is the lateral root that begins to elongate, bar=100 μm. B: Lateral root primordia of 5-day-old Oslrd2, B1~B3 are the lateral root primordia that have not broken through the primary root epidermis, B4 is the lateral root primordium whose top just broke through the primary root epidermis, B5 is the lateral root that begins to elongate, bar=100 μm.图3 野生型和突变体Oslrd2的侧根原基形态观察Fig.3 Morphology of lateral root primordia in the WT and mutant Oslrd2
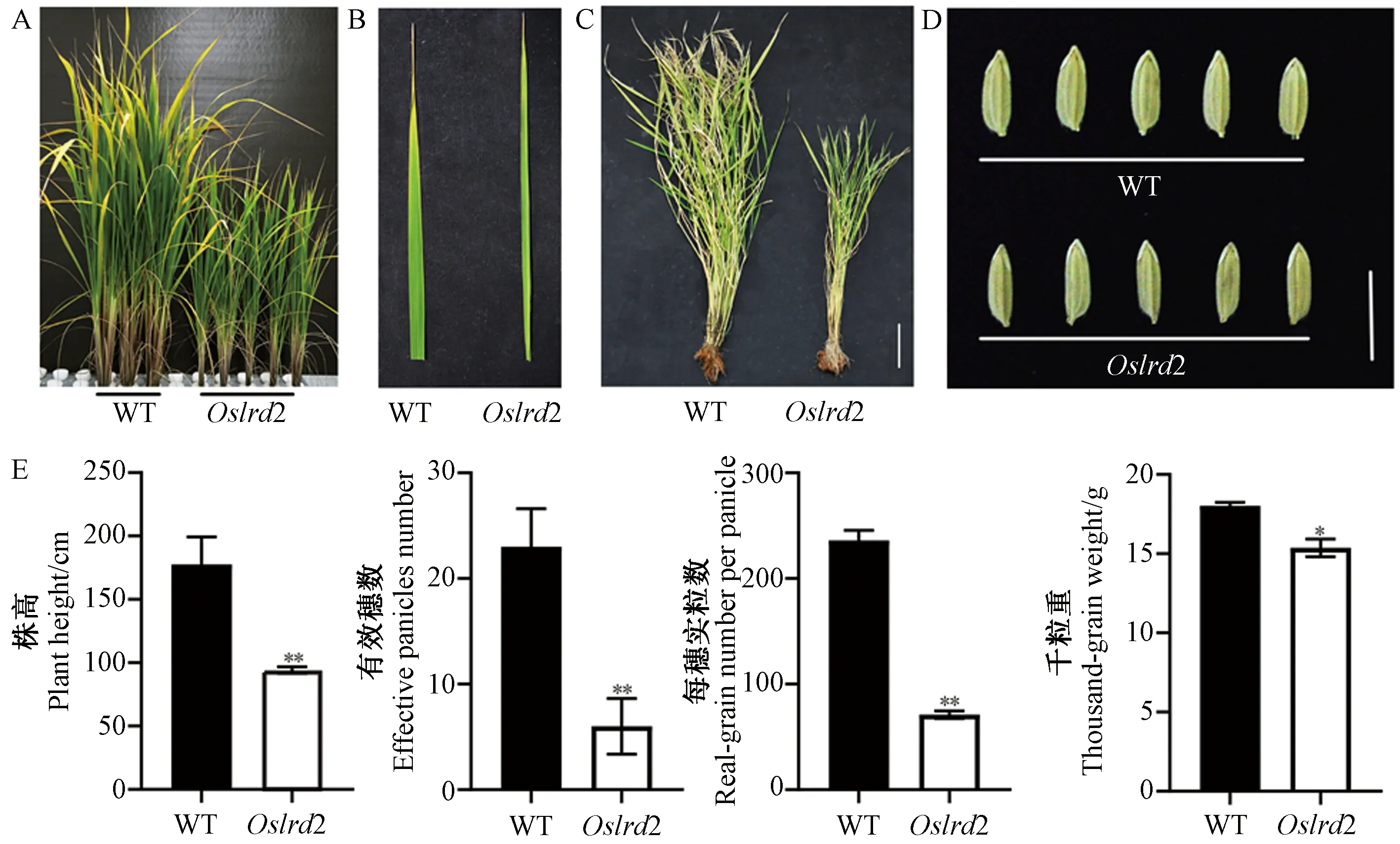
注:A:WT和突变体Oslrd2水培50 d地上部表型;B:WT和突变体Oslrd2水培50 d叶片表型;C:WT和突变体Oslrd2大田成熟全株,标尺为15 cm;D:WT和突变体Oslrd2种子形态比较;E:WT和突变体Oslrd2成熟期农艺性状比较。*表示在0.05水平上差异显著;**表示在0.01水平 上差异极显著。Note: A: The aboveground part of 50-day-old hydroponic WT and Oslrd2 seedlings. B: The leaf of 50-day-old hydroponic WT and Oslrd2 seedlings. C: Mature plants of the WT and Oslrd2 cultivated in soil, bar=15 cm. D: Seeds of WT and Oslrd2, bar=1 cm. E: Agronomic traits of the WT and Oslrd2 at the maturation stage. * indicate significant difference at 0.05 level. ** indicate significant difference at 0.01 level.图4 野生型和突变体Oslrd2成熟期表型Fig.4 The phenotype of the WT and mutant Oslrd2 at the maturation stage
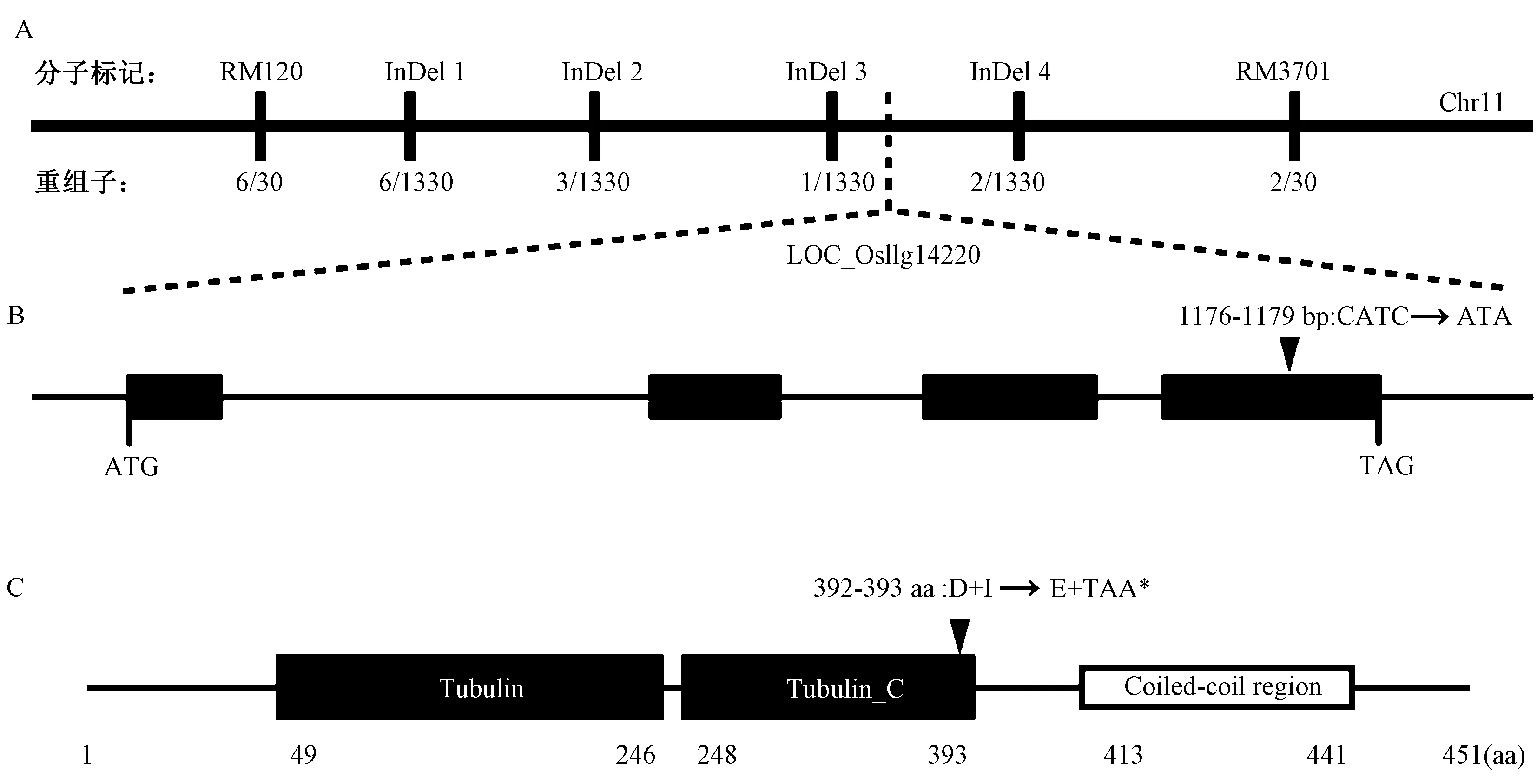
注:A:OsLRD2在11号染色体上的精细定位;B:OsLRD2基因结构,黑框代表外显子;C:OsLRD2结构功能域,黑色框代表结构域,白色框代表盘绕线圈区域。Note: A: The fine mapping of OsLRD2 on chromosome 11. B: The gene structure of OsLRD2, black boxes represent exons. C: The structure and functional domain of OsLRD2, black boxes represent domain, and the white box represents Coiled-coil region.图5 OsLRD2基因的图位克隆Fig.5 The map-based cloning of OsLRD2
2.6 OsLRD2基因的互补验证分析
为了进一步证明突变体的突变表型是由OsLRD2基因突变导致的,对突变体Oslrd2进行了转基因回复验证。构建的含有OsLRD2基因的超表达载体,经农杆菌介导侵染突变体Oslrd2诱导的愈伤组织并成功获得转基因回复株系,经过繁种并筛选获得纯合植株,纯合的转基因水稻的地上部和根系表型与野生型一致(图6-A),体视镜观察侧根数目和长度均为正常(图6-B)。逆转录PCR(reverse transcription PCR, RT-PCR)分析结果表明,阳性转基因植株中OsLRD2基因的表达增强(图6-C)。上述结果证明突变体Oslrd2的突变表型是由OsLRD2的突变引起的。
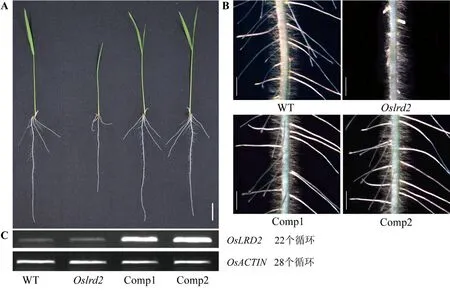
注:A:WT、突变体Oslrd2和两个转基因回复株系(Comp1、Comp2)的全株表型,标尺为2 cm;B:WT、突变体Oslrd2和两个转 基因回复株系(Comp1、Comp2)主根的体视镜照,标尺为1 mm;C:RT-PCR分析结果。Note: A: Seedlings of the WT, Oslrd2, and two lines of transgenic plants (Comp1 and Comp2) in the Oslrd2 mutant background, bar=2 cm. B: The primary root of the WT, Oslrd2, and two lines of transgenic plants(Comp1 and Comp2) under the stereoscope, bar=1 mm. C: RT-PCR analysis result.图6 OsLRD2 转基因回复结果Fig.6 Transgenic complementation analysis of Oslrd2 result
3 讨论
微管(microtubules, MTs)是细胞骨架的核心组成部分,参与细胞的形状构成、运输、运动和分裂[21]。MTs是真核细胞骨架的主要组成部分,由α和β微管蛋白异质二聚体组成,在聚合和解聚合之间相互转换[22]。微管束形成是真核生物间期和有丝分裂微管系统有序排列的重要机制[23]。在植物生长发育过程中,MTs参与植物生长和形态建成的控制和重构[24]。虽然MTs的基本结构和动态特性在真核生物中是保守的,但植物已经进化出几种独特的微管系统控制植物特异的细胞分裂和扩张方式,从而影响细胞形态发生和分化[25-26]。本研究克隆的OsLRD2基因编码一个α-微管蛋白,该基因突变后造成水稻侧根原基的细胞排列混乱,侧根的伸长受到明显抑制(图3);此外,叶片和种子宽度均变窄(图4-B、D)。表明α-微管蛋白参与水稻细胞分裂过程,控制细胞膨胀的方向,在细胞扩张生长过程中起重要作用。
在水稻中,已报道的α-微管蛋白基因的功能研究较少。目前已有研究如水稻TID1基因[27]编码α-微管蛋白,突变体Tid1-1表现为矮化和扭曲生长,叶片和茎呈螺旋状生长,茎尖分生组织细胞数量增加,根细胞伸长受抑制,根尖分生组织细胞扩大,根部缩短;SRS5[28]编码的α-微管蛋白调控了水稻种子细胞的伸长,突变体srs5与野生型相比,种子更短更圆,穗更短且植株表型半矮化;Liu等[29]通过CRISPR基因编辑技术对α-微管蛋白同源基因OsTubA2进行精确碱基编辑,形成一个点突变,突变后的水稻植株具有二硝基苯胺类除草剂抗性。
通过分析发现,上述三种α-微管蛋白基因TID1、SRS5、OsTubA2和本研究中的OsLRD2为同一个基因位点,但突变方式和对应性状不同。TID1基因编码的蛋白第56个氨基酸由苏氨酸(T)突变为异亮氨酸(I)和第180个氨基酸由丝氨酸(S)突变为苯丙氨酸(F)都造成水稻叶片螺旋生长[27]。SRS5编码的第308位氨基酸由精氨酸(R)突变为亮氨酸(L),导致外稃细胞长度减少,种子表现为小而圆[28]。TID1和SRS5都为单一氨基酸改变,本研究克隆的OsLRD2涉及多个氨基酸改变,其中第392位的天冬氨酸(D)突变为谷氨酸(E)和第393位的异亮氨酸(I)突变为终止密码子(图5-C)。OsLRD2突变后严重影响侧根原基发生和侧根伸长(图1),但突变体Oslrd2的叶片正常,未出现螺旋生长的表型(图4-B),其种子长度正常,宽度变窄(图4-D)。以上结果表明α-微管蛋白基因的不同突变方式,会造成水稻不同的性状改变。
目前水稻侧根发育的分子生物学研究已取得较大进展,但对水稻侧根的发生和发育的调控机制尚缺乏系统的认识。本研究对Oslrd2的表型和遗传分析、图位克隆、候选基因测序及转基因互补验证等试验证明OsLRD2基因所编码的α-微管蛋白是水稻侧根起始生长和伸长所必需的。本研究为α-微管蛋白调控水稻生长发育的作用机制提供了一个新的认识。
4 结论
本研究从水稻侧根突变体Oslrd2中克隆得到一个编码α-微管蛋白的OsLRD2基因。通过亚甲基蓝染色和解剖观察发现突变体Oslrd2侧根原基数目减少,且原基和侧根的形态发生膨胀变形,表明OsLRD2突变抑制了水稻侧根原基的发生和侧根突破表皮,导致侧根数目减少以及长度变短。成熟期农艺性状统计发现,突变体Oslrd2的株高、有效穗数、每穗实粒数、千粒重等重要的农艺性状都受到影响,表明OsLRD2基因与水稻产量密切相关。

附表1 用于OsLRD2基因定位的分子标记序列Supplementary table 1 Molecular markers and primers used to map OsLRD2

