等离子体辅助纳米涂层的构建及其成骨性能
郭西萌, 金莉莉, 李春旺, 何宏燕, 刘昌胜
(华东理工大学材料科学与工程学院,材料生物学与动态化学前沿科学中心,教育部医用生物材料工程研究中心,上海 200237)
前十字韧带(ACL)撕裂是常见的运动损伤,其损伤可能导致膝关节不稳定、半月板损伤、关节软骨退变等疾病,严重影响患者的行动与生活质量[1]。目前临床ACL 重建使用的材料包括自体移植物、异体移植物和人工合成材料等。采用同种异体移植需要经历1 年以上的“韧带化”过程,尤其是术后早期因植入物缺乏支撑而产生摩擦损伤肌腱会导致滑膜炎[2]。人工合成的聚对苯二甲酸乙二醇酯(PET)人工韧带不仅可以避免供体部位的并发症和异体韧带所产生的排异反应,还有创伤小、术后恢复快等优势[3]。但仍存在骨愈合不良、骨组织接合处不稳定等问题[4]。PET 的分子结构和高结晶度导致其亲水性较差,生物活性和生物相容性也差强人意,在临床应用中受到了限制[5,6]。
ACL 损伤发生后,为了促进腱骨交界处的组织愈合,研究者在表面处理活性修饰韧带、增强其腱骨结合方面开展了大量工作。常用的方法是,利用等离子体处理、涂敷亲水性材料等赋予材料亲水特性[7,8];引入外源性细胞因子或负载细胞因子的DNA 质粒,调控细胞的生物学响应,进而改善腱骨愈合效果[9]。其中引入外源性的骨形态发生蛋白(rhBMP-2)是目前最为有效的手段之一。研究表明rhBMP-2 只有负载在一定结构和亲和性较好的载体上才能发挥其诱导成骨活性[10]。目前rhBMP-2 载体材料主要包括凝胶胶原海绵、多糖及其衍生物等[11,12]。纤连蛋白(Fn)是黏附性蛋白,作为细胞外基质的主要成分之一,对细胞的铺展、黏附和增殖都有一定的促进作用,并可通过整合素介导的信号通路刺激细胞早期的成骨分化[13]。Fn 与rhBMP-2 可以通过特殊结合域相互连接[14],促进间充质干细胞(MSC)发生成骨分化,并促进体内成骨再生[15,16]。表没食子儿茶素没食子酸酯(EGCG)通过增加小鼠骨髓间充质干细胞(rBMSCs)成骨相关信使核糖核酸(mRNA)的表达来增强碱性磷酸酶的活性,并促进最终的矿化[17]。临床上使用的rhBMP-2 剂量过高,易引起异位骨形成和炎症等并发症[18]。为了解决这些临床应用中的问题,结合等离子体辅助技术,将rhBMP-2、EGCG、Fn 精准可控地引入人工韧带表面,可实现低剂量引入、高骨诱导性生成,增强人工韧带与腱周组织之间的骨性结合。
本文以PET 编织的人工韧带为研究对象,首先通过氧等离子体技术在PET 表面引入羟基基团;然后采用静电吸附法制备以EGCG 改性的PET 人工韧带(E-PET),并用相同的方法得到EGCG 和Fn 共同改性的PET 人工韧带(E-Fn-PET)。随后,将rhBMP-2 通过冷冻干燥负载到E-Fn-PET 的表面,制得rhBMP-2 修饰的B/E-Fn-PET。本文通过一系列细胞水平的评价验证了改性后PET 表面的生物相容性和诱导成骨活性,证实了B/E-Fn-PET 表面的良好生物相容性和高成骨活性。
1 实验部分
1.1 原料和试剂
PET 人工韧带:上海第六人民医院提供;EGCG、Fn:美国Sigma 公司;rhBMP-2:标准品,上海瑞邦生物材料有限公司;α-MEM 培养基、青链霉素混合液、胰蛋白酶、鬼笔环肽(FITC-Phalloidin)、4,6-二脒基-2-苯基吲哚(DAPI)、噻唑蓝(MTT)试剂:美国Gibco 公司;BMP-2 ELISA 试剂盒:上海欣博盛生物科技有限公司。
1.2 测试与表征
使用上海尔迪公司Femto A 型等离子表面处理仪,对材料进行表面羟基化处理;配有X 射线能谱分析的场发射扫描电子显微镜(SEM):日本日立集团公司S4800 型,将材料用导电胶固定在样品台上,真空状态下对样品喷金60 s,观察样品的表观形貌和测量样品表面元素组成;多功能酶标仪:美国Molecular Devices 公司SpectraMax M2 型,检测rhBMP-2 在样品表面的释放速率及rBMSCs 的细胞活性;伸缩式测角仪:中国上海中晨公司JC2000D2 型,通过固着滴落接触角法测定样品的亲水性,使用接触角测量仪,将3 μL 超纯水从针头中推出,滴落在样品表面,立即拍摄图像,通过软件对水滴图像进行分析,测量出水滴与接触面的角度;原子力显微镜(AFM):美国VEECO 公司Multimode VIII 型,测量表面粗糙度并通过NanoScope 软件对拍摄图片进行3D 效果模拟,得到样品表面的3D 形貌图像并比较表面粗糙度;激光共聚焦显微镜:日本尼康公司,拍摄荧光染色后的细胞状态;倒置显微镜:德国徕卡公司880 型,拍摄碱性磷酸酶(ALP)和茜素红染色。
1.3 B/E-Fn-PET 纳米改性涂层的制备
将PET 样品裁剪成1 cm×1 cm 的正方形,浸泡在w=75%的乙醇中,超声清洗30 min 后用大量去离子水冲洗材料表面,置于60 ℃干燥箱中干燥备用。将样品放入等离子体处理器腔体中,通入氧气,在70 W 的功率下连续处理60 s。选用足够量的溶液浸没PET 样品,通过静电吸附将10 μmol/mL 的EGCG、5 μg/mL 的Fn蛋白负载到材料表面,其余溶液保持在−20 ℃备用。利用磷酸盐(PBS)缓冲液将rhBMP-2 稀释至800 ng/mL,缓慢且均匀地滴加到E-Fn-PET 表面。将其于−20 ℃冷冻4 h 后,置于无菌冻干机中冷冻干燥48 h,得到B/E-Fn-PET 涂层(图1)。
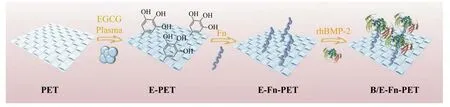
图1 B/E-Fn-PET 纳米涂层的制备Fig. 1 Preparation of the nano-coating B/E-Fn-PET
1.4 rhBMP-2 的固载及释放
为了探究rhBMP-2 在不同材料表面的释放情况,采用酶联免疫反应(ELISA)测定蛋白释放动力学曲线。根据ELISA 标准方法进行实验,其中自制rhBMP-2 标准品质量浓度分别为0、250、500、1 000、2 000 pg/mL。其中底物替换为底物A、B (底物A:3-(4-羟基)苯丙酸粉末0.0452 6 g 溶于11.3 mL 三(羟甲基)氨基甲烷-盐酸(Tris-HCl)缓冲液中;底物B:10 μL H2O2溶于11.3 mL Tris-HCl 缓冲液中)。经过37 ℃恒温震荡避光孵育30 min,通过终止液停止显色反应。使用酶标仪测量450 nm 处的吸光度(OD),此数据与结合的靶蛋白浓度呈正相关。
1.5 细胞生物学性能研究
1.5.1 纳米涂层表面的干细胞黏附 取2~5 代对数生长期的rBMSCs[19],经胰蛋白酶消化后添加2 mL 培养基吹打成单细胞悬液,将灭菌后的材料置于24 孔板中,表面滴加10 μL 高浓度细胞悬液静置15 min,添加1 mL 培养基培养24 h。培养结束后依次使用w=4%的多聚甲醛溶液固定细胞;使用w=0.1%的聚乙二醇辛基苯基醚(Triton X-100)溶液提高细胞的通透性;使用w=2%的FITC-Phalloidin 溶液和w=5%的DAPI 溶液分别对细胞骨架和细胞核进行荧光染色。采用激光共聚焦显微镜拍摄,判断细胞的黏附和铺展情况。
1.5.2 rBMSCs 在纳米涂层上的增殖 采用MTT 法对样品进行生物相容性检测,判断材料对细胞增殖情况的影响。按照GB/T 16 886.12—2005 提取浸提液并配制成条件培养基。将rBMSCs 以每孔2×103的密度接种于96 孔板上。将细胞置于37 ℃培养箱中贴壁培养24 h 后,每孔加入20 μL 的MTT 溶液和200 μL 的完全培养基,置于37 ℃培养箱中避光培养1、3、7 d 后,小心吸去上清液,避免枪头触碰蓝紫色沉淀物。每孔加200 μL DMSO 充分溶解,通过酶标仪检测490 nm 波长处的OD 值。在一定的细胞数量范围内,MTT 结晶量与细胞数目呈正相关,通过样品与空白对照组的对比可以判断出样品的细胞毒性。
1.5.3 ALP 染色和茜素红钙沉积染色评价材料的成骨活性 将2~5 代rBMSCs 以每孔2×104的密度接种于24 孔板上并用α-MEM 浸泡,按照国标GB/T 16886.12—2005 提取浸提液。用浸提液培养rBMSCs。培养7 d后移除培养基,清洗并固定细胞后使用碱性磷酸酶试剂盒对细胞进行染色,并用倒置显微镜进行观察。茜素红可以与细胞中的钙离子以螯合方式形成深红色沉淀,沉淀物即为钙结节。rBMSCs 在材料表面培养21 d后,清洗、固定细胞并使用茜素红染液染色30 min,弃去染色液,以PBS 缓冲液清洗2 次后,用倒置荧光显微镜拍摄,判断材料的成骨活性表达差异。
2 结果与讨论
2.1 表面形貌分析
图2 为PET 的水接触角变化情况。未处理PET 的水接触角为123°,亲水性极差。经过氧等离子处理后的PET,水滴落下的瞬间在PET 表面摊平,几乎测量不出接触角。由于引入了亲水的羟基,使处理后样品的亲水性显著提高,表明氧等离子体处理可以极大地改善PET 表面的亲水性。负载Fn 和rhBMP-2 后的水接触角为67°,在接入了蛋白类大分子后,PET 表面的润湿性反而变差。推测该种情况是由于Fn 和rhBMP-2 均为疏水蛋白所致。
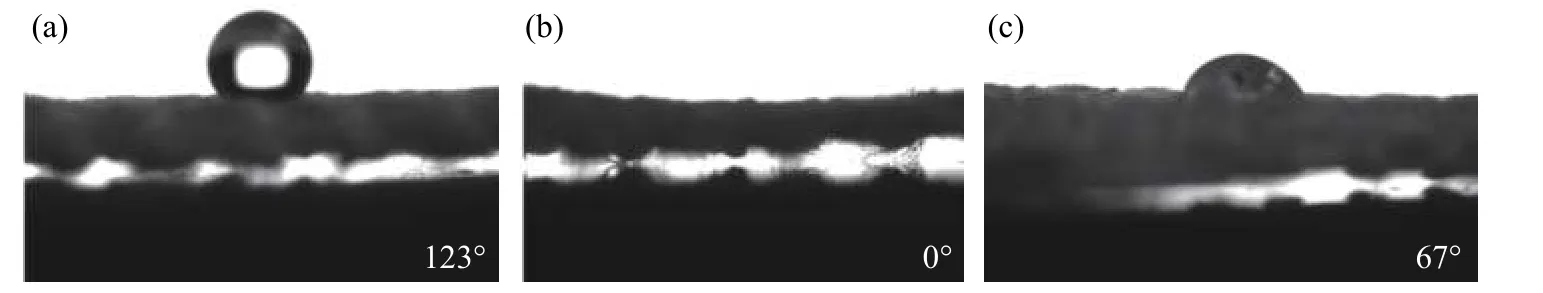
图2 PET 氧等离子体处理(a)前(b)后和(c)B/Fn-PET 的水接触角Fig. 2 Water contact angle of PET (a) before and (b) after treated by oxygen plasma and (c) B/Fn-PET
如图3 所示,未处理的PET 表面光滑并无其他附着物,单根纤维的直径约为25 μm。E-PET 和E-Fn-PET的表面与未处理的PET 表面相比,有更多微米级和纳米级颗粒的附着。含rhBMP-2 的3 组(B/PET、B/E-PET和B/E-Fn-PET)表面的附着物最多,推测其为冻干后附着在纤维表面的rhBMP-2。

图3 样品的SEM 照片Fig. 3 SEM images of samples
图4 比较了PET、E-Fn-PET 和B/E-Fn-PET 样品的表面粗糙度。未处理的PET 表面较为平坦,纤维熔喷过程中产生了0.31 μm 以下的轻微凸起。E-Fn-PET 表面的凸起约为26 μm,证明EGCG 和Fn 蛋白已固载于PET 表面。B/E-Fn-PET 表面凸起约为42 μm,表面粗糙度的明显增加证明rhBMP-2 已顺利固载于PET 材料表面。
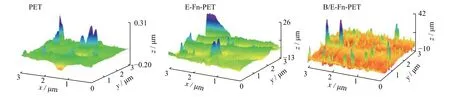
图4 不同纳米涂层表面的AFM 表观形貌比较Fig. 4 Comparison of AFM surface morphologies on the different nano-coating surfaces
2.2 rhBMP-2 的释放动力学
图5 显示了rhBMP-2 固载于PET 材料表面的释放曲线。rhBMP-2 的释放分为两个阶段,即前24 h 的突释和此后的持续释放。对于B/PET 上的rhBMP-2,大约有60.3%的rhBMP-2 在24 h 内从B/PET 表面累积释放,而后释放速率逐渐降低。B/EFn-PET 表面的rhBMP-2 在前24 h 的累积释放量仅为33.7%,有效降低了rhBMP-2 的突释速率。B/PET、B/E-PET、B/E-Fn-PET 的释放曲线表明,rhBMP-2 在第14 d 的累积释放量分别为90.6%、87.1%、63.7%。这些结果证实B/E-Fn-PET 减缓了rhBMP-2 的释放速率,使其具有持续释放特性。其原因是:在PET表面引入羟基基团增强了基底材料的吸附力,提高了材料表面的亲水性;表面带正电荷的EGCG 通过静电吸附作用与带负电的羟基基团作用包覆于样品表面;EGCG 的邻苯二酚基团对蛋白质的偶联将Fn 蛋白固定在样品表面,Fn 蛋白分子的每个亚基都具有与rhBMP-2 的高亲和力结合位点,从而增强了与rhBMP-2分子的结合能力,降低了rhBMP-2 的使用剂量,减缓了其释放速率。
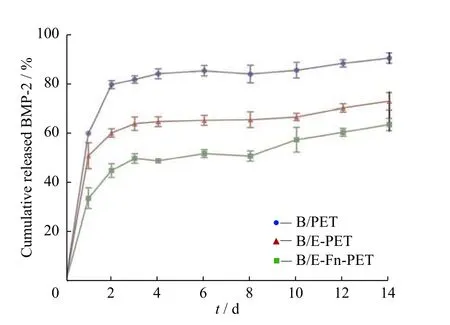
图5 rhBMP-2 的累积释放曲线Fig. 5 Cumulative release curves of rhBMP-2
2.3 表面改性对细胞黏附增殖的影响
成骨细胞在材料表面的黏附和铺展是影响后续细胞生长、繁殖和分化等一系列生物学行为的关键。图6对比了rBMSCs 在不同PET 表面共培养24 h 后细胞的黏附铺展情况。如图6 所示,经过24 h 的培养rBMSCs 在各样品表面均已铺展开。由于PET 属于生物惰性材料,表面光滑不易与细胞发生作用,在未处理的PET 表面接种的细胞黏附形态最差;E-Fn-PET 的表面细胞黏附效果优于E-PET 的效果,其原因在于Fn 对细胞黏附和铺展有促进作用。实验结果证实Fn 蛋白和EGCG 分子存在协同作用,在两者共同作用下促进了rBMSCs 在PET 表面的黏附和铺展。
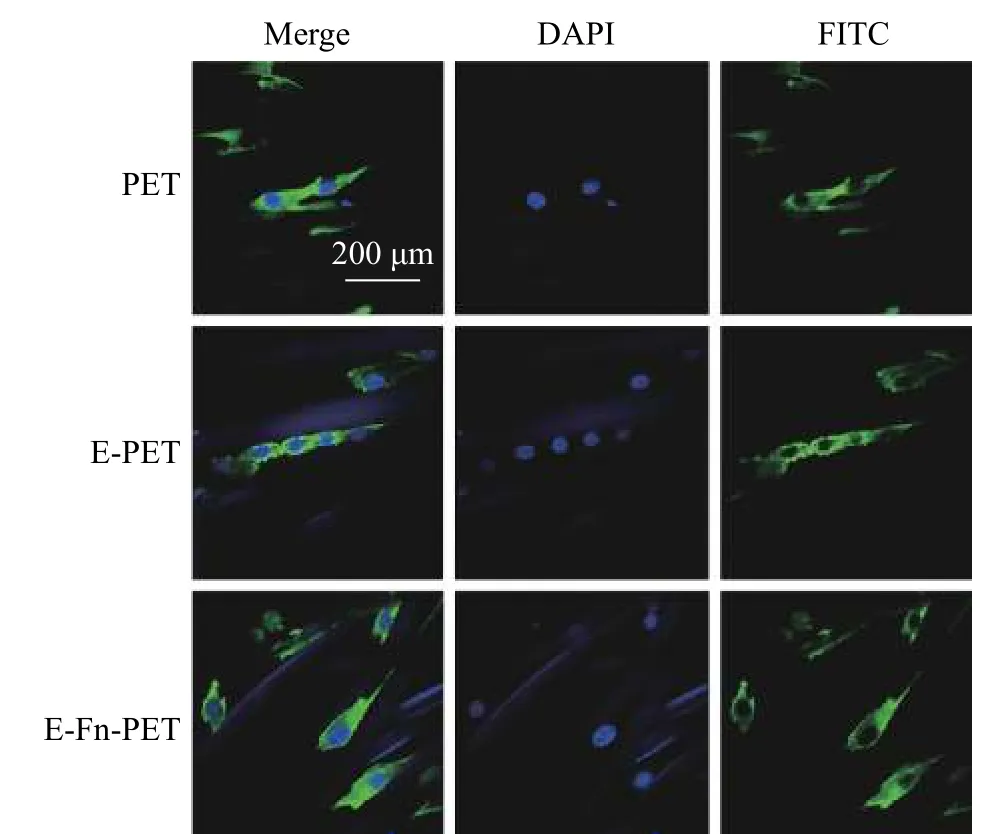
图6 rBMSCs 在PET、E-PET 和E-Fn-PET 表面的形态Fig. 6 rBMSCs morphology on the surfaces of PET, E-PET, and E-Fn-PET
图7 显示了rBMSCs 在不同PET 表面的增殖情况。当t=1 d 时,各样品的细胞增殖情况没有明显区别,表明处理后的PET 细胞毒性小,处理过程对细胞生存率的影响较小。当t=3 d 时,添加了rhBMP-2 的3 组样品细胞增殖速率明显提升,尤其是B/E-Fn-PET 表面培养的细胞增殖速率最高。当t=7 d 时,各样品的增殖情况相较于对照组均有显著提升。其中B/E-Fn-P 表面的细胞增殖速率明显高于其他样品,表明EGCG、Fn 和rhBMP-2 共同促进了rBMSCs 的增殖。综上所述,载有rhBMP-2 的纳米涂层通过叁者协同作用调控细胞的黏附和生长,进而促进rBMSCs 的增殖行为。
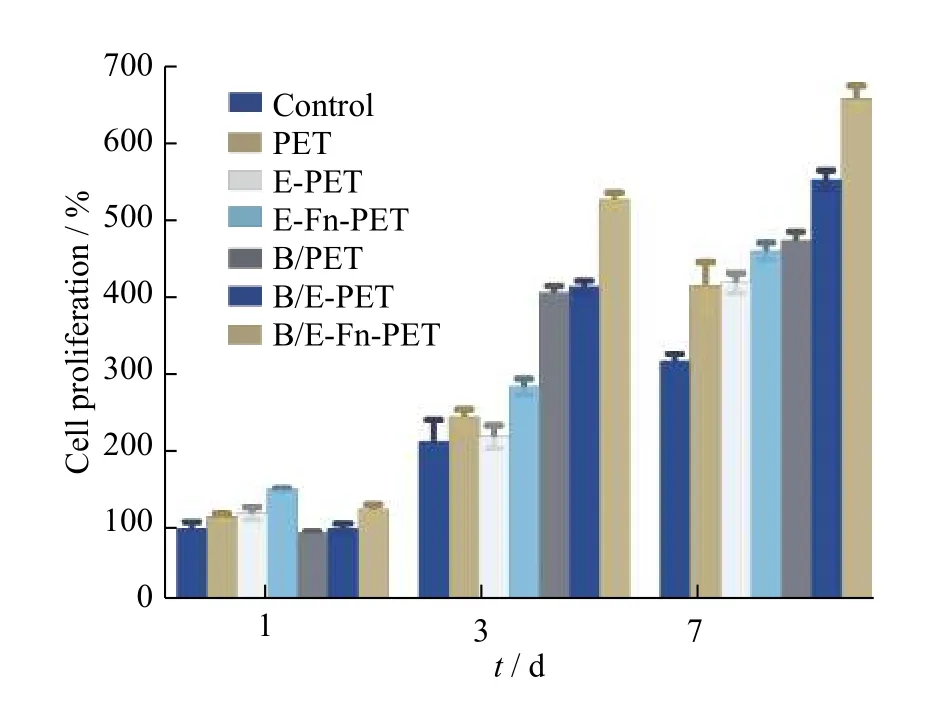
图7 rBMSCs 在不同PET 表面上培养后的细胞增殖行为Fig. 7 Cell proliferation of rBMSCs after cultured on the surfaces of different PET
2.4 不同PET 表面的ALP 染色和茜素红染色比较
图8(a) 显示了rBMSCs 在不同PET 材料表面培养7 d 的ALP 染色情况,ALP 是早期成骨细胞分化的标志物,其活性升高表明细胞发生了成骨分化。含rhBMP-2 的3 组(B/PET、B/E-PET 和B/E-Fn-PET)呈现出颜色更深的紫色沉淀,证明rhBMP-2 促进了rBMSCs 的成骨分化。图8(b) 通过对ALP 染色的定量分析显示,rBMSCs 在B/E-Fn-PET 上的ALP 活性明显高于其他样品,表明B/E-Fn-PET 显著地提高了rBMSCs 细胞的成骨分化能力。本文中通过EGCG 和Fn 蛋白引入低剂量的rhBMP-2 活性因子,在使用800 ng/cm2的低剂量条件下仍有利于ALP 的表达,并促进rBMSCs 的成骨分化。
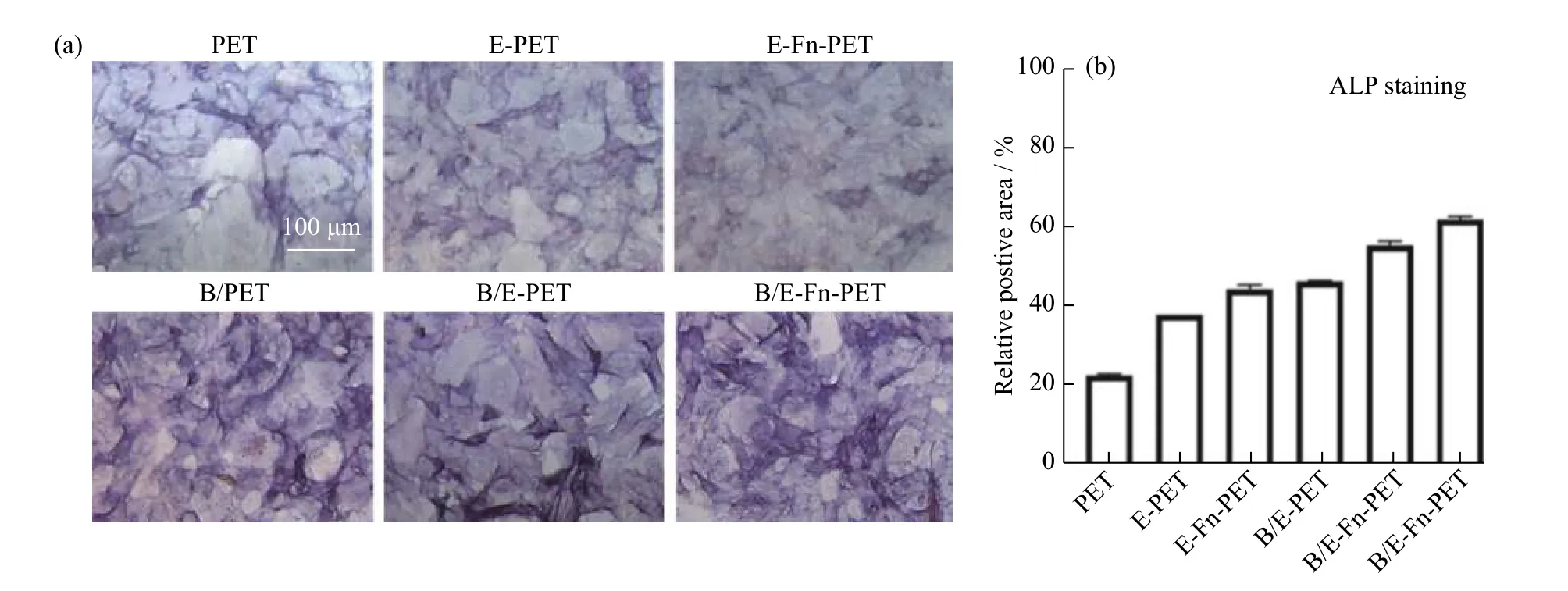
图8 rBMSCs 在各PET 样品中培养7 d 后的ALP 染色比较Fig. 8 ALP staining of rBMSCs on different PET surfaces cultured for 7 d
图9(a) 显示了rBMSCs 在不同PET 材料表面培养21 d 的茜素红染色情况。各培养物中均出现了明显的钙结节沉淀,其中添加了rhBMP-2(B/PET、B/E-PET、B/E-Fn-PET)样品的矿化表达明显高于不含rhBMP-2的样品,深红色矿化结节更多。图9(b) 为对钙结节的定量分析,B/E-Fn-P 产生的钙结节最多,表明EGCG 与Fn 的协同作用可以明显促进rhBMP-2 的成骨诱导作用并加速矿化进程。
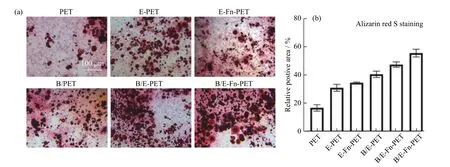
图9 rBMSCs 在各PET 样品中培养21 d 后的茜素红染色Fig. 9 Alizarin red S staining of rBMSCs on different PET surfaces cultured for 21 d
3 结 论
(1)通过表面改性制备的新型韧带纤维材料B/E-Fn-PET,可有效促进rBMSCs 的成骨分化并迅速诱导骨再生,显著改善生物惰性植入物的骨整合性能。
(2)EGCG、Fn 纤连蛋白和rhBMP-2 具有协同作用,可有效促进rBMSCs 的黏附、增殖及成骨分化,从而促进骨组织的修复。
(3)B/E-Fn-PET 不仅显示出优异的细胞相容性,还具备高诱骨活性,有望成为人工韧带应用的新型纳米涂层材料。

