芍药苷在溃疡性结肠炎中通过靶向NF-κB信号通路调控Th17/Treg平衡
宗 伟,闫春英,张 蓉(陕西省人民医院消化内一科,西安 710068;通讯作者,E-mail:iamzongwei@126.com)
溃疡性结肠炎(ulcerative colitis,UC)是一种难治性结肠炎症性疾病[1],但其发病机制尚不清楚。目前,UC的治疗方法包括手术治疗和药物治疗。除了常规使用的皮质类固醇和氨基水杨酸外,包括抗肿瘤坏死因子抗体在内的许多新药也被广泛应用于临床[2]。然而,UC往往在治疗后的一段时间内复发,并且可以引起包括恶心和头痛在内的多种不良反应,给患者及其家属带来严重的经济和精神困扰[2]。因此,了解溃疡性结肠炎的发病机制,寻找有效治疗溃疡性结肠炎的药物迫在眉睫。芍药苷(paeoniflorin,PF)是从中药白芍中提取的一种白芍总苷,占白芍总苷的90%,分子式为C23H28O11[3]。多项研究显示,芍药苷具有抗炎、抗癌、保肝、调节免疫以及影响细胞增殖等多种药理作用[4,5]。最近的研究报道,芍药苷对三硝基苯磺酸(TNBS)诱导的UC小鼠模型具有良好的抗炎作用[6]。然而,芍药苷治疗UC的确切机制仍未完全阐明。
T细胞在免疫系统中占有重要地位[7]。实验表明,在炎症性肠病中,局部CD4+T细胞浸润并出现功能异常[8]。CD4+T细胞主要包括Th1、Th2、Th17和Treg细胞4个亚群[9]。在正常情况下,体内Th17和Treg处于动态平衡状态,相互调节,从而维持体内环境的稳定。如果Th17和Treg失衡,组织和器官就会发生炎症,从而导致疾病。在UC的发育过程中,Th17细胞的过度表达和Treg细胞的缺乏导致肠道炎症[10]。Th17细胞分化受转化生长因子-β(transforming growth factor-β,TGF-β)/白细胞介素-6(interleukin-6,IL-6)或IL-21的调节,需要关键转录因子视黄酸相关孤儿受体γt(retinoic acid related orphan receptor-γt,ROR-γt)的参与[11]。叉头盒蛋白P3(forkhead box P3,FOXP3)是调节Treg细胞分化的重要转录因子,FOXP3缺失会损害Treg细胞的功能[12]。在UC患者中,Th17/Treg动态平衡被破坏。因此,抑制Th17细胞分化、刺激Treg细胞发育可能是治疗UC的有效途径。
先前的研究证实,机体在受到外界刺激后,通过髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖的信号通路启动先天免疫反应,上调Toll样受体4(Toll-likereceptor 4,TLR4)的表达,激活NF-κB,从而导致肠黏膜上皮的严重异常[13]。UC患者结肠黏膜NF-κB信号通路异常激活导致肠道炎症持续加重,成为UC患者药物治疗的靶点[14]。此外,NF-κB在由T、B细胞介导的特异性免疫反应中发挥作用,提示Th17/Treg平衡可能与NF-κB存在关联[15,16]。
基于以上阐述,本研究推测Th17/Treg与NF-κB相互影响介导炎症发生,芍药苷通过靶向调控NF-κB信号通路来调节Th17/Treg平衡,从而抑制过度的炎症反应,发挥治疗UC的作用。因此,本研究通过构建溃疡性结肠炎大鼠模型,然后给予不同浓度芍药苷处理,观察大鼠结肠组织病理性变化、信号通路以及相关因子的表达变化情况,旨在验证上述假说,从而深入揭示芍药苷治疗UC的分子机制,为抗UC新药研发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验试剂 芍药苷购自滁州仕诺达生物科技有限公司。5%三硝基苯磺酸(TNBS)购自美国Sigma-Aldrich公司。苏木精伊红(HE)试剂盒购自碧云天生物技术研究所。Trizol试剂购自美国Invitrogen公司。两步法反转录试剂盒购自瑞士罗氏公司。AceQ qPCR SYBR Green Master Mix购自南京诺唯赞生物科技有限公司。总蛋白提取试剂盒、BCA试剂盒购自江苏凯基生物技术股份有限公司。本研究中所有抗体均购自英国Abcam公司。
1.1.2 实验动物 24只7~8周龄SPF级雄性Sprague-Dawley(SD)大鼠(体质量200~220 g)由西安交通大学实验动物中心提供,生产许可证SCXK(陕)2020-001。大鼠在(25 ±1)℃、相对湿度60%~65%、12 h明暗循环照明条件下饲养,不限制饮食。
1.2 方法
1.2.1 动物分组及大鼠UC模型建立 适应环境1周后,SD大鼠随机分为4组:正常组、模型组、低剂量组和高剂量组。正常组大鼠不进行造模和给药处理,模型组大鼠给予100 mg/kg TNBS给药处理,低剂量组大鼠给予100 mg/kg TNBS+10 mg/kg芍药苷给药处理,高剂量组大鼠给予100 mg/kg TNBS+100 mg/kg芍药苷给药处理,每组6只大鼠。
利用TNBS造模,将5%TNBS与无水乙醇按照体积比为1 ∶1配成25 mg/ml的混合液。对于模型组、低剂量组和高剂量组大鼠,将润滑后的聚丙烯管由肛门轻缓插入深约8 cm处,推注100 mg/kg(0.4 ml/100 g体质量)TNBS溶液,连续推注14 d。正常组大鼠推注等体积的蒸馏水。将芍药苷溶于二甲基亚枫 ∶Tween 80 ∶生理盐水(1 ∶1 ∶18)混合溶液中。低剂量组和高剂量组大鼠在TNBS给药基础上分别灌胃10 mg/kg和100 mg/kg的芍药苷混合溶液,其他组大鼠灌胃等体积溶剂,连续治疗14 d。治疗结束后对大鼠进行疾病活动指数(DAI),然后分离结肠组织进行组织病理学检查。
1.2.2 大鼠结肠组织分离 治疗14 d后,用氯胺酮(110 mg/kg)/赛拉嗪(10 mg/kg)麻醉大鼠,腹主动脉穿刺取血,3 000 r/min离心20 min,-80 ℃冰箱保存。另外,分离大鼠结肠,PBS冲洗后用游标卡尺测量结肠长度。将一部分结肠固定在4%多聚甲醛中用于组织病理学检查和免疫组化染色。另一部分结肠组织保存于-80 ℃用于Western blot检验。
1.2.3 疾病活动指数(DAI) 参考文献[17]方法,根据体质量、大便特征和大便中的血液对大鼠进行评分。0分表示无体质量下降,大便正常,大便无血;1分表示体质量下降1%~5%,大便疏松,大便隐血;2分表示体质量下降5%~10%,大便疏松,大便隐血;3分表示体质量下降10%~15%,腹泻,便血;4分表示体质量下降15%以上,腹泻,便血。
1.2.4 苏木精-伊红染色检测结肠组织学变化 取大鼠结肠组织用10%多聚甲醛固定,脱钙、脱水、渗透、石蜡包埋,用切片机切成4 μm厚的切片。切片用二甲苯脱蜡,用梯度乙醇水化,然后用苏木素和伊红(HE)染色,显微镜下观察组织学变化。
1.2.5 脾脏T淋巴细胞的分离和流式细胞术分析脾脏中Th17细胞和Treg细胞水平 分离大鼠脾脏,放在100目不锈钢网上研磨得到细胞悬液,然后过滤,去掉结缔组织。将淋巴细胞分离液加入另一无菌试管中。将上述制备的细胞悬液缓慢加入试管中。淋巴细胞分离液与细胞悬液体积比为1 ∶2,加入红细胞裂解液,1 500 r/min离心20 min。然后,可以看到非细胞成分和细胞碎片在上层,中间层是单核细胞,红细胞在下层。将单核细胞层吸进另一个无菌试管中,加入PBS 1 000 r/min离心10 min,共2次。将洗涤后的细胞加入1640培养基和20%血清悬液,缓慢加入制备好的尼龙毛柱,密封,37 ℃孵育1 h,1 h后取出,在超净平台上竖立,将无菌管置于针下。用Hanks液和血清洗柱,洗脱液中的主要细胞为T淋巴细胞。取T淋巴细胞单细胞悬液用标准抗体对细胞进行表面标记染色。选择抗CD4和IL-17A抗体进行Th17细胞染色,选择抗CD3、CD4、CD25和FOXP3进行Treg染色。最后,流式细胞术用于分析染色的细胞。
1.2.6 免疫组化染色检测结肠组织p-P65、ROR-γt和FOXP3的阳性表达 大鼠结肠组织在4%多聚甲醛中固定30~60 min,石蜡包埋,切成4 μm厚的切片。切片经脱蜡、水化、3%H2O2灭活内源酶后,浸入0.01 mol/L柠檬酸盐进行抗原修复。切片用5%牛血清白蛋白封闭20 min,然后与p-P65(1 ∶1 000稀释)、ROR-γt(1 ∶500稀释)和FOXP3(1 ∶500稀释)一抗在4 ℃过夜孵育,PBS洗涤2~3次。随后将切片与生物素化的IgG(1 ∶500稀释)在37 ℃下孵育20 min,用PBS洗涤3次,用DAB显色,苏木精复染,蒸馏水洗涤,脱水、透明、树脂封片、显微镜观察。
1.2.7 qRT-PCR分析结肠组织IL-6、TGF-β1、TNF-α、IL-10、IL-17、FOXP3和ROR-γt mRNA表达 使用Trizol试剂提取大鼠结肠组织的总RNA。分光光度计来评估RNA质量。使用两步法反转录试剂盒对提取的RNA进行反转录。将获得的cDNA保存在-80 ℃的冰箱中。使用AceQ qPCR SYBR Green Master Mix在Bio-Rad iQ5实时荧光定量PCR仪(美国Bio-Rad公司)上进行RT-PCR。PCR的反应条件如下:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 20 s,70 ℃ 10 s,40个循环。β-actin作为内部对照,使用2-ΔΔCt计算目的mRNA的相对水平。引物序列见表1。
1.2.8 Western blotting分析结肠组织p65和p-P65的蛋白表达水平 使用总蛋白提取试剂盒提取结肠组织总蛋白,用BCA试剂盒测定总蛋白浓度。通过10%SDS-PAGE电泳分离蛋白,然后转移到硝酸纤维素膜上。将膜用10%胎牛血清封闭1 h,然后与p65(1 ∶1 000稀释)、p-P65(1 ∶1 000稀释)和β-actin(1 ∶2 000稀释)一抗在4 ℃过夜孵育,然后使用TBST洗3次,与辣根过氧化物酶标记的IgG二抗(1 ∶2 000稀释)室温孵育1 h。用TBST洗涤后,用增强化学发光试剂显影。β-actin作为内部对照使用伯乐ChemiDocTMXRS+凝胶成像分析系统测定膜蛋白条带密度。

表1 IL-6、TGF-β1、TNF-α、IL-10、IL-17、FOXP3、ROR-γt和β-actin的引物序列

1.3 统计学分析
数据采用SPSS21.0软件进行分析,以平均数±标准差表示。样本间差异比较采用单因素方差分析及LSD事后检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 芍药苷对UC大鼠结肠长度的影响
各组大鼠的结肠长度差异有统计学意义(F=70.979,P<0.001)。与正常组相比,模型组大鼠的结肠长度显著缩短(P<0.05);与模型组相比,低剂量组和高剂量组大鼠的结肠长度显著增加(P<0.05,见图1)。
2.2 芍药苷对UC大鼠疾病活动指数(DAI)评分的影响
各组大鼠的DAI评分差异有统计学意义(F=17.460,P<0.001)。与正常组相比,模型组的DAI评分显著升高(P<0.05);与模型组相比,低剂量组和高剂量组的DAI评分显著降低(P<0.05,见图2)。

与正常组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,&P<0.05图1 芍药苷对UC大鼠结肠长度的影响Figure 1 Effects of paeoniflorin on colon length in UC rats

与正常组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,&P<0.05图2 芍药苷对UC大鼠疾病活动指数评分的影响Figure 2 Effects of paeoniflorin on disease activity index score in UC rats
2.3 芍药苷对UC大鼠结肠形态的影响
苏木精-伊红染色显示,正常组未见大鼠结肠的明显损伤。相比之下,模型组大鼠结肠黏膜损伤严重,表现为充血、水肿、大量炎性细胞浸润,上皮破裂、隐窝变形和杯状细胞丢失。然而,低剂量组和高剂量组大鼠的结肠形态有所改善,结构破坏明显缓解,仅出现轻微的炎症细胞浸润(见图3)。

黑色箭头表示充血、水肿;红色箭头表示炎性细胞浸润;蓝色箭头表示:上皮破裂、隐窝变形图3 芍药苷对UC大鼠结肠形态的影响 (×200)Figure 3 Effects of paeoniflorin on colon morphology in UC rats (×200)
2.4 芍药苷对UC大鼠脾脏Th17/Treg平衡的影响
流式细胞术分析显示,各组大鼠脾脏中Th17细胞、Treg细胞在CD4+细胞中的占比和Th17/Treg比率差异有统计学意义(P<0.001,见表2和图4)。与正常组相比,模型组的Th17细胞占比和Th17/Treg比率显著升高,而Treg细胞占比显著降低(P<0.05);与模型组相比,低剂量组和高剂量组的Th17细胞占比和Th17/Treg比率显著降低,而Treg细胞占比显著升高(P<0.05)。
2.5 芍药苷对UC大鼠结肠组织中Th17和Treg细胞相关基因表达的影响
qRT-PCR检测结果显示,各组大鼠结肠组织中IL-6、TGF-β1、TNF-α、IL-10、IL-17、FOXP3和ROR-γt的mRNA表达水平差异有统计学意义(P<0.001,见图5)。与正常组相比,模型组的IL-6、TNF-α、IL-17和ROR-γt的mRNA表达水平显著升高,而TGF-β1、IL-10和FOXP3的mRNA表达水平显著降低(P<0.05);与模型组相比,低剂量组和高剂量组的IL-6、TNF-α、IL-17和ROR-γt的mRNA表达水平显著降低,而TGF-β1、IL-10和FOXP3的mRNA表达水平显著升高(P<0.05,见图5)。免疫组化染色中ROR-γt和FOXP3的蛋白表达变化与qRT-PCR中的ROR-γt和FOXP3的mRNA变化趋势一致(见图6)。

表2 芍药苷对UC大鼠脾脏中Th17和Treg细胞在CD4+细胞中的占比及Th17/Treg比率的影响

图4 芍药苷对UC大鼠脾脏Th17/Treg细胞比例的影响Figure 4 Effects of paeoniflorin on the ratio of Th17/Treg cells in spleen of UC rats
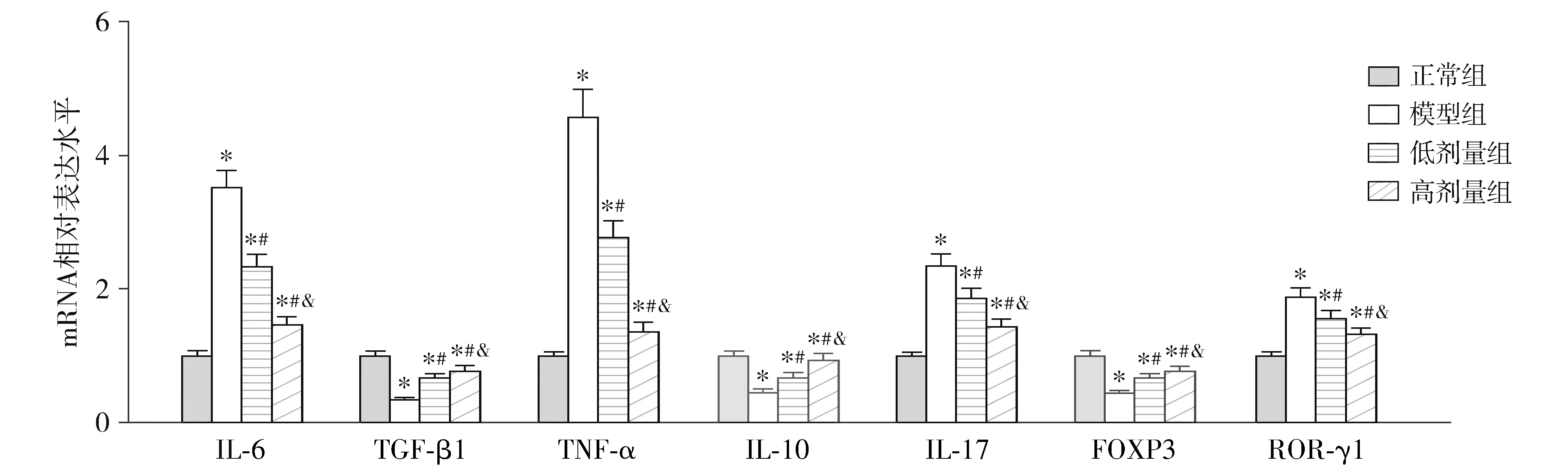
与正常组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,&P<0.05图5 芍药苷对UC大鼠结肠组织中IL-6、TGF-β1、TNF-α、IL-10、IL-17、FOXP3和ROR-γt mRNA表达水平的影响Figure 5 Effects of paeoniflorin on the mRNA expression levels of IL-6, TGF-β1, TNF-α, IL-10, IL-17, FOXP3 and ROR-γt in the colon tissue of UC rats

图6 芍药苷对UC大鼠结肠组织中ROR-γt和FOXP3蛋白表达水平的影响 (免疫组化,×200)Figure 6 Effects of paeoniflorin on the protein expression levels of ROR-γt and FOXP3 in the colon tissue of UC rats (mmunohistochemistry,×200)
2.6 芍药苷对UC大鼠结肠组织中NF-κB信号通路的影响
Western blot结果显示,各组大鼠的P65磷酸化水平差异有统计学意义(F=18.614,P<0.001)。与正常组相比,模型组的P65磷酸化水平显著升高(P<0.05);与模型组相比,低剂量组和高剂量组的P65磷酸化水平均显著降低(P<0.05,见图7)。
免疫组化和免疫荧光染色结果均显示,正常组有少量P65蛋白移位至细胞核,而模型组细胞核中P65蛋白表达水平较高;与模型组相比,低剂量组和高剂量组的细胞核中P65蛋白表达水平降低(见图8和图9)。
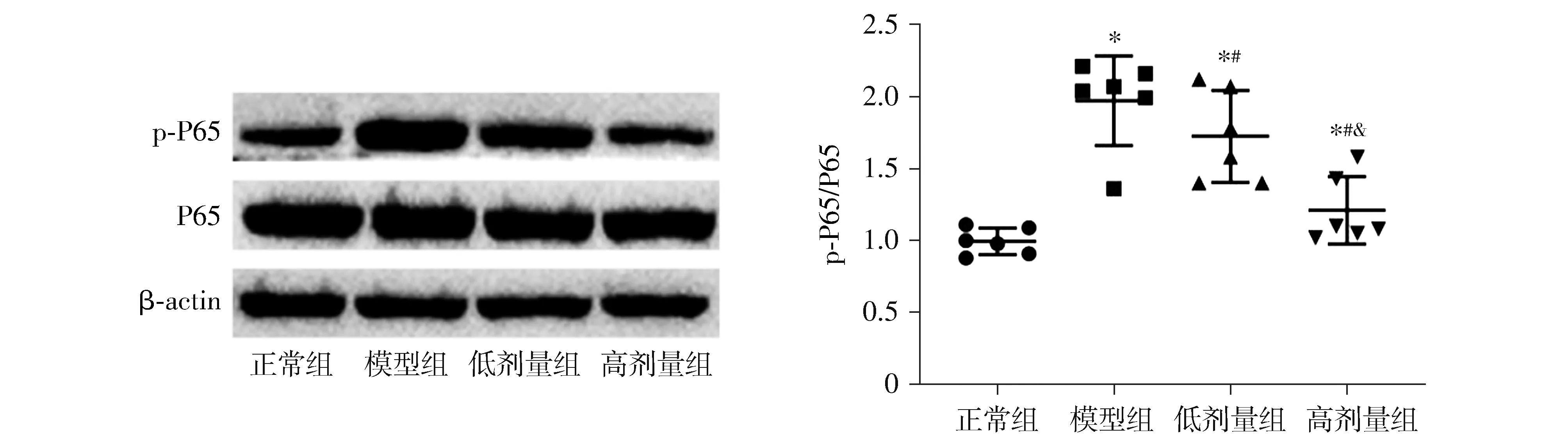
与正常组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,&P<0.05图7 芍药苷对UC大鼠结肠组织中P65的磷酸化水平的影响Figure 7 Effects of paeoniflorin on the phosphorylation of P65 in colon tissue of UC rats

图8 芍药苷对UC大鼠结肠组织细胞核中P65蛋白表达水平的影响 (免疫荧光染色,×200)Figure 8 Effects of paeoniflorin on the protein expression level of P65 in the nucleus of UC rat colon tissue (immunofluorescence staining,×200)

图9 芍药苷对UC大鼠结肠组织中p-P65的蛋白表达水平的影响 (免疫组化,×200)Figure 9 Effects of paeoniflorin on the protein expression level of p-P65 in colon tissue of UC rats (immunohistochemistry,×200)
3 讨论
目前,芍药苷的药理学作用已经被广泛报道,尤其是其抗炎和免疫调节作用。Wu等[18]研究显示,芍药苷显著抑制了内毒素刺激的人Caco-2细胞的环氧合酶-2、诱导型一氧化氮合酶、TNF-α、IL-6和基质金属蛋白酶-9的表达。此外,芍药苷激活了NRF2/HO-1信号通路并抑制了NF-κB信号通路[18]。Zheng等[19]研究显示芍药苷可抑制TNBS诱导的UC小鼠树突状细胞(DC)表面MHC-Ⅱ和CD86的表达,降低IL-12的分泌,恢复TH17/Treg比值,提示芍药苷可通过调节DC介导的TH17/Treg平衡来改善TNBS诱导的UC。在本研究中,芍药苷以剂量依赖性方式增加了UC大鼠结肠长度,降低了DAI评分,改善了结肠形态,充分证实了芍药苷对UC的治疗作用。
辅助性T细胞(Th细胞),也被称为CD4+T细胞,是免疫应答的重要组成部分。Th17和Treg细胞是两种类型的CD4+T细胞,它们在调节免疫反应方面具有相反的功能。Th17和Treg细胞之间的相互结合负责维持免疫稳态[20]。研究表明,肠道环境的稳定取决于各种免疫细胞比例和数量以及不同细胞因子的动态平衡。在这些肠道免疫细胞中,CD4+T细胞在介导体内免疫平衡反应中起着至关重要的作用。越来越多的数据表明Th1/Th2细胞在UC的发生发展过程中起着重要作用。然而,自从发现Th17细胞以来,Th17细胞反应已被证实是UC患者炎症反应的主要促进因素,Th17/Treg细胞与其衍生的细胞因子之间的失衡可能参与了UC的发病[21]。Th17细胞是另一种不同于传统Th1和Th2细胞的CD4+效应T细胞亚群,可介导炎症反应并参与自身免疫性疾病、移植排斥和肿瘤的发展[22]。Th17细胞产生IL-17A、IL-17F、IL-22、IL-21等细胞因子,其分化需要多种因子,包括ROR-γt、信号转导和转录激活因子3(STAT3)等[23]。Th17细胞介导炎症反应,并在控制肠道炎症中发挥重要作用。研究表明,UC患者外周血中Th17细胞及其相关细胞因子水平显著升高[24]。相比之下,Treg细胞是抑制CD4+和CD8+T淋巴细胞活化和增殖的主要免疫调节细胞,在维持免疫耐受和抗炎方面发挥着关键作用。CD4+CD25+Treg细胞是目前研究中最常见的Treg细胞类型,通过细胞之间的直接接触、分泌细胞因子(如IL-10和TGF-β)和诱导细胞凋亡来发挥免疫调节功能[25]。本研究结果显示,芍药苷显著降低了UC大鼠脾脏Th17细胞占比和Th17/Treg比率,而显著升高Treg细胞占比,从而纠正了Th17/Treg平衡。这些结果证实芍药苷对UC的治疗机制与纠正Th17/Treg平衡有密切的关系。
越来越多的证据表明,UC患者外周血和肠道组织中多种促炎细胞因子的表达显著增加,这些细胞因子是肠道炎症启动和持续的关键病理生理因素[26]。IL-17、IL-6等Th17相关细胞因子与UC密切相关。Th17细胞通过分泌IL-17参与炎症反应,进而促进IL-6和TNF-α的产生。随着对UC发展过程中细胞因子反应的大量研究,抑制促炎细胞因子已成为UC治疗的一个新领域。除了抑制这些促炎介质的产生,增强抗炎因子的表达也是迫切需要的。TGF-β和IL-10是重要的抗炎细胞因子,主要由Treg细胞产生,参与调节炎症反应和维持免疫平衡。据报道,Th17/Treg细胞分化受不同转录因子和细胞因子的调节,它们可以根据不同的细胞因子环境相互转化。ROR-γt是一种针对Th17细胞的转录因子,可诱导初始辅助性T细胞中IL-17基因的转录。在ROR-γt缺陷小鼠中,Th17细胞已被证明显著减少[11]。相比之下,Treg细胞的特征是转录因子FOXP3的高表达,而且在初始T细胞中FOXP3的表达被证明是通过TGF-β依赖的信号通路促进的。TGF-β促进FOXP3的表达并间接诱导Treg细胞的生成[23]。本研究结果显示,芍药苷以剂量依赖性方式显著降低了UC大鼠结肠组织中IL-6、TNF-α、IL-17和ROR-γt的mRNA表达水平,而显著升高了TGF-β1、IL-10和FOXP3的mRNA表达水平。由于这些细胞因子不仅与Th17/Treg平衡有关,而且与抗炎/促炎有关。因此,这些结果证实芍药苷对UC的治疗机制与纠正Th17/Treg平衡有密切的关系。本研究提示芍药苷除了纠正UC大鼠Th17/Treg平衡之外,还抑制炎症介质的产生,并促进抗炎介质的产生。
研究发现,已有100余种基因可被NF-κB调控。其中与溃疡性结肠炎发病相关的因素如细胞因子TNF-α、IL-1β、IL-6、IL-10等都是NF-κB的激活因子,而这些物质中大多都含有κB位点,NF-κB可以调节这些分子的基因转录。因而,NF-κB的活化是UC发病过程中的一个重要环节,是多种抗炎症药物的靶标[27]。NF-κB含有p50和p65两个亚基。在静息状态下,NF-κB P50/P65二聚体与抑制性蛋白IκBα结合于胞质,呈无活性状态;当受到炎症刺激时,IκBα降解,NF-κB移位至核,结合于靶基因的NF-κB结合位点,启动基因转录。在UC组织中,NF-κB在胞质中的表达是炎症状态的反映。NF-κB活化后可增强TNF-α、IL-1β的基因转录,而TNF-α、IL-1β可再次激活NF-κB。UC患者结肠黏膜炎症组织NF-κB和蛋白表达较正常对照组增强,随炎症程度的增加而增高,且与UC病理分级正相关,表明NF-κB在UC炎症发生发展中起关键作用[28]。在免疫系统,NF-κB不仅广泛参与炎症介质等介导的非特异性免疫反应,同时在由T、B细胞介导的特异性免疫反应中发挥作用。在NF-κB活化过程中,作为调控T细胞向Treg分化的主要细胞因子IL-10和TGF-β分泌下降,使得T淋巴细胞分化偏向Th1型,可见NF-κB参与了Th1淋巴细胞免疫反应的调节[29]。而且NF-κB通过对淋巴细胞因子中RORγt、PDK1表达的调控间接调节Th17/Treg[30]。本研究结果显示,芍药苷显著抑制了p65的磷酸化水平并抑制了p65的核转位,从而抑制了NF-κB信号通路的活化。这些结果提示芍药苷可能通过靶向NF-κB信号通路及其下游细胞因子来调控Th17/Treg平衡,从而发挥其对UC的治疗作用。
综上所述,本研究结果表明芍药苷纠正了TNBS诱导的UC大鼠体内Th17/Treg平衡并抑制了NF-κB信号通路的活化,芍药苷可能通过靶向NF-κB信号通路来调控Th17/Treg平衡,从而发挥其对UC的治疗作用。这些结果充分说明芍药苷可能是治疗UC的候选天然药物。

