附子多糖对深低温保存腹主动脉线粒体结构和功能的影响
周树兰,王 成(遵义医科大学第五附属(珠海)医院手外科,珠海 519100;通讯作者,E-mail:906090860@qq.com)
目前动脉冷冻的难点是在冻融过程中即便消除溶质损伤和冰晶损伤,内皮细胞氧化应激和缺血再灌注损伤等事件将成为复苏后较长时间内依然发生血管活性丧失的刺激因素,造成血管生存极限;与此同时,以渗透性保护剂为主的二甲基亚砜作为器官冻存剂的毒性作用越来越引起人们的注意[1]。因此,不断寻找毒性小、敏感性高的冷冻保护剂,是动脉低温保存研究的焦点。
附子是一种著名的中药,具有补火助阳、温补肾阳、振奋心阳、散寒止痛等阳热功效,而深低温冻存环境阴寒,根据中医辩证思维,性大热的附子具有深低温冻存保护剂的潜在特性;另一方面,现代医学研究表明附子多糖(Fuzi polysaccharide,FPS)是来源于中药附子的主要活性成分之一,由葡萄糖和阿拉伯糖聚合而成[2],无毒[3],具有免疫调节、抗高血糖、抗炎、抗肿瘤等多种作用[4]。本课题组前期研究表明,FPS在深低温冻存中对腹主动脉组织层面有较好的保护作用[5]。为进一步探索其细胞分子保护机制,本研究观察了不同浓度附子多糖在深低温冻存中对腹主动脉线粒体结构和功能的影响,寻找其最佳保护浓度及保护机制。
1 材料与方法
1.1 实验动物
6~8周龄雄性SD大鼠48只,SPF级,体质量(190 ±30)g,购自长沙市天勤生物技术有限公司,动物许可证号SCXK(湘)2019-0014。
1.2 主要试剂与仪器
附子多糖(中山大学中西医结合研究所),线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性检测试剂盒(苏州科铭生物技术有限公司),线粒体提取试剂盒、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),超氧化物歧化酶(SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-PX)测定试盒、过氧化氢酶(CAT)测定试剂盒、丙二醛(MDA)测定试剂盒、ATP酶(Na+-K+-ATP酶、Ca2+-ATP酶)活力测定试剂盒(南京建成生物技术股份有限公司)。HT 7700透射电子显微镜(日本日立公司);UV-1200紫外-可见光分光光度计(安捷伦科技有限公司);全波段酶标仪(赛默飞世尔科技有限公司)。
1.3 样品预处理
无菌环境下显微镜取大鼠腹主动脉,置于培养皿中,4 ℃操作台上迅速去除残血、多余脂肪和结缔组织,滤纸吸干血管表面水分,于室温、无风环境内称取重量,并记录相应数据。随机将血管分为新鲜组、保存对照组(灭菌注射用水)和多糖保存组(附子多糖0.1,1,10,20 mg/ml),每个浓度各8只。新鲜组取材后立即进行线粒体内部超微结构采集分析,线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性,ATP酶(Na+-K+-ATP酶、Ca2+-ATP酶)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、过氧化氢酶(CAT)活力和丙二醛(MDA)含量等各项指标检测,保存对照组和多糖保存组取腹主动脉后于-196 ℃液氮中保存1周后进行上述各项指标检测。
1.4 线粒体提取及蛋白含量测定
新鲜组取腹主动脉后立即进行线粒体提取及蛋白含量测定,保存对照组和多糖保存组腹主动脉液氮保存1周后将冻存管置于37 ℃水浴锅内快速复温[6],待冰块融化后用生理盐水洗净血管表面附子多糖残留液,迅速放于无菌培养皿中并加入相应的提取液,4 ℃操作台上显微剪快速将血管组织修剪成约为2 mm×2 mm大小的组织块,修剪完成后将组织液倒入手持玻璃匀浆器中,根据线粒体提取试剂盒及线粒体蛋白浓度测定试剂盒进行腹主动脉线粒体提取和蛋白浓度测定,为保证线粒体结构和功能的稳定,操作全程均在4 ℃条件下完成。
1.5 线粒体功能指标检测
按照线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性测定试剂盒说明书进行操作检测。按照SOD检测试剂盒、GSH-Px检测试剂盒、CAT检测试剂盒和MDA检测试剂盒说明书操作,分别检测SOD、GSH-Px、CAT活力和MDA含量。分别按照ATP酶活力检测试剂盒说明书检测Na+-K+-ATP酶活力和Ca2+-ATP酶活力。
1.6 透射电镜观察线粒体内部超微结构并采集分析各组线粒体内外膜及基质变化
将血管组织修剪成截面为2 mm×2 mm的小组织块,将修剪好的小组织块快速转移至体积分数为4%多聚甲醛和2%戊二醛溶液固定过夜。之后用磷酸缓冲液(PBS,pH 7.4)漂洗3次,每次15 min;之后用1%锇酸避光室温固定2 h;PBS(pH 7.4)漂洗3次,每次15 min;组织块依次放入体积分数为30%,50%,70%,80%,95%,100%,100%乙醇溶液中脱水每次20 min和100%丙酮2次,每次15 min。丙酮和812包埋剂1 ∶1比例37 ℃ 2~4 h,丙酮和812包埋剂1 ∶2比例37 ℃过夜,纯812包埋剂37 ℃ 5~8 h。将组织块放入盛有812包埋剂的包埋箱中37 ℃烘箱静置24 h,后调整温度至于60 ℃烤箱聚合48 h,取出树脂块,超薄切片后150目方华膜铜网捞片。后用2%醋酸铀饱和酒精溶液避光染色8 min;70%乙醇清洗3次;超纯水清洗3次;2.6%枸橼酸铅溶液避二氧化碳染色8 min;超纯水清洗3次,滤纸吸干多余水分,放入铜网盒内室温干燥过夜。透射电镜下观察腹主动脉内皮、平滑肌纤维大体形态和线粒体内部结构。
1.7 统计学分析

2 结果
2.1 FPS在深低温保存中对腹主动脉线粒体蛋白浓度的影响
与新鲜组比较,保存对照组中线粒体蛋白大量降解(P<0.01);与保存对照组比较,多糖保存组线粒体蛋白的降解程度明显减轻,而且FPS浓度越高,蛋白浓度越高,当浓度达到FPS 10 mg/ml时,溶液达到饱和状态,此时蛋白浓度最高(P<0.01);与FPS 10 mg/ml组比较,FPS 20 mg/ml线粒体蛋白浓度呈下降趋势,差异无统计学意义(P>0.1,见图1)。
2.2 FPS在深低温保存中对复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性的影响
与新鲜组比较,保存对照组复合体活力明显降低(P<0.01)。与保存对照组比较,多糖保护组复合体活性逐渐增加,其中从1 mg/ml开始差异有统计学意义。其中浓度为10 mg/ml时,复合体活性达到最高,当继续增加FPS浓度时,复合体活性呈下降趋势(见表1)。

线粒体蛋白浓度比较,F=35.20,P<0.0001;与新鲜组比较,* *P<0.01;与保存对照组比较,##P<0.01图1 分光光度法测定深低温保存中线粒体蛋白的相对浓度Figure 1 The relative concentrations of mitochondrial proteins in cryopreservation by spectrophotometry
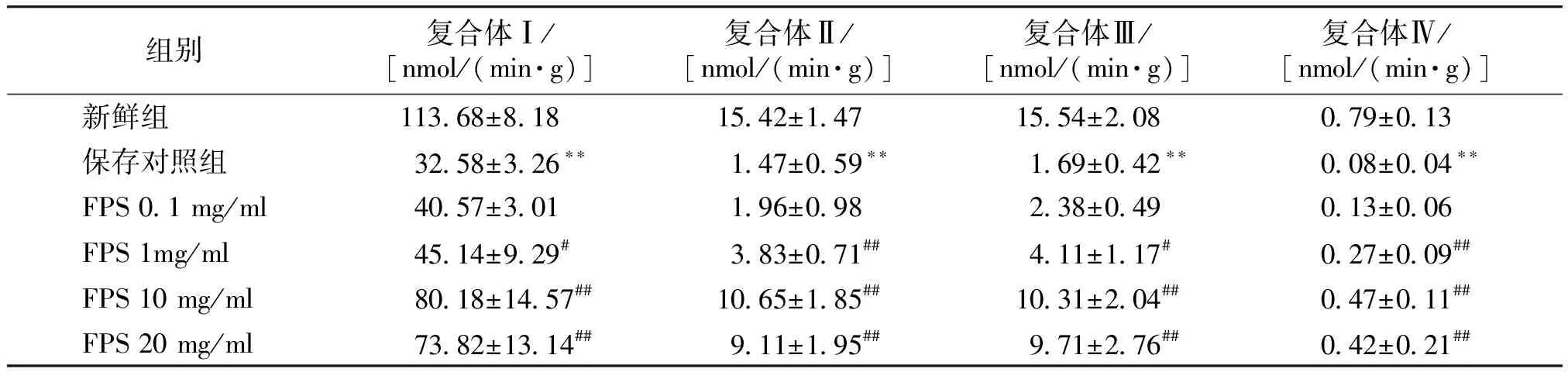
表1 深低温冻存中不同浓度FPS对腹主动脉线粒体呼吸链复合体活性的影响
2.3 FPS在深低温保存中对腹主动脉SOD、GSH-Px、CAT活力和MDA含量的影响
与新鲜组相比,保存对照组中抗氧化物酶SOD、GSH-Px、CAT活力明显降低(P<0.01),MDA含量明显升高(P<0.01);与保存对照组比较,加入不同浓度FPS处理后,多糖保存组SOD、GSH-Px、CAT活力逐渐上升,MDA含量逐渐下降,呈浓度依赖性;从1 mg/ml开始差异有统计学意义,FPS浓度达10 mg/ml时保护效应出现峰值(见表2)。
2.4 FPS在深低温保存中对腹主动脉Na+-K+-ATP酶、Ca2+-ATP酶活力的影响
与新鲜组相比,保存对照组中Na+-K+-ATP酶和Ca2+-ATP酶活力明显降低(P<0.01);与保存对照组比较,加入不同浓度的FPS干预后,多糖保存组血管组织中ATP酶活力随浓度增加而逐渐升高,这可能与FPS减轻呼吸链复合体损伤有关,并从1 mg/ml开始与保存对照组差异有统计学意义,其中10 mg/ml时ATP酶活力达高峰(见表3)。
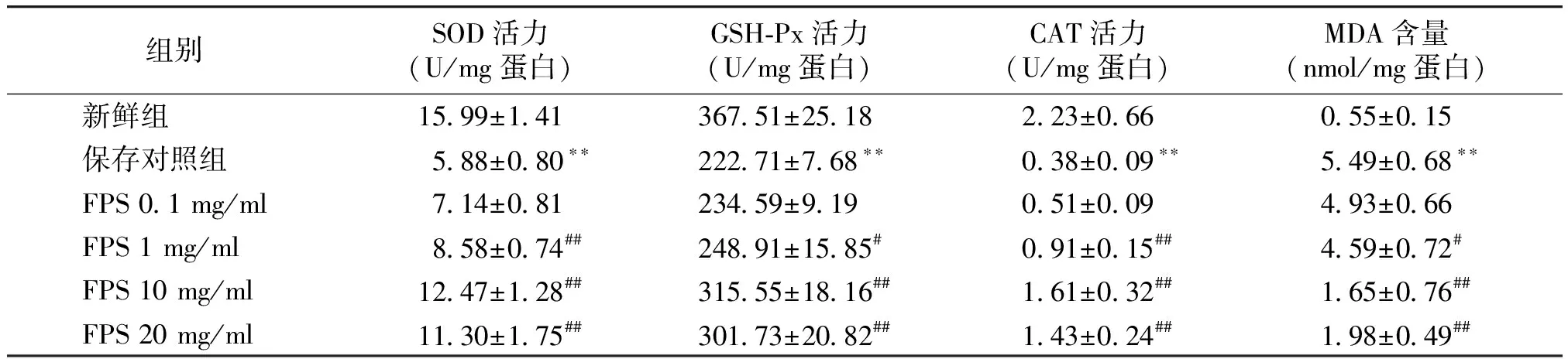
表2 FPS在深低温保存中对腹主动脉线粒体SOD、GSH-Px、CAT活力和MDA含量的影响

表3 深低温保存中不同浓度FPS对腹主动脉线粒体Na+-K+-ATP酶、Ca2+-ATP酶活力的影响
2.5 深低温保存中不同浓度FPS对腹主动脉平滑肌线粒体内部超微结构影响
新鲜组线粒体呈规则的椭圆型,轮廓分明,外膜光滑完整,内脊密集且清晰可见,基质分布均匀;深低温保存使线粒体均出现不同程度的肿胀,保存对照组线粒体内外膜完全破裂溶解呈碎片状,内脊几乎降解消失,内部基质呈透明状。FPS 0.1 mg/ml组线粒体内外膜开始出现破裂溶解,膜结构模糊,线粒体内脊开始大量降解减少,基质外流;FPS 1 mg/ml组线粒体外膜基本完整,但内部结构紊乱,内脊大部分断裂,基质减少;FPS 10 mg/ml组线粒体呈较为规则的圆形或卵圆形,这可能与线粒体动力学有关,轮廓较为分明,外膜完整光滑,基质分布较保存对照组明显增多,可见清晰线粒体内脊;FPS 20 mg/ml组线粒体形态大多数呈圆形,外膜光滑完整,内脊轮廓出现部分断裂不连续现象,基质分布均匀(见图2)。

图2 深低温保存中不同浓度FPS对腹主动脉平滑肌线粒体内部超微结构影响 (×25 000)Figure 2 The effect of different concentrations of FPS on the internal ultrastructure of abdominal aorta smooth muscle mitochondria under cryopreservation (×25 000)
3 讨论
目前普遍认同深低温保存具有长期保留生物器官组织活性[7]、降低组织器官免疫原性和抑制排斥反应[8]等作用,可以使组织器官得到有效复用。在这些器官组织移植中血管起到向移植部位供送血液的作用,只有血管保存成功了,才能保证移植器官或组织得到充分的血供,其成活才有希望。因此,冻存中血管结构和功能的完整性对后期组织器官存活非常重要。
FPS是由单糖组成的大分子化合物,研究发现,FPS通过降低低密度脂蛋白(oxidized low density lipoprotein,Ox-LDL)来抑制中性鞘磷脂酶(NSMase)/神经酰胺(ceramide,Cer)信号通路激活并增强机体自噬活性,显著改善血管钙化[9,10];以及通过阻断高迁移率族盒1(high-mobility group box 1,HMGB1)/晚期糖基化终末产物受体(advanced-glycation end products,RAGE)通路抑制IL-6、IL-1、TNF-α等炎症介质的释放,显著抑制血管炎症反应,减少缺血引起的血管损伤,以及通过提高细胞的吞噬活性及增加一氧化氮的生物利用度,改善血管内皮损伤[11];此外,值得注意的是,FPS能增强雪旺细胞的抗氧化能力、下调NADPH氧化酶-1(Nox1)水平,显著抑制高糖诱导的糖尿病周围神经氧化应激损伤[12]和通过较强的抗氧化能力减少肝脏缺血-再灌注损伤[13]。因此,FPS具有抗动脉粥样硬化、抗炎、增强自噬、免疫调节、抗缺血再灌注损伤、抗高血糖血症、抗氧化等多种生物学作用特性,这为冷冻保护剂研发提供了新思路。
线粒体是机体的能源工厂,也是调控凋亡、自噬、钙离子、生物膜电位稳态等多种细胞生理功能的细胞器,其结构和功能的变化直接调节细胞存活或死亡的信号。有氧环境下,线粒体通过三羧酸循环进行氧化磷酸化产生ATP,供应各组织细胞能量,其中线粒体呼吸链复合体扮演着重要角色,当外在因素使线粒体呼吸链损伤时将阻碍氧化磷酸化的进行,使能量合成减少,打破细胞生理平衡,从而导致组织器官功能衰竭,本实验中线粒体呼吸链复合体对低温很敏感,强烈的低温刺激后,线粒体呼吸链复合体活性显著下降;此外,线粒体呼吸链功能障碍将促进电子泄漏,有利于ROS大量产生[14],其中复合体Ⅰ、Ⅲ和复合物Ⅱ相关的琥珀酸介导产生的ROS是细胞内的主要来源[15],占细胞内ROS的45%[16]。除上诉外,复合体Ⅳ,即细胞色素c氧化酶(COX),被认为是氧化磷酸化的调节中心,它会被氧化磷酸化的最终产物ATP反馈抑制,而这种“变构ATP抑制”能保持低而健康的线粒体膜电位(放松状态),并阻止ROS的形成[17]。ROS是一种具有化学活性的分子,包括羟基自由基(OH-)、超氧阴离子(O2-)、和过氧化氢(H2O2)等[18],生理条件下,ROS参与细胞的代谢调控,在生物体内具有重要的功能;但当ROS积累上升到毒性水平时,将促使机体发生氧化应激,引起脂质、蛋白质和核酸,特别是DNA等大分子物结构破坏从而导致细胞损伤坏死[19]。生物体内存在完整的抗氧化系统,它由各种抗氧化物酶组成,包括SOD、GSH-Px和CAT,它能将氧自由基还原成H2O和O2[20],避免氧化损伤的发生;其中MDA是脂质过氧化最丰富的羰基产物,其含量高低间接反应了组织细胞氧化应激损伤的程度[21]。因此,线粒体呼吸链复合体功能损伤不仅影响氧化磷酸化,而且加重机体氧化应激损伤;而抗氧化物酶活性和MDA的含量则进一步反应了氧化损伤的程度。
此外,线粒体外膜和内膜上有大量的ATP酶离子通道,参与机体能量转换、电化学梯度维持、膜兴奋性控制、渗透平衡和物质运送等多个方面[22];因此,离子通道的开启或关闭可以调节线粒体膜电位、ROS的产生和影响呼吸链复合体的功能[23]。Na+-K+-ATP酶和Ca2+-ATP酶是生物膜上最常见的离子通道,它的活力依赖于细胞能量的变化,线粒体呼吸链损伤和过度的氧化应激将导致ATP酶活力下降,出现离子紊乱、钙超载、细胞高渗水肿等造成线粒体膜电位下降,从而加重线粒体膜损伤,导致细胞质到线粒体的流量过载[24,25]。
本研究中,深低温保存导致线粒体呈现膨胀直至破损,线粒体膜出现破裂崩塌,内容物流出减少消失,内嵴分裂和线粒体功能严重下降,从而影响远期血管能量代谢并加重氧化应激损伤,造成后期血管生存极限。随着FPS浓度升高,线粒体损伤程度减轻,线粒体结构趋于完整;同时,线粒体复合体Ⅰ~Ⅳ活性、ATP酶活力和抗氧化能力较保存对照组明显上升,并呈浓度依赖性,其高浓度的FPS较低浓度FPS保护效果好,其中FPS 10 mg/ml组保护效应可能较好。
综上所述,深低温保存造成了线粒体结构和功能损害,而FPS通过改善线粒体功能障碍并减轻组织氧化损伤,保护了深低温保存中腹主动脉线粒体结构和功能的稳定,从而明显提高细胞能量代谢储备,为后期血管生存保存体力。我们猜想这可能与某种线粒体分子通路有关,但其具体机制还有待实验阐明。

