基于非洲猪瘟病毒E199L 蛋白间接ELISA 方法的建立
范婷婷,何希君,2,张险峰,2*
(1.中国农业科学院哈尔滨兽医研究所病原与病理形态学创新团队,黑龙江 哈尔滨 150069;2.中国农业科学院哈尔滨兽医研究所国家动物疫病防控高级别生物安全实验室,黑龙江 哈尔滨 150069)
非洲猪瘟(African swine fever,ASF)是由ASF 病毒(ASFV)引起的一种广泛出血性、高度接触传播的猪烈性传染病,所有品种和日龄的猪均可感染,家猪高度易感,发病率和死亡率最高可达100%,威胁着全球养猪业。自2018 年8 月在辽宁确诊我国首例ASF 疫情以来,ASF 迅速在全国蔓延,到目前为止已经给我国养猪业造成严重经济损失。该病目前主要在欧洲、非洲及一些亚洲国家流行[1-2]。
ASFV 是一种有囊膜的复杂的核质大DNA 病毒(NCLDV),也是目前唯一已知核酸为DNA 的虫媒病毒。ASFV 基因组结构是对称的二十面体,含有若干同心层,呈六边形外观,包括末端反向重复、末端交联、中央保守区和基因组两端的可变区[3-5]。全长170 kb~190 kb 不等,含有150~167 个开放阅读框,可编码上百种蛋白。病毒蛋白功能多样,参与病毒形态发生、病毒复制、宿主免疫应答等过程,还有多种病毒蛋白的功能未知[1-4]。鉴定参与宿主免疫应答的病毒蛋白仍然是ASFV 研究中重要的任务之一。含有假定跨膜区的蛋白是重要关注点之一,因为它们可以被整合到病毒粒子的内膜或外膜和/或在感染细胞的表面表达。
ASFV E199L 蛋白是一种富含半胱氨酸的结构多肽,定位于病毒的内膜,是一种完整的跨膜蛋白,有良好的免疫原性[5-6]。本研究以ASFV Pig/HLJ/2018株基因组(MK333180.1)为模板,PCR 扩增E199L 基因,构建重组质粒pET-32a-E199L。利用IPTG 诱导重组质粒表达,经SDS-PAGE 和western blot 鉴定后,利用该重组蛋白(rE199L)作为包被抗原,建立用于检测ASFV E199L 蛋白抗体的间接ELISA 方法[7]。为ASFV 的早期检测提供技术手段。
1 材料与方法
1.1 菌株、质粒及血清大肠杆菌(E. coli)BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司;pET-32a(+)由本实验室保存;ASFV Pig/HLJ/2018 株基因组从中国农业科学院哈尔滨兽医研究所分离并保存的ASFV 中提取;临床样品以及8 份ASFV 阳性血清均由国家动物疫病防控高级别生物安全实验室提供;217 份ASFV 阴性SPF 猪血清来源于实验动物基地的SPF 猪。猪繁殖与呼吸障碍综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪圆环病毒(Porcine circovirus,PCV)、猪细小病毒(Porcine parvovirus,PPV)、伪狂犬病毒(Pseudorabies virus,PRV)阳性血清均本实验保存。196 份ASF 临床猪血清样品由哈尔滨兽医研究所非洲专业实验室提供,为ASF 弱毒疫苗HLJ/18-7GD株[8]免疫两次获得的猪血清,两次免疫间隔三周,从免疫开始每隔5 d 采血一次,并分离血清,共采集了3 次。
1.2 主要试剂T4 DNA Ligase、MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0、DL2000 及DL10000 DNA Marker 均购自TaKaRa 公司;限制性内切酶EcoR I 和XhoI 购自New England Biolabs 公司;BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司;IPTG、PureLinkTMHiPure 质粒大提试剂盒购自Invitrogen 公司;彩色预染蛋白分子量标准(10 ku~180 ku)购自GenStar 公司;Ni 层析介质(NTA)重力预装柱套装购自博奥龙公司;His-Tag 鼠源单克隆抗体(MAb)购自Proteintech 公司;ASFV 阻断ELISA 抗体检测试剂盒购自ABM公司。
1.3 引物设计根据GenBank 中ASFV Pig/HLJ/2018株(MK333180.1)E199L 基因序列,结合pET-32a(+)载体的多克隆酶切位点设计引物,上游引物E199LF:5'-CGGAATTCCGTTGCCCGCTTAAAAATTG-3'/下游引物E199L-R:5'-CCCTCGAGGGTCGGTGATAGG TTGAATA-3',下划线分别为EcoR I、XhoI 酶切位点,由吉林省库美生物科技有限公司合成。
1.4 重组质粒的构建与重组E199L蛋白(rE199L)的表达与鉴定以Pig/HLJ/2018 株基因组为模板,以E199L-F/E199L-R 引物经PCR 扩增E199L 基因片段,经回收纯化后,克隆于pET-32a(+)载体中,构建重组质粒并经菌液PCR鉴定后由吉林省库美生物科技有限公司测序鉴定,正确的重组质粒命名为pET-32a-E199L。将pET-32a-E199L 转化至BL21(DE3)感受态细胞中,37 ℃、220 r/min培养至OD600nm值为0.6时,分别加入终浓度为0.1 mmol/L、0.5 mmol/L、1.0 mmol/L的IPTG,分别于37 ℃、25 ℃、17 ℃诱导表达。同时设置pET-32a(+)载体转化的菌作为阴性对照,培养12 h 后收集菌液。离心收集菌体沉淀,PBS 洗涤后重悬,超声裂解破碎后分离上清与沉淀,通过12%SDS-PAGE 检测蛋白的表达及表达形式。按上述确定的蛋白表达条件大量诱导rE199L 的表达。利用Ni层析介质(NTA)重力预装柱摸索蛋白纯化的条件,并大量纯化蛋白。以His-标记小鼠MAb(1∶5 000)为一抗,兔抗小鼠HRP-IgG(1∶10 000)为二抗,经western blot 鉴定rE199L 蛋白的反应原性。
1.5 间接ELISA 方法反应条件的优化采用矩阵法,按照间接ELISA 常规程序分别对纯化的rE199L蛋白包被浓度(1.0 μg/mL、2.0 μg/mL、4.0 μg/mL、8.0 μg/mL、16.0 μg/mL)、ASFV 阳性猪血清和阴性猪血清稀释倍数(1∶10、1∶50、1∶100、1∶200)、封闭液(1%BSA、2%BSA、5%脱脂乳、5%胎牛血清)、封闭时间(30 min、45 min、60 min、75 min)、兔抗猪HRP-IgG(1∶1 000、1∶5 000、1∶7 500、1∶1 0000)、孵育时间(30 min、45 min、60 min、75 min)等进行优化,确定该方法的最佳反应条件。
1.6 临界值的确定按照上述优化的程序检测217份猪阴性血清,测定其OD450nm值,计算平均值ˉx和标准方差SD,将ˉx+3s作为临界值,OD450nm值大于或等于临界值判定为阳性,OD450nm值小于临界值判定为阴性。
1.7 特异性试验利用上述优化的间接ELISA 方法分别对PRRSV、PEDV、CSFV、PCV、PPV、PRV、ASFV 阳性猪血清进行检测,设ASFV 阴性猪血清作为阴性对照,每种血清设置2 个重复,评价ELISA检测方法的特异性。
1.8 敏感性试验利用上述优化的间接ELISA 方法对10 倍倍比稀释的ASFV 阳性猪血清(1∶100~1∶6 400)后进行检测,每个血清样品设置2 个重复,确定阳性血清的最高稀释度,评价该方法的敏感性。
1.9 重复性试验选取同一批次包被的3 块酶标板,利用建立的间接ELISA 方法检测8 份ASFV 阳性猪血清,每种样品设置3 个重复,计算其批内变异系数(CV),评价该方法的批内重复性。选取3 块不同批次包被的酶标板,利用该方法检测上述8 份ASFV 阳性猪血清,每种样品设置3 个重复,计算其批间变异系数(CV),评价该方法的批间重复性。
1.10 临床样品检测采用建立的ELISA 方法检测196 份临床猪血清样品,并与美国biostone ASFV 阻断ELISA 抗体检测试剂盒检测结果相比较,并计算二者的符合率。
2 结 果
2.1 重组表达载体的构建与鉴定结果以ASFV Pig/HLJ/2018 株基因组作为模板,利用相应引物经PCR 扩增E199L 基因片段,结果显示,获得与预期大小相符的目的片段(图1A)。构建的重组质粒pET-32a-E199L 经双酶切(图1B)和测序鉴定均正确。
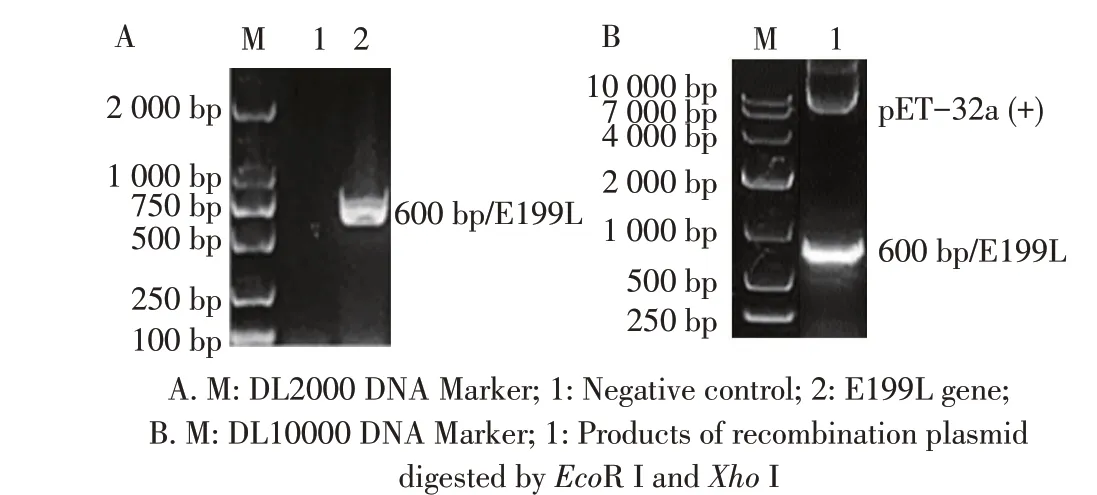
图1 E199L基因的PCR扩增(A)及重组质粒的双酶切鉴定(B)结果Fig.1 PCR amplification(A)and Enzyme digestion analysis(B)of E199L gene
2.2 rE199L 的表达、纯化及鉴定结果重组菌pET-32a-E199L/BL21(DE3)经不同终浓度的IPTG 在不同温度诱导后的SDS-PAGE 电泳结果显示,E199L 蛋白主要以可溶性蛋白形式表达,在25 ℃、0.1 mmol/L IPTG诱导后的rE199L表达量较多(图2A~图2C)。通过带有His 标签的Ni 层析介质(NTA)重力预装柱纯化蛋白,经His 标签纯化后的蛋白进行western blot 鉴定,结果显示在22 ku 有特异性条带(图2D),表明E199L 蛋白具有较好的反应原性。

图2 rE199L表达的SDS-PAGE(A、B、C)及其纯化的western blot(D)鉴定结果Fig.2 Identification of recombinant E199L protein by SDSPAGE(A,B,C)and western blot(D)
2.3 间接ELISA 方法的优化采用矩阵滴定法优化各反应条件结果如表1。

表1 间接ELISA方法反应条件的优化Table 1 Optimization of reaction conditions for indirect ELISA
2.4 间接ELISA 方法临界值的确定利用上述优化的间接ELISA 方法检测217 份ASFV 阴性猪血清,测定其OD450nm值,将ˉx+3s作为阴、阳性血清的临界值,结果显示OD450nm值均介于0.038~0.696(图3)。统计分析结果显示,样品OD450nm的ˉx为0.301,SD 为0.041,即当待检样品的OD450nm值≥0.424 时,判定样品为阳性,当待检样品的OD450nm值<0.424 时,判定样品为阴性。

图3 阴性样品结果的正态分布图Fig.3 Normal distribution diagram of negative samples
2.5 间接ELISA方法的特异性试验结果利用优化的间接ELISA 方法检测PRRSV、PEDV、CSFV、PCV、PPV、PRV 及ASFV 阴、阳性猪血清,每种血清2 次重复,结果显示,只有ASFV 阳性猪血清的OD450nm值大于0.424,其他血清样品的OD450nm值均小于0.424(表2),表明建立的间接ELISA 方法特异性较强。

表2 间接ELISA方法的特异性试验结果Table 2 Specificity test of the indirect ELISA
2.6 间接ELISA 方法的敏感性试验结果将ASFV阳性猪血清从1∶100 开始10 倍倍比稀释,利用优化的间接ELISA 方法检测,根据检测结果判定阳性血清的最大稀释度,结果显示,当阳性血清稀释度为1∶1 600,检测的OD450nm值仍大于0.424(表3),表明该方法能够检测ASFV 阳性血清的最大稀释度为1∶1 600,敏感性较高。
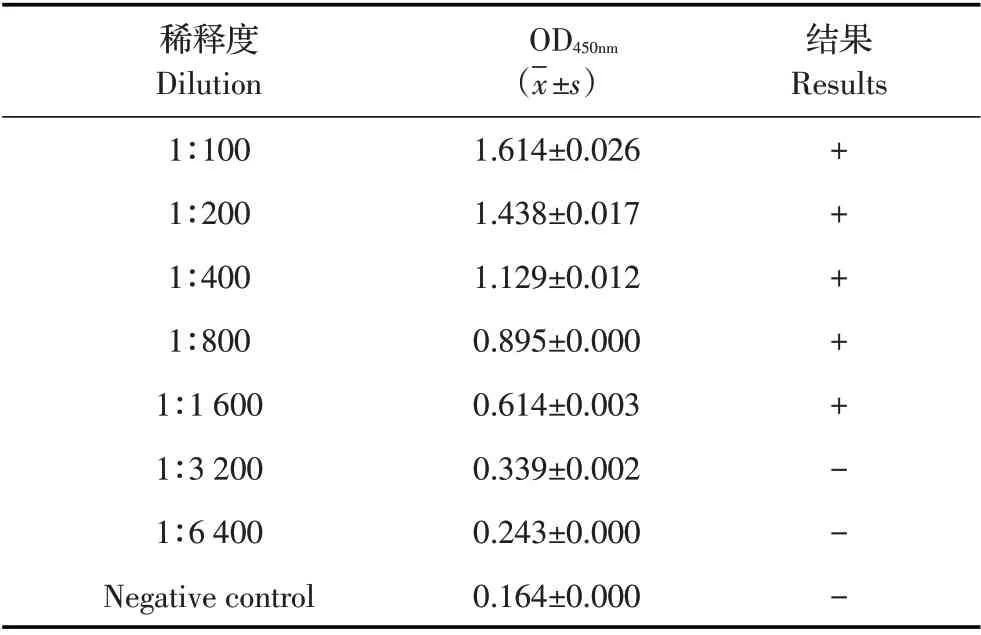
表3 间接ELISA方法的敏感性试验结果Table 3 Sensitivity test of the indirect ELISA
2.7 间接ELISA 方法的重复性试验结果选取同一批次包被的酶标板,采用建立的间接ELISA 方法检测8 份ASFV 阳性猪血清,每份样品3 次重复,计算其批内变异系数(CV);选取不同批次包被的酶标板,采用建立的间接ELISA 方法检测上述血清样品,计算批间变异系数(CV)。结果显示,批内和批间变异系数均<10%(表4)。表明建立的间接ELISA方法重复性较好。
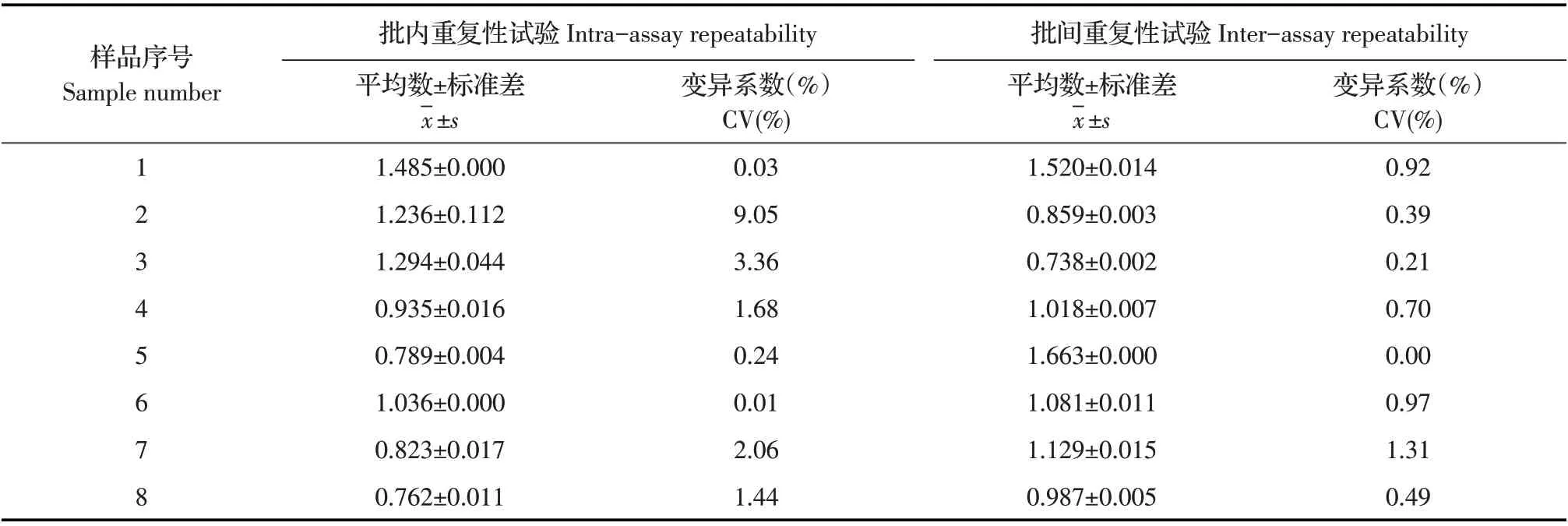
表4 间接ELISA方法的重复性试验结果Table 4 Repeatability test of the indirect ELISA
2.8 临床样品检测结果采用本研究建立的间接ELISA 方法与美国biostone 非洲猪瘟阻断ELISA 抗体检测试剂盒(10057-02/05)同时检测196 份猪血清。本研究建立的间接ELISA 检测结果为:阳性样品175 份,阴性样品21 份,阳性检出率为89.3%;且在免疫后7 d 就检测出了相应抗体。采用进口商品化试剂盒检测结果为:阳性样品178 份,阴性样品18 份,阳性检出率为90.8%;经计算二者符合率为98.3%。表明本实验建立的间接ELISA 方法与商品化试剂盒的符合率较高,可以用于临床样品的检测。
3 讨 论
ASF 自1921 年在肯尼亚地区首次报道至今已有一个世纪的历史,长距离、跨区域传播至多个国家,并给这些国家的生猪及相关产业造成严重的打击[1]。2016 年以来,ASF 疫情显著增加,2018 年,ASF 传入中国,并迅速蔓延到全国大部分地区。截至目前,尚无商品化疫苗用于ASF 的防控。因而建立能够快速、准确检测ASFV 的方法对于ASF 疫情防控非常重要。目前主要有p72、p54 和p30 等蛋白可作为ASFV 检测方法的靶抗原。而最近对我国部分地区的ASF 流行病学检测和病原学研究中发现了ASF 基因II 型自然变异流行株的出现[9],大大增加了该病早期诊断的难度,为我国ASF 防控带来全新的挑战。探寻ASFV 血清学的候选诊断抗原并以此建立相应的检测方法,有助于提高ASFV 检测结果的准确性。
本研究选择的E199L 结构蛋白是定位于ASFV 内膜的一种I 型跨膜多肽,含有分子内二硫键,在病毒内化过程中发挥重要作用。研究表明,E199L 蛋白缺陷的病毒颗粒不能实现膜融合和基因组核心释放到细胞质中的过程,使得病毒颗粒在宿主细胞溶酶体样结构中累积。此外,缺陷E199L 蛋白的病毒颗粒vE199Li 感染的细胞不表达早期(p32/pCP204L)或晚期(p72)标记的病毒蛋白[6]。上述结果表明,E199L蛋白是ASFV 感染早期所必需的。有研究表明,ASFV E199L 蛋白可以激活NOD 样受体热蛋白结构域相关蛋白3(NLRP3)和干扰素诱导蛋白2(AIM2)介导的炎症反应,推测其可能在ASFV 的免疫应答中发挥作用[10]。据文献报道,ASFV 通过调节促炎分子和细胞因子的表达来逃避宿主的免疫监测[11-13]。表明E199L 可能参与病毒感染后的炎性反应而逃避宿主的免疫防御。猪感染ASFV 后的7 d~10 d 内可检测到E199L 抗体,表明E199L 可以用于ASFV 的早期检测。综上所述,E199L 在ASFV 复制早期及免疫应答方面发挥重要作用,在原核表达系统中可以稳定表达,且在猪中可以诱导较强的免疫反应,表明E199L 可以作为ASFV 血清学检测及其疫苗研发的候选抗原。
本研究在原核系统中表达了ASFV E199L 蛋白并建立了检测其抗体的间接ELISA 方法。建立的间接ELISA 检测方法具有较好的特异性、敏感性和重复性,对临床样品的检测结果与ASFV 阻断ELISA 抗体检测试剂盒(p54)检测结果的符合率较高。目前尚无针对E199L 蛋白的商品化试剂盒,而由哈尔滨国生生物科技股份有限公司研发的p72 间接ELISA 抗体检测试剂盒的敏感性为1∶1 600,与本研究建立的E199L 间接ELISA 方法的敏感性一致,说明基于E199L 建立的间接ELISA 方法的敏感性已达到商品化试剂盒的标准,可以为ASFV 的早期检测提供更多方法的选择。
——一道江苏高考题的奥秘解读和拓展

