基于整合转录组学分析丝氨酸蛋白酶抑制剂Hespintor抑制肝癌裸鼠移植瘤生长的潜在机制
伦永志,孙 杰,魏 玲,2,刘 奔,董 雯,潘凌鸿
(1. 莆田学院药学与医学技术学院医学微生态学福建省高校重点实验室,福建莆田 351100;2. 北京市理化分析测试中心,北京 100089)
人丝氨酸蛋白酶抑制剂(serine proteinase inhibitors,Serpins)是一类参与人体诸多生理过程的活性调节因子。迄今为止已发现动物、植物、古细菌、细菌、病毒中均存在Serpins,大约1 500个成员至少分属于20个基因家族[1],Kazal型Serpins是其中较为保守的家族之一。Hespintor是本课题组在2005年从肝癌细胞Hep G2中首次筛选发现,2006年3月提交序列至GenBank(DQ438947),2018年6月正式命名为Kazal型丝氨酸蛋白酶抑制剂13(SPINK13)[2]。在前期工作中,已证实Hespintor重组蛋白质可在体外明显抑制肝癌细胞的增殖、迁移及侵袭,并对肝癌细胞裸鼠移植瘤皮下生长具有良好的抑制作用[3-5],使其有望成为新型肿瘤靶向治疗药物。研究表明,诸如Hespintor等Serpins可在胞外通过抑制基质金属蛋白酶(matrix metalloproteinases,MMPs)活化,从而控制肿瘤细胞的迁移和侵袭能力[6]。此后,Serpins可经受体介导的内吞作用进入胞内[6],由于入胞后的代谢转归和生物学功能等研究较少,其胞内靶蛋白质或靶蛋白酶较难确定,因此后续的作用机制尚不清楚。
研究显示,无论是编码蛋白质的mRNA还是以参与调控为主的长链非编码RNA(long non-coding RNA,lncRNA)对肿瘤发生、发展均有重要影响,其中lncRNA在表观遗传、细胞周期及细胞分化等调控中发挥重要作用[7],并且差异表达lncRNA调控的靶基因在功能富集方面表现更为全面[8]。本研究基于裸鼠移植瘤Hespintor治疗组及溶剂对照组的比较转录物组结果,分别筛选lncRNA、mRNA差异表达基因 集(differential expression genes,DEGs),针 对DEGs lncRNA调控靶基因、DEGs mRNA,利用网络模块划分方法筛选Hespintor作用靶点基因并构建调控网络,为探究Hespintor分子调控机制及可用于临床诊疗的分子靶点提供理论依据。
1 材料与方法
1.1 细胞系和重组蛋白质
人高侵袭性肝癌细胞系MHCC97-H购自北纳创联公司(北京),细胞培养于含100 mL/L胎牛血清的DMEM(1%青霉素-链霉素)培养基,置于37℃、50 mL/L CO2常规培养,1~2 d传代1次。纯化的Hespintor重组蛋白质由本实验室在前期研究中利用Ni-NTA亲和层析方法制备[4-5]。
1.2 实验动物建模与分组
SPF级裸鼠12只,6~8周龄,雄性,体质量(22±3)g,购自重庆恩斯维尔生物科技有限公司。取对数生长期的MHCC97-H细胞,制备成1×107个/mL的细胞悬液,每只裸鼠于右腋皮下缓慢接种200μL细胞悬液。裸鼠荷瘤1 d后随机分为2组,每组6只,2 d后开始给药。Hespintor治疗组按尾静脉注射Hespintor溶液,剂量为20μg/kg;溶剂对照(solvent control)组按尾静脉注射生理盐水,剂量为20μg/kg。移植瘤模型裸鼠尾静脉注射给药时间均为第1~2周每周给药2次,第3~4周每周给药3次。最后一次2 d后给药,70 g/L。水合氯醛腹腔注射麻醉,剂量为5 mL/kg,麻醉后剥离瘤块。瘤块用生理盐水冲洗并立即放入液氮中,之后迅速转移至-80℃保存备用。
1.3 转录物组测序分析
由重庆威斯腾生物公司完成后续的组织RNA提取及检测、文库构建,库检合格后进行Illumina PE150测序。获得的原始测序序列先进行测序数据质量评估,经过原始数据过滤、测序错误率检查及GC含量分布检查后获得符合标准的clean reads,利用Hisat2 v2.0.5将reads比对到参考基因组(Ensembl 75),继而利用StringTie v2.1.1进行转录物拼接,再利用Cuffmerge v2.2.1去除不合格的拼接转录物,然后利用Cuffdiff v2.2.1进行差异表达显著性分析。
1.4 差异表达基因集的筛选及相互作用分析
DEGs lncRNA、DEGs mRNA(候选基因集标记为DM)筛选标准均为│log FC│≥2、P<0.05。利用lncRNA与编码基因的位置关系(co-location)预测DEGs lncRNA调控靶基因,筛选阈值为差异表达lncRNA上下游20 kb内;为保证预测结果的真实性,将筛选得到的DEGs lncRNA调控靶编码基因与转录物组全部mRNA同时提交至韦恩图在线绘制工具(http://bioinformatics.psb.ugent.be/webtools/Venn),取两者交集作为候选基因集(标记为DL-M),确保进入后续分析的DEGs lncRNA调控靶编码基因均为真实表达。选取DM差异表达倍数分别排在前30位的上调、下调基因,利用Cluster v3.01和Heml v1.0根据FPKM值绘制聚类热图。将DM、DL-M两组基因集分别提交至Metascape数据库(http://metascape.org),分别进行KEGG(Kyoto Encyclopedia of Genes and Genomes)和Reactome通路(pathway)富集分析。富集标准为Min Overlap≥3、PValue Cutoff≤0.05,其余选择默认值[9]。再将上述两组基因集分别提交至String在线工具(http://string-db.org)构建可视化相互作用关系网络,参数设置为meaning of network edges:confidence,active interaction sources:Experiments、Databases,minimum required interaction score≥0.7(满分为1),hide disconnected nodes in the network,其余选择默认值[10]。
1.5 靶点基因的筛选及其调控网络构建
将具有相互作用关系的2组基因集分别导入Cytoscape软件构建可视化网络,先利用MCODE插件筛选出构成网络稳定结构的核心(Core)基因,参数设置为degree cutoff≥3、K-Core≥4,其余选择默认值;再利用CentiScape插件计算网络及各个节点的拓扑特性,规定degree value≥Mean+SD的节点所对应基因为枢纽(Hub)基因,betweenness value≥Mean+SD的节点所对应基因为瓶颈(bottleneck)基因。取三者交集作为靶点基因,汇总注释得到的重要通路、关联的靶点基因及其调控DEGs lncRNA,分别建立相互关系文本并导入Cytoscape软件构建可视化调控网络。
1.6 q RT-PCR验证靶点基因的表达
按PureLink Total RNA Kit(Thermo Fisher Scientific,上海)说明书提取组织总RNA,以β-actin内参基因,利用qRT-PCR和2-ΔΔCt法检测关联的DEGs mRNA、DEGs lncRNA相对表达量。以总RNA为模板,按PrimeScript RT Reagent kit(TaKaRa,北京)说明书进行逆转录,所得产物即为cDNA,稀释10倍后用于后续qPCR。反应体系:Power SYBR Green PCR Master Mix(Thermo Fisher Scientific,上海)5.0μL、cDNA 2.0μL、Forward Primer(10μmol/L)0.5μL、Reverse Primer(10μmol/L)0.5μL、DNase Free dH2O up to 10.0μL;反应条件:95℃10 min、95℃15 s、60℃1 min(40 cycles)。引物由生工生物工程(上海)股份有限公司合成,序列见表1。
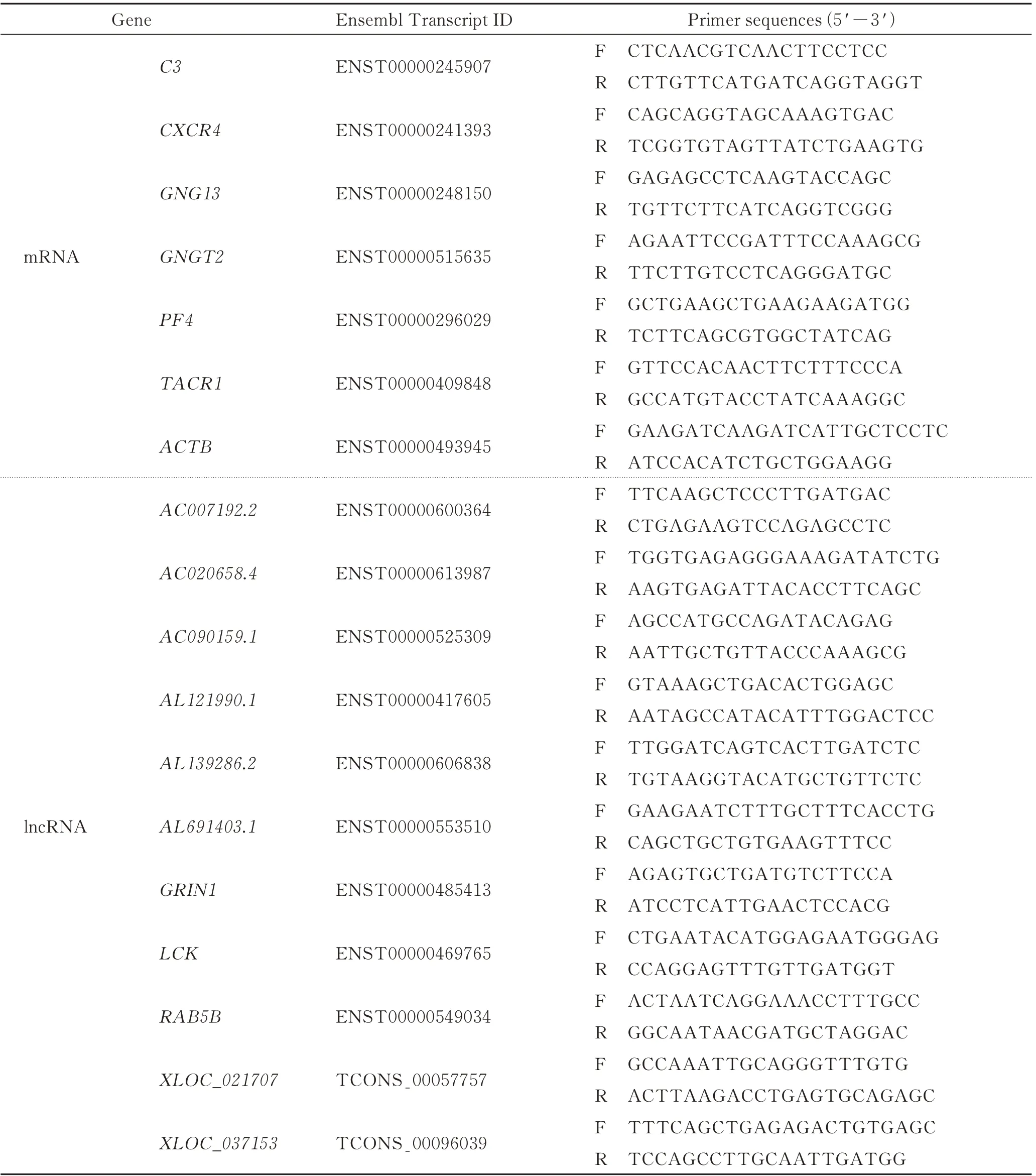
表1 实时定量PCR的各基因引物序列Tab.1 qPCR Primer sequences
1.7 流式细胞术检测细胞周期
空白对照组、实验组细胞分别培养于含0、15μg/mL Hespintor无血清DMEM培养基中48 h,经胰酶消化后,离心收集细胞沉淀,加入预冷的PBS重悬细胞,再次离心沉淀细胞,小心吸弃上清;加入预冷的700 mL/L乙醇,轻轻吹打混匀,4℃固定过夜,离心沉淀细胞。按细胞周期检测试剂盒说明书(Beyotime,上海)操作,加入碘化丙啶(propidium iodide,PI)至终质量浓度为50 mg/L,缓慢并充分重悬细胞沉淀,37℃避光温浴30 min,采用激发波长为488 nm的红色荧光检测细胞周期,实验独立重复3次。利用细胞周期拟合软件对结果进行分析,记录亚二倍体峰,即G0/G1期、S期、G2/M期细胞比例。
1.8 统计学分析
数据分析采用单因素方差分析(One-way ANOVA),两两比较用Tukey检验,图中所有数据均以平均值±标准差的方式呈现,P<0.05为差异有统计学意义。
2 结 果
2.1 重组Hespintor对MHCC97-H细胞裸鼠移植瘤的抑制作用
通过将MHCC97-H肝癌细胞皮下注射至裸鼠体内获得移植瘤模型。荷瘤3 d后,裸鼠尾静脉注射给药治疗4周后,剥瘤称重并测量体积,分别计算抑瘤率。重组Hespintor治疗组相比溶剂对照组明显抑制了裸鼠中MHCC97-H肝癌细胞的皮下生长(图1),抑瘤率分别达到24.21%、29.76%。

图1 重组Hespintor抑制裸鼠MHCC97-H细胞皮下生长Fig.1 Recombinant Hespintor inhibited the subcutaneous growth of MHCC97-H cells in nude mice
2.2 转录物组测序质量评估与聚类分析
分别构建Hespintor治疗组和溶剂对照组裸鼠移植瘤cDNA文库并进行转录物组测序,所得原始数据经过滤、测序错误率检查及GC含量分布检查以去除低质量数据,再将有效测序数据(clean reads)比对到人类参考基因组。Hespintor治疗组和溶剂对照组分别获得91 230 446和98 123 016个有效测序数据(图2A),Q30质量值分别达到92.9%、94.07%(图2B),GC含量分别达到49.23%、51.39%;Hespintor治疗组移植瘤与参考基因组的比对率为85.9%,溶剂对照组移植瘤与参考基因组的比对率为82.85%,在参考序列上有多个比对位置的reads数量(multiple mapped reads)占比率分别为3.79%、4.52%。上述结果表明,测序质量较高且结果可信,符合后续分析要求。将比对结果进行转录物拼接,利用每千个碱基的转录物每百万映射读取的片段值(fragments per kilobase of exon per million reads mapped,FPKM)定量mRNA、lncRNA表达水平(图2C)。根据DM差异基因表达值显著聚类为2大类(图2D)。

图2 Hespintor治疗组与溶剂对照组的转录物组测序质量评估与差异表达的显著性分析Fig.2 RNA-Seq quality assessment and significance analysis of differential expression between Hespintor treatment and solvent control
2.3 差异表达基因集主要富集于细胞行为、转录调控和细胞周期等功能
为了提高显著性分析水平,按照自定义筛选条件,共计得到DEGs lncRNA 2 003个,其中上调基因1 090个、下调基因913个。剔除实际未表达的编码基因,预测得到DEGs lncRNA调控靶基因共计1 332个(即为DL-M);共计筛选得到1 038个DEGs mRNA(即为DM),其中上调基因570个、下调基因468个。
将DM、DL-M作为后续分析的候选基因集。DM显著富集于神经调控、细胞行为和凝血功能等三类重要KEGG通路(图3A):①神经活性配体受体相互作用、谷氨酸能突触、鞘氨醇生物合成等;②趋化因子信号通路、细胞外基质受体相互作用、cAMP信号通路等;③补体和凝血级联。以上结果与Reactome通路富集结果相吻合:①神经元系统;②G蛋白偶联受体(G protein-coupled receptor,GPCR)配体结合、细胞外基质组织、淋巴细胞和非淋巴细胞之间的免疫调节相互作用等;③血管壁细胞表面的相互作用、补体激活的凝集素途径等。KEGG及Reactome通路分析结果显示,相较DM,DL-M涉及功能更广泛,两者关联性侧重体现在细胞行为、转录调控和细胞周期等三方面(图3B):①MAPK信号通路和PIP3激活Akt信号、细胞凋亡的内在途径等;②p53信号通路和TP53的转录调控、FOXO介导的转录等;③细胞周期(KEGG及Reactome通路同时富集得到)。值得关注的是,DM、DL-M富集结果交互贯通,其中GPCR信号通路、趋化因子信号通路和PI3K/Akt信号通路、p53信号通路、细胞周期信号通路等不仅与细胞增殖、凋亡的关系密切相关,且彼此之间相互影响。将DM、DL-M分别上传至String在线工具,按设置参数标准筛选后,去除重复及无相互作用孤立的基因后,DM构建的蛋白质相互作用网络包括956个节点蛋白质、1 101条关系对,DL-M蛋白质相互作用网络共计1 285个节点蛋白质、1 810条关系对(图4)。

图3 候选基因集富集分析结果Fig.3 The results of enrichment analysis of candidate gene set

图4 候选基因集蛋白质相互作用分析结果Fig.4 T he result of protein-protein interaction network analysis of candidate gene set
2.4 差异表达基因集交互作用网络核心、枢纽、瓶颈节点及Hespintor作用靶点基因的筛选
将图3两组蛋白质相互作用网络分别导入Cytoscape软件中进行可视化。利用该软件“MCODE”插件对该网络进行K核解析,按设置参数标准筛选后,DM、DL-M分别获得10个、15个稳定结构的核心基因集(图5A、图5B),分别包括109个、205个核心基因(core genes)。利用Cytoscape软件“CentiScape”插件计算网络及各个节点的拓扑特征,Degree为节点连接的边的总数目,按设置参数标准筛选后,分别获得枢纽基因(hub genes)45个、76个;Betweenness为网络中所有的最短路径中经过该节点的数量比例,按设置参数标准筛选后,分别获得瓶颈基因(bottleneck gene)25个、47个。同时为核心基因、枢纽基因和瓶颈基因者对所在网络至关重要,即为Hespintor作用靶点基因(图5C)。DM靶点基因共计7个,其中CXCR4、LCK为上调基因,其余为下调基因;DL-M靶点基因共计21个,只有GNG13为下调基因,其余均非DEGs mRNA(表2)。

表2 候选基因集靶点基因的筛选Tab.2 Identification result of target genes of candidate gene set

图5 核心基因集结构和候选基因集靶点基因的筛选Fig.5 Interaction diagram of core genes and identification of target genes of the candidate gene set
2.5 构建DEGs lnc RNA-target gene-KEGG/Reactome pathway可视化调控网络
以溶剂对照组为基准,选择关联重要通路的靶点基因或其调控DEGs lncRNA进行表达水平验证(图6)。研究表明,qPCR验证结果与转录物组测序结果相符,这为进一步开展机制研究奠定了物质基础。将以上靶点基因、与之调控相关的DEGs lncRNA和注释得到的重要通路导入Cytoscape软件,构建一个

图6 重要通路关联的差异表达基因相对表达水平的q PCR验证Fig.6 Verification of the relative expression levels of DEGs mRNA,DEGs lncRNA related to important pathways by qPCR
DEGs lncRNA-target gene-KEGG/Reactome pathway可视化调控网络,共计42个节点(17个靶点基因、11个lncRNA和14条通路)及63个关系对。Hespintor调控通路主要集中于GPCR信号通路、PI3K/Akt信号通路、p53信号通路和细胞周期通路等,这些通路均与肿瘤的发生发展有关且彼此关联(图7)。同时,Hespintor能够诱导细胞周期阻滞于G1/S期(图8)。

图7 DEGs lncRNA-tar get gene-KEGG/Reactome pathway调控网络Fig.7 DEGs lncRNA-target gene-KEGG/Reactome pathway regulatory network

图8 Hespintor作用MHCC97-H细胞后的细胞周期阻滞变化Fig.8 Changes of cell cycle arrest in MHCC97-H cells treated with Hespintor
3 讨 论
蛋白酶抑制剂在肿瘤中的作用机制非常复杂,具有抑制和促进的矛盾表现,原因在于作用底物的种类和性质。除了蛋白酶抑制剂直接与上下游底物互作外,功能各异的不同底物与其他蛋白质之间的交互关系也影响了肿瘤细胞的生物学进程[11]。肿瘤细胞的命运往往取决于某种相互作用能否通过调控细胞增殖、侵袭和凋亡等,以及血管形成等生理过程,进而扩大并固化细胞间的分子差异和最终结局。Serpins在胞外通过抑制尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator,uPA)的丝氨酸蛋白酶活性可间接抑制MMPs活性,避免细胞外基质(extracellular matrix,ECM)及基底膜(basement membrane,BM)发生局灶性蛋白质水解,从而阻止肿瘤细胞的侵袭或(和)迁移[12-14]。Serpins经内吞作用入胞后的作用机制和对肿瘤细胞的影响尚有待于研究。
前期研究表明,Hespintor能够激活促凋亡因子Bax和Caspase-3的表达,同时抑制抗凋亡因子Bcl-2的表达[4-5],通过诱导肿瘤细胞凋亡而发挥抑瘤作用。Bax通过改变线粒体膜通透性,促进细胞色素C的释放,经Caspase途径激活Caspase-3及后续级联反应,促进细胞凋亡[15],这表明线粒体凋亡途径极有可能是Hespintor促凋亡机制之一。但因此而产生的活性氧(reactive oxygen species,ROS)对肿瘤细胞信号通路的调控具有两面性:一般来说,ROS能够激活与增殖、存活、血管生成和转移相关的信号通路,促进肿瘤的发生、发展和转移;过量ROS介导的氧化应激机制则可引起损伤。根据ROS水平和暴露时间的不同,可以激发肿瘤细胞存活或凋亡机制[16]:低水平的ROS可作为有丝分裂原引起细胞增殖;中等水平的ROS可诱导细胞周期暂时或永久阻滞并促进细胞分化;高水平的ROS可破坏生物大分子从而导致细胞凋亡[17]。由于代谢异常和线粒体功能障碍,抵抗内源性ROS升高是肿瘤细胞的一个重要特征,这使得肿瘤细胞应对ROS额外升高的能力变得有限,反而更容易受到氧化应激损伤[18-19]。充分利用ROS与抗氧化应激之间的微妙平衡,通过诱生高浓度的ROS来消除肿瘤细胞的抗氧化防御能力而促进凋亡[20],并借此达到治疗的目的。
以数据挖掘与分析为主体内容的生物信息学已被广泛应用于包括肿瘤在内的各种疾病诊疗机制研究。利用网络模块划分方法,有助于发现“疾病与基因”之间的关联,网络模块的“网络结构熵”值越小,则该模块就越稳定、可信度也越高,采用MCODE cluster方法划分网络模块后的熵值最小[21]。DEGs mRNA中的关联靶点基因主要参与GPCR信号通路。CXCR4作为其中最重要的趋化因子受体之一,在高活性氧或低氧环境中通过形成CXCL 12/CXCR4生物轴促进肿瘤细胞转移[22];C3、GNG13、GNGT 2、PF4、TACR1本身就是Gαi蛋白质和(或)Gαq蛋白质组分,多个有丝分裂原均可通过Gαi蛋白质、Gαq蛋白质传递细胞增殖信号[23]。ROS通过氧化半胱氨酸残基使磷酸酶张力蛋白同源物(PTEN)失活,继而活化磷酸肌醇-3-激酶/蛋白激酶B/缺氧诱导因子1α(PI3K/Akt/HIF-1α)信号通路增加CXCR4表达[24]。因此,肿瘤细胞极有可能通过以上途径借以逃避氧化应激损伤和死亡。Hespintor在实体瘤组织的分布必定有限且不均匀,组织内围更易产生中低水平的ROS并经依赖ROS介导机制促进uPA、uPAR、CXCR4表达[24-26]。这意味着Hespintor用药剂量应着重考虑ROS浓度,且在一定程度上可以解释Serpins在肿瘤中的矛盾表现。
真核细胞中存在着由lncRNA参与构成的复杂而重要的基因表达调控网络,在调控细胞周期、疾病发生、干细胞分化和细胞重编程等方面发挥重要功能[27]。目前认为,lncRNA可通过行使信号分子、支架分子、诱饵分子和引导分子等功能,从转录、转录后和表观遗传三个层面体现其顺式或反式中心调控作用,lncRNA调控靶基因的生物学效果与意义比mRNA更加直接和明显[28]。受DEGs lncRNA调控的关联靶点基因主要参与PI3K/Akt信号通路、p53信号通路和细胞周期信号通路,整合GPCR信号通路分析可知,以上通路交联贯通,尤其是PI3K/Akt通路可能在其中发挥了主导作用,诱导细胞周期阻滞于G1/S期并引起细胞凋亡。目前认为,PI3K/Akt通路是介导细胞增殖的基本途径,Akt通过磷酸化方式活化下游多个通路而抗凋亡,并使细胞周期失控促进增殖,但物极必反,Akt也可导致细胞周期阻滞和凋亡增加[29]。作为GPCR主要的下游效应器,活化的PI3K催化磷脂酰肌醇4,5-二磷酸(PIP2)生成磷脂酰肌醇3,4,5-三磷酸(PIP3),后者作为一种信号分子招募并激活磷酸肌醇依赖性激酶(PDK),随后经磷酸化激活Akt,p-Akt再激活其靶蛋白质,包括Bcl-xl/Bcl-2相关死亡启动因子(BAD)、叉形头转录因子O1(FOXO1)、糖原合酶激酶3(GSK3)、哺乳动物雷帕霉素靶蛋白1(mTOR1)等,p53泛素化降解同样需要p-Akt介导的双微体2(MDM 2)磷酸化[30],并最终影响后续一系列的转录[31]。原本ROS致PTEN失活可激活Akt,此时促进细胞增殖,然而当ROS继续积累时又可引发细胞凋亡。除了ROS破坏生物大分子机制外,尚涉及多个机制且均与p-Akt相关:①HIF1α的稳定依赖于E3蛋白连接酶(pVHL)活性,HIF1α活性的降低与p VHL活性的增加成反比,pVHL上含有p-Akt底物位点,其磷酸化后可促进细胞凋亡[29];②肿瘤抑制因子BRCA 1同样含有p-Akt磷酸化位点,活化的BRCA 1可增强其在细胞核中的定位和依赖BRCA 1的转录活性[32];③p-Akt通过抑制由FOXO1介导的肿瘤抑制功能,使细胞倾向于依赖ROS的方式致凋亡[33];④p-Akt通过诱导凋亡素(apoptin)发挥其肿瘤抑制功能[34];⑤积累的ROS通过激活酪氨酸磷酸酶(SHP-TP1)使p-Akt去磷酸化[35];⑥蛋白磷酸酶2A(PP2A)对积累的ROS敏感,导致Akt-PP2A相互作用增强使p-Akt去磷酸化[36]。
本研究通过整合分析mRNA-seq与lncRNA-seq,发现Hespintor入胞后可能经线粒体凋亡途径产生ROS,进而调控下游多个信号通路,为揭示Hespintor作用机制提供了重要线索。同时,上述靶点基因及通路有待于进一步的实验验证,并且需要深入探讨Hespintor的量效关系及毒性作用,以评估其作为抗肿瘤药物的潜力。

