猪流行性腹泻病毒N蛋白阻断ELISA抗体检测方法的建立及初步应用
万 颖,周改静,麻 园,石正旺,肖书奇,罗俊聪,宋 锐,曹丽艳,杨 波,王丽娟,田 宏*,郑海学*
(1.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室 国家口蹄疫参考实验室,兰州 730046;2.西北农林科技大学动物医学院,杨凌 712100)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的一种急性、高度接触性传染性肠道疾病。PEDV是一种有包膜的单链RNA病毒,属于冠状病毒科,与传染性胃肠炎病毒(TGEV)、猪呼吸道冠状病毒(PRCV)等病毒同属于甲型冠状病毒属[1]。该病毒的基因组大小约28 kb,成熟病毒粒子的四种主要结构蛋白包括:穗状糖蛋白(S)(Mr 150~220 ku)、核蛋白(N)(Mr 45~57 ku)、糖化膜蛋白(M)(Mr 20~30 ku)、糖基化包膜蛋白(E)(Mr 7 ku)。N蛋白与病毒RNA结合,为螺旋状核衣壳提供了结构基础,是一种基本的碱性磷蛋白[2-3]。此外,它不仅在宿主体内诱导细胞介导免疫的过程中起重要作用,还参与病毒基因组的转录、复制和病毒RNA的组装[4-5]。猪在PEDV感染后的早期阶段,会产生针对N蛋白的高水平抗体[6]。鉴于N蛋白高度保守,因此常作为早期诊断试剂和疫苗开发的最佳候选抗原[5]。
PED临床表现腹泻、呕吐、脱水和体重减轻等症状[7-9],不同年龄的猪对该病均易感。该病毒首次于1971年出现在欧洲,后来逐渐扩散至亚洲[10-11]。我国于2010年首次发现其变异毒株,之后便迅速传播。虽各年龄猪均易感,但仔猪的死亡率更高,尤其是5日龄新生仔猪的死亡率可达100%[12],给我国养猪业带来了巨大的损失[13-15]。
PEDV抗原常规诊断方法包括病毒分离、常规RT-PCR[16-17]、荧光定量RT-PCR[18-19]、免疫荧光法(IFA)[20]和酶联免疫吸附试验(ELISA)[10]。虽然PED暴发后最好的诊断方法通常是病毒学检测,但血清学检测可提供有关先前接触病毒和特定动物和/或畜群免疫状态的重要信息。因此建立一种准确快速的PED抗体诊断方法迫在眉睫。抗体的检测方法有病毒中和试验、IFA和ELISA,其中IFA和病毒中和试验对仪器的精密度要求较高、检测的成本相对较高,且检测时间长。相较于前两种方法,ELISA法操作简便、快速,可应用于基层和临床的大批量检测。
目前,正在研发的PEDV ELISA抗体检测方法多以PEDV特异性单克隆或多克隆抗体为基础,这无疑增加了更多的成本,且不易大规模生产。与传统抗体相比,本研究中使用的纳米抗体更倾向于与凹形表位相结合,可以识别更多难以识别的隐蔽位点[21]。此外,其具有体积小、易于大量表达、特异性高、稳定性好等优点[22-24],是一种很有发展前景的诊断和治疗工具。本试验旨在以原核表达的N蛋白作为包被抗原,并利用所选择的Nb2纳米抗体开发一种阻断ELISA抗体检测方法,快速、低成本、灵敏地检测PEDV血清样本,为临床PEDV抗体检测提供技术支撑。
1 材料与方法
1.1 蛋白与血清
猪流行性腹泻病毒N蛋白和Nb2纳米抗体[8]均由西北农林科技大学肖书奇教授实验室惠赠;96份PEDV阴性血清由国家口蹄疫参考实验室提供;1份PEDV抗体阳性对照,1份PEDV抗体阴性对照,CSFV、PRRSV、PCV2、TGEV抗体阳性血清,健康猪血清,均由中国农业科学院兰州兽医研究所家畜病原学国家重点实验室制备与保存;140份田间猪血清样品采自不同猪场。
1.2 主要试剂、设备与试剂盒
BCA蛋白定量试剂盒购自宝生物工程(大连)有限公司;HRP Conjugation Kit-Lighting-Link®购自Abcam公司;BSA Albumin Fraction V购自BioFroxx公司;猪流行性腹泻病毒间接ELISA抗体检测试剂盒(批号:PEDVS-5P)购自法国Innovative Dignostics公司;96孔酶标板购自NUNC公司;海藻糖购自南宁中诺生物公司;抗体稀释液(批号:17032206)购自济南百迪泰生物科技有限公司;TMB显色液购自北京全式金生物技术有限公司。
1.3 N蛋白阻断ELISA抗体检测方法的建立
1.3.1 抗原N蛋白最佳包被浓度及血清样品稀释度的确定 按照HRP conjugation Kit-Lighting-Link®试剂盒操作步骤对Nb2纳米抗体进行HRP 标记,获得所需酶标抗体HRP-Nb2。将浓度为0.15 mg·mL-1N蛋白用包被液从1 250 ng·mL-1倍比稀释至156.25 ng·mL-1包被96孔酶标反应板,50 μL·孔-1,4 ℃包被12 h,弃液,每孔加入300 μL 1×PBST溶液洗涤4次,弃液拍干,加入120 μL封闭液,4 ℃封闭10 h,弃液拍干。将材料与方法中的阴阳性对照血清分别作为阴阳性待检血清,用样品稀释液分别稀释成3个梯度1∶1、1∶5和1∶10,同时设置阴性对照孔,按照棋盘式滴定的模式加入到反应板,每孔加入50 μL血清,37 ℃反应30 min,弃液,每孔加入300 μL 1×PBST溶液洗4次,弃液拍干。用抗体稀释液将HRP-Nb2 1∶5 000稀释,每孔加入50 μL,37 ℃反应30 min,弃液,加入300 μL 1×PBST溶液洗4次,弃液拍干。每孔加入50 μL TMB底物溶液,37 ℃避光孵育 12 min±1 min 后,加入 50 μL·孔-1的终止液,读取吸光光度值(OD450 nm)。根据公式PI=[(OD450 nm阴性对照-OD450 nm待检血清)/OD450 nm阴性对照]×100%[25],计算阳性待检血清的阻断率 PPI 值和阴性待检血清的阻断率NPI 值,以PPI/NPI 值最大为最佳条件原则,确定N蛋白的最佳包被浓度及血清样品最佳稀释度。
1.3.2 样品稀释液的筛选 1号样品稀释液:1% BSA(PBST溶液);2号样品稀释液:1% BSA[0.9% NaCl,0.5% Tween-20,0.05 mol·L-1MOPS(pH7.0)];3号样品稀释液:1% BSA[0.9% NaCl,0.5% Tween-20,1% 海藻糖,0.05 mol·L-1MOPS(pH7.0)],用这3种稀释液将阴阳性待检血清按照“1.3.1”筛选出的最佳血清稀释度进行稀释。后续按照步骤“1.3.1”进行,以PPI/NPI 值最大为最佳条件原则,筛选最佳样品稀释液。
1.3.3 封闭液的筛选 1号封闭液:0.5% BSA(1%蔗糖,2%海藻糖,100 mL PBS溶液);2号封闭液:PBST溶液;3号封闭液:0.8%明胶(100 mL PBS溶液);4号封闭液:1% BSA溶液(100 mL PBS溶液);5号封闭液:0.5%胎牛血清溶液作为封闭液。按照步骤“1.3.1”进行,以PPI/NPI 值最大为最佳条件原则,筛选得到最佳封闭液。
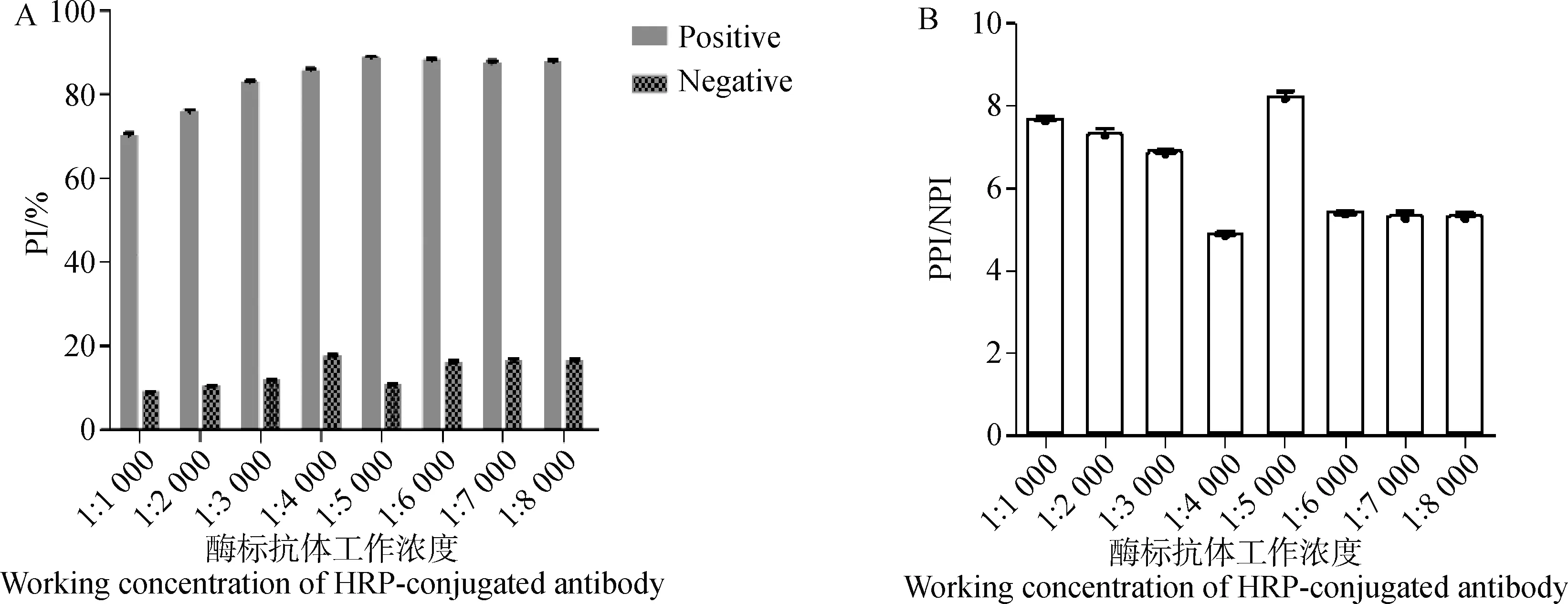
1.3.4 酶标抗体工作液最佳工作浓度的确定 用抗体稀释液将HRP-Nb2稀释成1∶1 000、1∶2 000、1∶3 000、1∶4 000、1∶5 000、1∶6 000、1∶7 000、1∶8 000。按照步骤“1.3.1”进行,以PPI/NPI值最大为最佳条件原则,确定酶标抗体工作液的最佳工作浓度。

1.3.6 特异性试验 用本研究建立的方法对健康猪血清、PRRSV、CSFV、PCV2和TGEV等病原的阳性血清进行检测,并设置阳性对照。读取吸光光度值并分析计算PI值,判定待检血清样品的阴阳性,从而分析本方法的特异性。
1.3.7 灵敏性试验 用本研究建立的检测方法和市售IDvet PEDV间接ELISA抗体检测试剂盒分别检测倍比稀释的阳性对照,读取吸光光度值并分析计算PI值,判定阴阳性,并与市售IDvet PEDV间接ELISA抗体检测试剂盒检测结果进行对比,从而分析本方法的灵敏性。
1.3.8 批内和批间重复性试验 选取4份血清样品(2份PEDV抗体阳性血清和2份PEDV抗体阴性血清),用同批包被的酶标反应板检测4份血清样本,读取吸光光度值并计算批内变异系数(CV%)。用3个不同批次酶标反应板检测上述4份血清样本,读取吸光光度值计算得到PI值,并分析计算批间变异系数(CV%)。
1.4 与商品化试剂盒的比较
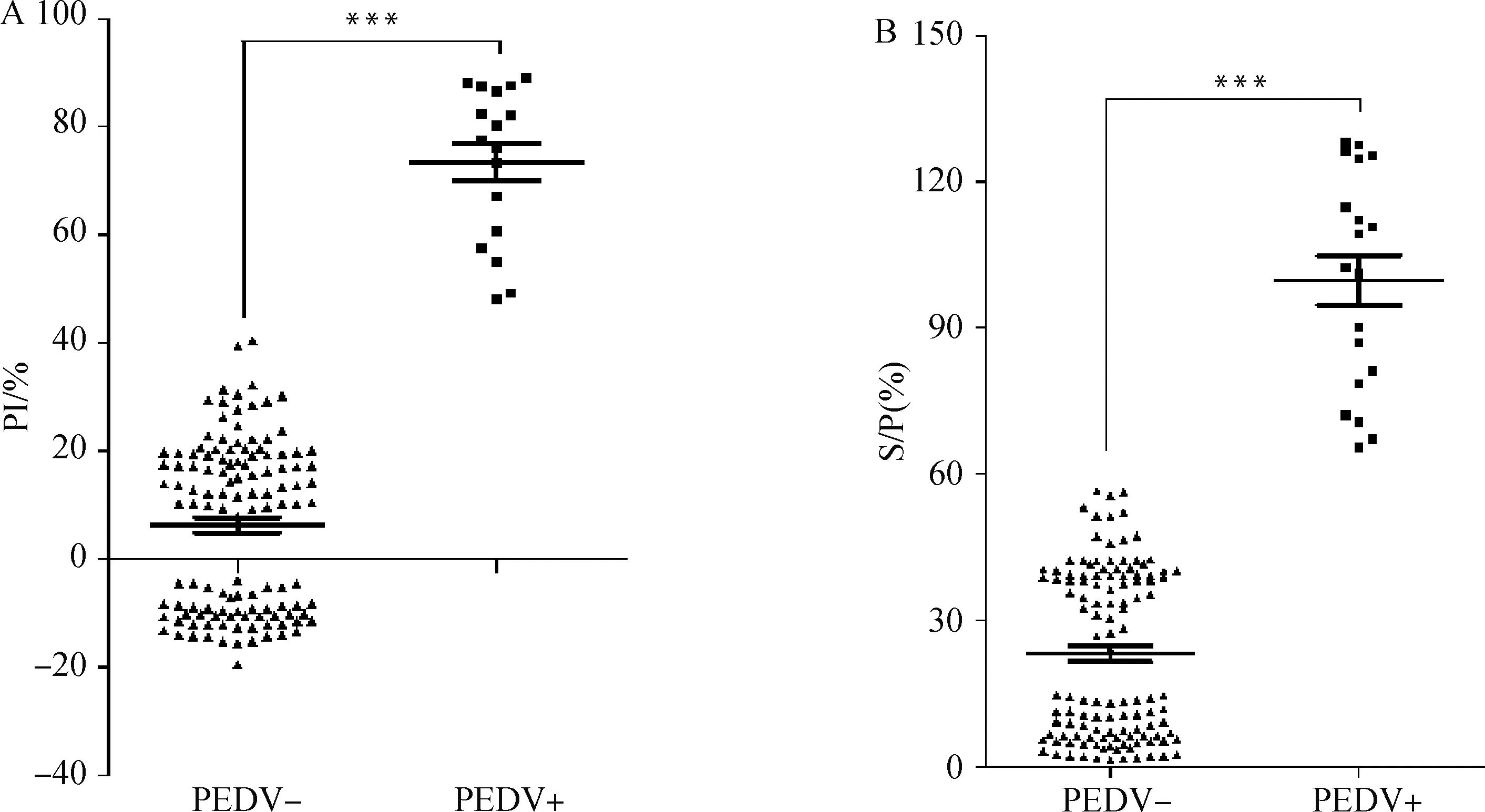
用本研究建立的检测方法和市售IDvet PEDV间接ELISA抗体检测试剂盒共同检测140份田间猪血清样品,读取吸光光度值计算得到PI值,分析计算阳性符合率、阴性符合率及kappa值。当0 采用镍柱层析法纯化PEDV N蛋白,SDS-PAGE检测得到1条约60 ku的条带(图1A),纯化后的目的蛋白条带单一,与预测条带大小一致,说明成功纯化N蛋白。Western blot结果表明,N蛋白与PEDV阳性血清和Nb2纳米抗体均能够发生特异性反应(图1B、C)。 M.蛋白相对分子质量标准;A.PEDV N蛋白的SDS-PAGE分析;B.PEDV N蛋白与PEDV抗体阳性血清反应原性鉴定;C.PEDV N蛋白与PEDV Nb2纳米抗体反应原性鉴定 利用棋盘滴定法将浓度为0.15 mg·mL-1N蛋白用包被液从1 250 ng·mL-1倍比稀释至156.25 ng·mL-1包被96孔酶标反应板,阴阳性待检血清用样品稀释液分别稀释成3个梯度1∶1、1∶5和1∶10后进行检测,计算NPI值和PPI值(图2A、B)。 A.阴性待检血清阻断率;B.阳性待检血清阻断率;C.阳性待检血清阻断率/阴性待检血清阻断率。图例示N蛋白浓度(单位:ng·mL-1) 根据PPI/NPI值最大为最佳条件原则,确定N蛋白的最佳包被浓度及血清样品最佳稀释度。结果显示,当N蛋白包被浓度625 ng·mL-1,血清稀释度为1∶1稀释时,PPI/NPI值最大(图2C)。 用1、2、3号样品稀释液分别按照“2.2”最佳稀释倍数对阴阳性待检血清稀释后进行检测,计算得到NPI值和PPI值。结果表明,用2号样品稀释液稀释血清样品时,PPI/NPI值最大,2号与1号、3号均差异显著(P<0.05,P<0.01)。因此,最佳样品稀释液为1% BSA[0.9% NaCl,0.5% Tween-20,0.05 mol·L-1MOPS(pH7.0)]。 将已包被好的酶标反应板用1、2、3、4、5号5种不同的封闭液4 ℃封闭10 h。计算NPI值和PPI值。结果表明,1号封闭液封闭时,PPI/NPI值最大。因此最佳封闭液为0.5% BSA(1%蔗糖,2%海藻糖,100 mL PBS溶液)。 用抗体稀释液将酶标抗体稀释成1∶1 000、1∶2 000、1∶3 000、1∶4 000、1∶5 000、1∶6 000、1∶7 000、1∶8 000。计算NPI值和PPI值(图3A)。根据PPI/NPI最大的原则确定1∶5 000为酶标抗体工作液的最佳工作浓度(图3B)。 A.阴阳性待检血清阻断率;B.阳性待检血清阻断率/阴性待检血清阻断率 图4 100份已知PEDV阴性血清的PI结果分布 用本研究建立的PEDV抗体检测方法,对PEDV、PRRSV、PCV2、TGEV、CSFV抗体阳性血清和健康猪血清进行检测,读取OD450 nm值分析计算PI值,并与临界值进行比较。结果表明,以上5种猪病抗体阳性血清的PI值均小于45%,证实本研究建立的PEDV阻断ELISA抗体检测方法特异性良好(图5)。 图5 N蛋白阻断ELISA特异性试验 用本研究建立的检测方法和市售IDvet PEDV间接ELISA抗体检测试剂盒分别检测倍比稀释的阳性对照,读取吸光光度值并分析计算S/P值和PI值,判定阴阳性,并与市售IDvet PEDV抗体检测试剂盒检测结果进行对比。结果表明,IDEVT PEDV抗体检测试剂盒的最低稀释度为1∶32(图6A),而本方法的最低稀释度为1∶16(图6B),灵敏度只降低了一个稀释度,因此本研究建立的抗体检测方法具有良好的灵敏性。 图6 IDvet间接ELISA和阻断ELISA灵敏性试验 用本研究建立的抗体检测方法对4份血清样品(阳性血清和阴性血清各2份)进行检测,以评估该方法的批内重复性。选取3个不同生产批次的酶标反应板对上述4份血清样品进行检测,用于批间重复性的评估。每个血清设置3个平行孔,通过阻断率PI值计算变异系数(CV%)。结果显示,批次1批内变异系数分别为0.71%、1.00%、4.66%、4.08%;批次2批内变异系数分别为0.74%、0.98%、2.86%、2.34%;批次3 的批内变异系数分别为0.85%、1.01%、3.75%、1.89%。批次1、2、3的批间变异系数分别为1.07%、1.32%、5.46%、7.16%。因此批内及批间变异系数均小于10%,表明本研究建立的抗体检测方法重复性好。 用本研究建立的PEDV阻断ELISA抗体检测方法与市售IDvet PEDV间接ELISA抗体检测试剂盒共同检测140份田间猪血清样品,由图7A、B可知,阻断ELISA检出阳性17份,阴性123份;间接ELISA检出阳性19份,阴性121份;因此两种检测方法的阳性符合率为89.5%(17/19),阴性符合率为98.4%(121/123),说明阻断ELISA与商品化试剂盒的敏感性和特异性相近;同时两种方法检测的阴阳性结果均存在极显著差异(P<0.001,P<0.001)。 图7 阻断ELISA(A)和间接ELISA(B)临床试验 用表格对两种方法进行统计,计算Kappa值,结果表明,Kappa值为0.87(>0.75),说明两种检测方法几乎完全一致(表1)。综合以上,本研究建立的PEDV阻断ELISA抗体检测方法与市售IDvet PEDV间接ELISA抗体检测方法检测效果相当。 表1 阻断ELISA与商业化间接ELISA的比对结果 据报道,PEDV主要感染新生仔猪,一旦被感染,死亡率可高达100%[27]。在过去的十年,我国多地经常有PED的暴发,该病发病迅猛,传播速度快,当前市面上尚无特异性针对该病的特效药及疫苗,因此快速准确的血清学抗体检测方法对于PED的流行病学调查和后续疫苗免疫效果的评估具有重要的意义。 当前我国检测PEDV抗体大多采用国外进口的间接ELISA检测试剂盒,虽然特异敏感,准确度高,但其价格昂贵,应用于基层大批量的检测不太现实。N蛋白一般在病毒感染早期表达和分泌,并且高度保守,故常作为早期诊断的优势蛋白。根据肖教授实验室[8]前期已发表文章可知,Nb2纳米抗体是通过噬菌体展示技术和PE-ELISA连续3次从高质量的噬菌体展示VHH文库中成功分离而得到。Nb2可以特异性结合PEDV N蛋白,而不与TGEV N蛋白发生交叉反应,说明特异性好;测定抗体对特定抗原的亲和力,对筛选抗体十分重要。亲和力的大小既可以用结合常数Ka表征,也可以用解离常数Kd表征。通过表面等离子体共振(SPR)分析,Ka值为9.21×105·(M·s)-1,说明Nb2与PEDV N蛋白结合力高,同时综合Ka/Kd值(5.32×108M),表明Nb2与PEDV N蛋白具有很好的结合活性和亲和力[8]。同时本研究将N蛋白、PEDV阳性血清和Nb2均进行了反应性验证,结果也显示反应性良好。综合以上特性拟建立一种特异、敏感且可应用于基层的PEDV阻断ELISA抗体检测方法。 目前,最常用于ELISA的两种抗体标记的探针是辣根过氧化物酶(HPR)和生物素[21,28-29]。HRP活性高,稳定,分子量小,同时标记方法也更加简便和成熟,因此采用HRP作为标记的探针。本研究通过检测与PEDV在临床上相似而容易混淆的猪源CSFV、PRRSV、TGEV、PCV2阳性血清,结果证明本方法特异性好;通过检测不同稀释度的阳性对照,同时与进口IDvet ELISA进行比较,证明其敏感性较高;为了评估本研究制备的ELISA检测方法的实用性,将其与进口IDvet ELISA同时检测140份血清,结果证明两种方法的kappa值为0.87,为几乎完全一致,kappa值是检验两个检测方法一致性的重要指标,kappa值越大说明两种检测方法的一致性越高[30-31]。综上所述,本研究建立的阻断ELISA抗体检测方法可应用于基层快速、灵敏的特异性检验。 成功建立了一种检测猪流行性腹泻病毒抗体的阻断ELISA检测方法,可通过计算阴阳性阻断率判定血清中抗体水平,可用于猪流行性腹泻的流行病学调查和抗体水平的监测。2 结 果
2.1 PEDV N蛋白的纯化与鉴定

2.2 PEDV N蛋白最佳包被浓度及血清样品最佳稀释度的确定

2.3 样品稀释液的确定
2.4 封闭液的确定
2.5 酶标抗体工作液最佳工作浓度的确定
2.6 判定标准的确定

2.7 特异性试验

2.8 灵敏性试验

2.9 批内和批间重复性试验
2.10 与商品化试剂盒的比较

3 讨 论
4 结 论

