3种食源性致病菌 TaqMan 多重荧光定量PCR检测方法的建立
王华健,张 宁,杨 威,赵志强,李 茜,陆 安,田 勇,何 欣,赵兴华,4*,李杰峰*
(1.河北农业大学动物医学院,保定 071000;2.河北省畜牧兽医研究所,保定 071000;3.石家庄市金元康牧药业有限公司,石家庄 051130;4.河北省兽医生物技术创新中心,保定 071000)
食源性疾病是食品安全的主要问题之一,据世界卫生组织(World Health Organization, WHO)统计报告,全球平均每年有上亿腹泻病例,以儿童死亡率最高,其中超70%疾病由致病微生物所致[1]。自2015年我国系统开展食源性疾病监测以来,新的食源性细菌感染不断出现,大肠杆菌O157∶H7和产单核细胞李氏杆菌感染是近年重要的食源性疾病[2]。大肠杆菌O157∶H7是肠出血性大肠杆菌(enterohemorrhagicEscherichiacoli, EHEC)的代表血清型,1999年、2000年相继在我国安徽和江苏两省暴发流行,并波及中原及西部地区,在华北、东北及华东少数地区也出现了散发病例。沙门菌在我国分布广泛,刘继开等[3]调查研究发现除西藏外所有省份均有检出,最常见血清型为鼠伤寒型和肠炎型,除此之外,近年来,非伤寒型沙门菌(NTS)也被认为是我国食源性疾病的主要病原菌。WHO将产单核细胞李氏杆菌列为与高住院率和死亡率有关的主要食源性病原体。2015年,美国疾病预防控制中心(CDC)报道了一起由产单核细胞李氏杆菌引起的食源性疾病暴发事件,至少8人因食用蓝铃(Bule Bell)公司冰淇淋产品患病,导致3人死亡。国外研究发现生鲜肉中产单核细胞李氏杆菌污染最严重,对四环素类、氯霉素和青霉素等抗生素耐药[4-5],国内牛桓彩等[6]通过对产单核细胞李氏杆菌流行病学和耐药性研究也有相似结论。综上,大肠杆菌O157∶H7、沙门菌和产单核细胞李氏杆菌在食品中污染严重、危害巨大,针对这3种食源性致病菌建立一种快速检测方法非常必要。
食源性致病菌检测方法中,目前最常用的是细菌分离培养结合生化鉴定,但该传统方法费时、费力且不能对食源性致病菌进行深入分析。分子生物学经过几十年的发展,已经广泛应用于食源性致病菌的检测,基于核酸和荧光标记的荧光定量PCR(qPCR)方法作为先进的技术手段,具有特异性强、灵敏度高、耗时短等优点[7]。目前,应用qPCR方法针对一种或多种食源性致病菌的检测稳定,但未见关于这3种致病菌的多重qPCR检测方法的研究和市场专利产品等。rfbE基因是大肠杆菌O157∶H7的特异基因,rfb基因簇编码多种将低聚糖单元组装成特异O抗原所必需的酶[8];沙门菌吸附和侵袭上皮细胞表面蛋白由invA基因合成,是主要毒力因子且核苷酸序列保守[9];产单核细胞李氏杆菌溶血素编码基因hlyA高度保守和特异[10]。本研究基于3种致病菌保守性基因拟建立一种可同时检测这3种食源性致病菌的多重qPCR方法,用于食品中致病菌污染检测。
1 材料与方法
1.1 标准菌株
试验所用标准菌株共10株,目标菌株为大肠杆菌O157∶H7(EscherichiacoliO157∶H7,NCTC 12900)、沙门菌(Salmonela)和产单核细胞李氏杆菌(Listeriamonocytogenes)3种,其余7种供试菌株有大肠杆菌(Escherichiacoli)、表皮葡萄球菌(Staphylococcusepidermidis)、金黄色葡萄球菌(Staphylococcusaureus)、克雷伯菌(Klebsiellaspp.)、巴氏杆菌(Pasteurella)、猪链球菌2型(Streptococcussuistype 2)和粪肠球菌(Enterococcusfaecalis),所有菌株均保存于河北省畜牧兽医研究所微生物室菌种保藏库。
1.2 主要试剂和培养基
通用型DNA提取试剂盒、M5 GoldStar TaqMan Mixture(北京聚合美生物科技有限公司);溶菌酶(北京索莱宝科技有限公司);营养肉汤(nutrient broth, NB)、改良EC肉汤(Modified EC Broth, mEC+n)、改良山梨醇麦康凯琼脂(Modified Sorbitol MacConkey Agar, CT-SMAC)、缓冲蛋白胨水(buffered peptone water, BPW)、四硫磺酸盐煌绿增菌液基础(tetrathionate broth base, TTB)、亚硒酸盐胱氨酸增菌液(elenite cystine broth, SC)、沙门氏菌显色培养基(第二代)、李氏菌增菌肉汤基础(Listeriaenrichment broth base, LB1, LB2)、PALCAM 琼脂(青岛海博生物技术有限公司);法国科玛嘉李斯特菌显色培养基(上海欣中生物工程有限公司)。
1.3 主要仪器
Light Cycler®96实时荧光定量PCR仪(德国罗氏诊断有限公司)、K5500超微量分光光度计(北京凯奥科技发展有限公司)。
1.4 引物和探针
登录NCBI网站,在GenBank中分别下载大肠杆菌O157∶H7、沙门菌和产单核细胞李氏杆菌的保守基因rfbE、invA和hlyA序列。应用MegAlign软件进行序列比对,选择合适的基因序列,应用Primer Express 3.0.1软件设计引物和TaqMan探针。引物和探针序列见表1所示,各引物和探针均由上海生工生物工程股份有限公司合成。

表1 引物和探针序列
1.5 菌株培养及细菌基因组DNA提取
将大肠杆菌O157∶H7、沙门菌和产单核细胞李氏杆菌分别接种于NB中复苏,37 ℃ 培养12 h后进行平板培养基分离[大肠杆菌O157∶H7,改良山梨醇麦康凯琼脂(CT-SMAC)培养基;沙门菌,沙门氏菌显色培养基(第二代);产单核细胞李氏杆菌,PALCAM 琼脂培养基]。在各平板上挑取单个菌落于NB中37 ℃ 纯培养12 h,取1 mL细菌纯培养液,按通用型DNA提取试剂盒提取各细菌基因组DNA。用K5500超微量分光光度计测定各细菌DNA模板的浓度和纯度,并计算DNA拷贝数。DNA模板于-20 ℃保存备用。
1.6 单重qPCR 扩增及特异性试验
分别以目标菌株和供试菌株的基因组DNA为模板进行扩增。反应体系:2×M5 GoldStar TaqMan Mixture 10 μL,上下游引物各0.6 μL,探针0.4 μL,DNA模板2 μL,ddH2O补足至20 μL。引物和探针浓度为10 mmol·μL-1。反应参数:95 ℃预变性15 min;95 ℃变性3 s,60 ℃退火并延伸30 s,40个循环,在每个循环的退火延伸阶段收集荧光信号。以NB培养液为阴性对照,无菌超纯水为空白对照。
1.7 多重qPCR 体系的建立和优化
以单重qPCR反应体系为基础,对3株目标菌株引物和探针的使用量进行优化,确认最优多重qPCR反应体系。
1.7.1 多重qPCR特异性试验和标准曲线的建立 同步骤“1.5”提取各目标菌株的DNA模板并用ddH2O倍比稀释为浓度107~103copies·μL-1,将3种目标菌株的DNA模板按每个稀释度等量混匀并做3个重复,按优化后的qPCR反应体系,分别对大肠杆菌O157∶H7、沙门菌、产单核细胞李氏杆菌和其他7株供试菌种进行多重qPCR扩增,构建标准曲线。
1.7.2 多重qPCR灵敏性和重复性试验 同步骤“1.7.1”,将3种目标菌株的DNA模板等量混匀,倍比稀释浓度为107~100copies·μL-1,按优化后的反应条件进行多重qPCR扩增确定其灵敏性,每个稀释度设3个重复。重复性试验根据灵敏性试验选择合适的DNA模板浓度,每隔5 d做一组重复性试验,共3次。根据结果分别计算批内变异系数(CV%)和批间变异系数。
1.8 临床样品检测
在本地超市、农贸市场和商店中购买120份生鲜肉,包括鸡肉41份、猪肉47份、牛肉18份、羊肉14份。以进出口行业标准(SN/T 1870—2016《出口食品中食源性致病菌检测方法实时荧光PCR法》)为基础,按优化后的多重qPCR反应体系进行样品检测,同时根据国家标准(GB 4789.36—2016《食品安全国家标准食品微生物学检验 大肠埃希氏菌O157∶H7/NM检验》、GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》、GB 4789.30—2016《食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验》)进行检测结果对比,验证多重qPCR方法的准确性。
1.9 数据统计
应用SPSS 21.0软件对试验数据进行统计分析。
2 结 果
2.1 DNA模板浓度和纯度的测定及单重qPCR特异性
DNA模板浓度和纯度(A260nm/A280nm)测定数值如下:大肠杆菌O157∶H7分别为166.39 ng·μL-1和1.799,沙门菌分别为272.62 ng·μL-1和1.847,产单核细胞李氏杆菌分别为35.905 ng·μL-1和1.967。拷贝数计算公式:DNA拷贝数=[6.02×1023(copies·mol-1)×DNA浓度(g·μL-1)]/目的基因组的分子量,式中需要的条件有DNA浓度和目的基因组的分子量。沙门菌基因组大小为4.8 Mb,1 bp碱基分子量为652 g·mol-1[11];大肠杆菌O157∶H7基因组大小约4.2 Mb[12];产单核细胞李氏杆菌基因组大小约3 Mb[13]。3种目标菌株分别进行单重qPCR反应,结果见图1所示,扩增曲线明显,其他供试菌株均无扩增曲线,表明试验设计的3种目标菌株的引物和探针特异性良好。

1.大肠杆菌O157∶H7;2.沙门菌;3.产单核细胞李氏杆菌;4~11.其他供试菌株(E. coli、S. epidermidis、S. aureus、Klebsiella、Pasteurella、S. suis type 2、E. faecalis)和空白对照
2.2 多重qPCR反应体系的优化
以引物和探针浓度为10 mmol·μL-1为基础,对多重 qPCR 反应体系的各引物、探针和Mixture等用量进行优化,选出最优反应体系为2×M5 GoldStar TaqMan Mixture 30 μL,3种细菌混合上、下游引物1.5 μL,混合探针0.6 μL,混合模板4 μL,ddH2O 补足至50 μL。反应参数:95 ℃预变性15 min;95 ℃变性3 s,60 ℃退火并延伸30 s,40个循环,在每个循环的退火延伸阶段收集荧光信号。
2.3 多重qPCR特异性和标准曲线的建立
多重qPCR特异性试验结果为3种目标细菌均显示良好的扩增曲线,非目标细菌和空白对照均无扩增,表明优化后的多重qPCR反应对大肠杆菌O157∶H7、沙门菌和产单核细胞李氏杆菌具有良好的特异性,且不产生交叉反应。多重qPCR标准曲线结果见图2,大肠杆菌O157∶H7的标准曲线线性方程为y=-3.743x+45.675,相关系数R2= 0.999,扩增效率为85%;沙门菌的标准曲线线性方程为y=-3.62x+43.13,R2=0.999,扩增效率为88.9%;产单核细胞李氏杆菌的标准曲线线性方程为y=-3.926x+44.296,R2=0.995,扩增效率为80%。R2均大于0.99,表明DNA拷贝数浓度的对数值(X轴)与Ct值(Y轴)之间具有良好的线性关系,引物和探针的扩增效率较高,建立的多重 qPCR 反应体系稳定。

1.大肠杆菌O157∶H7;2.沙门菌;3.产单核细胞李氏杆菌
2.4 多重qPCR灵敏性和重复性
多重qPCR灵敏性试验阳性结果判定为Ct≤35[14-15],qPCR试验通常设定为40个循环,当Ct值>35时,反应的随机性增大,重复性试验误差增加,可能伴随非特异性产物的影响。大肠杆菌O157∶H7、沙门菌和产单核细胞李氏杆菌的灵敏性均为104copies·μL-1。根据重复性试验结果选择浓度梯度为107~104copies·μL-1的DNA模板,4个梯度批内变异系数为0.09%~2.97%,批间变异系数为0.23%~7.82%。变异系数只在平均值不为零时有意义,反应单位均值上的离散程度,当批内变异系数小于5%~10%,批间变异系数小于15%~20%时,表明试验结果可重复性高,建立的多重qPCR检测方法重复性好,具体数据见表2和表3。

表2 多重qPCR批内重复性试验
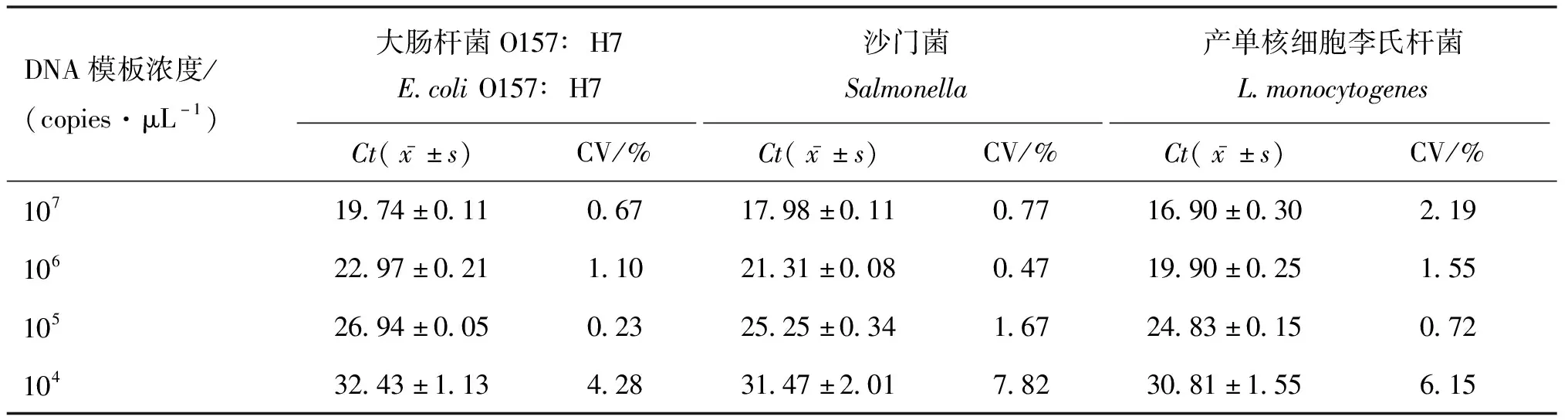
表3 多重qPCR批间重复性试验
2.5 临床样品检测
以国家标准检测方法为对照,检验已建立的多重 qPCR方法的准确性,结果对比见表4。市场采集的120份生鲜肉样品中,国家标准方法检测出2份大肠杆菌O157∶H7、13份沙门菌和21份产单核细胞李氏杆菌;使用建立的多重qPCR法检出2份大肠杆菌O157∶H7、14份沙门菌和21份产单核细胞李氏杆菌。食品检测中用传统培养法鉴定的阳性样本与qPCR方法检测结果一致,应用qPCR方法检测食源性致病菌的阳性检出率较传统培养法略高,而多重qPCR方法的检测时间更短。

表4 多重qPCR与国标法检测对比试验
3 讨 论
传统的细菌鉴定需要增殖培养、选择性培养和生化鉴定3个步骤,是检测食源性致病菌的“金标准”,缺点是耗时长,通常需要5~6 d,且检测灵敏度低、无法进行定量分析[14]。目前,已报道多种食源性致病菌快速检测方法[16],除平板检测法外,常规检测方法还有化学分析法和免疫分析法等,这些方法步骤繁琐、耗时长、成本高,需要高专业水平人员操作,因此开发以分子生物学、免疫分析、生物传感器、代谢学、核酸适配体为基础,具有操作简单、灵敏、快速和低成本等优点,具备检测复杂食品样品中致病菌的方法是主要研究方向。随着分子生物学的发展和应用,实时荧光定量聚合酶链反应(qPCR)已成为一种强大的研究和诊断工具,简便、快速、灵敏和特异是qPCR满足核酸检测所需的4个关键方面[17]。本研究参考多篇文献报道的3种致病菌保守基因[11,14,18],以大肠杆菌O157∶H7rfbE基因、沙门菌invA基因和产单核细胞李氏杆菌hlyA基因设计3种致病菌特异性引物和探针,建立多重qPCR方法,进行特异性、灵敏性、重复性和临床样品检测试验。结果表明,建立的多重qPCR方法对3种致病菌均特异性扩增;灵敏性高,均达到104copies·μL-1,目前国内多数多重qPCR方法的研究中[14,19-20]灵敏性检测限为102~105copies·μL-1,本研究建立的方法灵敏性符合理论预期;重复性良好,批内变异系数为0.09%~2.97%,小于5%,批间变异系数为0.23%~7.82%,小于10%;临床样品检测同国标法差异小,国标法检测阳性样品用本研究方法检测结果均为阳性;检测时间短,仅1 h。
本研究建立的多重qPCR方法在食品检测结果中显示沙门菌检出率略高于国标法,但所有受污染样品都被检出,证明建立的方法具有特异性和有效性,可用于实际检测。微生物在自然环境中主要有活菌(viable)、活的非可培养状态(viable but non-culturable, VBNC)、具有生物活性的死菌(ghosts)以及细胞膜损伤的死菌(membrane compromised)4种存在状态。有研究表明[21],处于VBNC状态时细菌不能在异养平板上生长,但仍具有新陈代谢、致病性和毒性,从而逃避国标法的检测,成为影响食品安全的隐性污染源,qPCR法作为分子生物学方法根据致病菌的特异性基因来检测,不区分活菌和死菌,多重qPCR法的阳性检测率略高于国标法,多篇文献报道[14-15,22]也证实了这一点。多重qPCR反应在同一体系下进行,大大节省了试剂和材料,检测程序更加精准、快速[22]。综上所述,研究建立的多重qPCR方法可作为食品中大肠杆菌O157∶H7、沙门菌和产单核细胞李氏杆菌3种食源性致病菌一种准确、快速、稳定的检测手段。
应用本研究建立的多重qPCR方法对保定市市售生鲜肉食品中3种致病菌污染进行检测分析,采集的120份生鲜肉样品中,受污染样品34份,总检出率为28.33%,检测出2份大肠杆菌O157∶H7、14份沙门菌和21份产单核细胞李氏杆菌,阳性检出率分别为1.67%、11.67%和17.50%,其中有3份样品为沙门菌和产单核细胞李氏杆菌混合感染。2010—2016年,河北省共报告食源性疾病暴发事件308起,发病3 152人,死亡25人,病死率为0.79%,其中微生物性是主要致病因素,占24.7%[23]。近年来,河北省对食源性致病菌污染研究较少,关于石家庄、沧州和邯郸等部分地区流行情况的文献报道显示食源性致病菌存在不同程度污染[24-26],2015年,石家庄市市售食品食源性致病菌总检出率为25.00%,沙门菌和产单核细胞李氏杆菌检出率分别为4.08%和3.06%;2016—2017年,沧州市食品食源性致病菌总检出率为22.38%;2014 年邯郸市食品致病菌监测总检出率为14.4%,产单核细胞李氏杆菌为6.0%,沙门菌为1.3%。综上所述,不同地区存在不同程度的食源性致病菌污染,对食品安全造成潜在威胁,必须加强各地食源性致病菌污染监测和食品卫生管理,保障食品安全。
4 结 论
建立了能快速、准确检测食品中大肠杆菌O157∶H7、沙门菌和产单核细胞李氏杆菌3种食源性致病菌的多重qPCR检测方法。应用该方法对120份保定市售生鲜肉样品进行检测,总检出率为28.33%,大肠杆菌O157∶H7、沙门菌和产单核细胞李氏杆菌阳性检出率分别为1.67%、11.67%和17.50%。

