骨碎补总黄酮对缺氧环境中犬骨髓间充质干细胞成骨分化潜能的影响
龙亚丽,田启会
(1.甘肃农业大学动物医学院,兰州 730070; 2.甘肃畜牧工程职业技术学院,武威 733006)
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)属于骨髓基质干细胞,同时具有横向向骨分化的能力,因此被认为是骨组织损伤修复的种子细胞之一[1-2]。但骨组织损伤通常伴随着严重的组织肿胀,形成局部缺氧环境[3]。文献报道,缺氧一方面可以导致BMSCs生物学特性改变,同时还会造成其分化能力的异常,这为其在应用中的有效性提出挑战[4-5]。BMSCs骨分化能力是受损骨组织再生和修复的基础,因此,如何避免缺氧环境中BMSCs的成骨分化能力异常改变,是BMSCs应用前必需解决的关键问题。
BMSCs大量存在于脊髓中,骨碎补作为补肾中药,根据“肾主骨生髓”理论,其极可能是能够促进BMSCs增殖和成骨分化的重要药物[6-7]。因此,在中医理论的支持下,骨碎补总黄酮(total flavonoids ofDrynariaRhizoma, TFDR)可能对BMSCs成骨分化能力具有影响作用。本研究拟通过建立缺氧微环境,并探究骨碎补总黄酮对缺氧环境中BMSCs成骨分化的影响作用。
1 材料与方法
1.1 材料
1.1.1 细胞来源 犬骨髓间充质干细胞(BMSCs)细胞株购自美国 ScienCell 公司(编号:7500)。
1.1.2 主要试剂及仪器 骨碎补总黄酮(北京岐黄制药有限公司,批号:国药准字Z20133051);间充质干细胞基础培养基、胎牛血清(ScienCell);RT-PCR转录试剂盒(TaKaRa公司,批号:AKG1212A),RT-PCR荧光定量试剂盒(TaKaRa公司,批号:AL12412A),兔抗人Runx2、Osterix多克隆抗体(GeneTex),山羊多克隆抗体二抗抗兔(Alexa Fluor®488)(Abcam公司),OriCell TM 狗骨髓间充质干细胞成骨诱导分化培养基试剂盒(Cyagen 批号:CAXMX-90021),JC-10细胞线粒体膜电位(MMP)活细胞荧光染料(美国AAT公司,批号:2191362),碱性磷酸酶(AKP)检测试剂盒(南京建成生物工程研究所,批号: 20170719);PCR引物序列见表1。

表1 PCR引物序列
CO2细胞低氧培养箱(日本SANYO公司),酶标仪(美国BIO-RAD公司),光学显微镜、激光共聚焦显微镜FV10-ASW 2.1 Viewer(日本Olympus公司),FACS CelestaTM型流式细胞仪(美国BD公司),RT-PCR仪(美国BIO-RAD公司)。
1.2 方 法
1.2.1 试验分组 试验分为空白组(Control)、低氧组(Hyp)、TFDR干预组(Hyp+TFDR),低氧组和TFDR组细胞培养氧浓度为10%[8],TFDR的浓度为50 μg·mL-1(前期预试验筛选出能够促进BMSCs最大增殖的浓度)。
1.2.2 细胞培养 取第3代对数期生长的BMSCs细胞,并调整成细胞浓度为1×104个·mL-1的单细胞悬液,接种于包被明胶的六孔板内,每组定容为2 mL,并设3个平行重复。将细胞置于常氧环境培养箱中培养,至细胞汇合达到60%~70%时,低氧组和TFDR干预组置于10%的氧浓度环境中培养4周,TFDR干预组加入含有50 μg·mL-1TFDR的培养基。在第2周结束后,向六孔板中加入骨髓间充质干细胞成骨诱导分化诱导剂,继续在10%的氧浓度环境中成骨诱导分化14 d,TFDR干预组诱导培养基中含有50 μg·mL-1TFDR。
1.2.3 细胞形态观察 细胞成骨诱导过程中,每天将各组细胞置于显微镜下进行形态观察,并采集图像,重点观察钙结节形成情况。
1.2.4 茜素红染色 成骨诱导结束后,弃掉六孔板中剩余诱导液,PBS清洗;每孔加入 2 mL细胞固定液,固定 30 min后,弃掉细胞固定液,PBS清洗两次。每孔加入1 mL茜素红染色液,染色3~5 min。PBS清洗两次,于显微镜下观察。
1.2.5 碱性磷酸酶(ALP)活性测定 诱导完成后,弃培养瓶中诱导液,PBS反复摇晃清洗,用细胞裂解液裂解细胞,反复吹打后,12 000 r·min-1离心6 min,取上清,检测ALP活性。在96孔板中分别加入标准品和各组样品与底物的混合液,37 ℃条件下孵育30 min。每孔加入终止液终止反应,于酶标仪检测每孔OD405 nm值。ALP活性单位为“U·g-1”。
1.2.6 流式细胞术检测线粒体膜电位 诱导完成后,用胰酶消化细胞,用PBS清洗1遍后,用PBS将细胞重悬,并移入流式上样管,将JC-10荧光探针工作液加入细胞悬液,37 ℃避光孵育20 min后,通过流式细胞仪进行检测。当膜电位水平低时,激发波长527 nm,通过FITC荧光通道收集;当膜电位水平高时,激发波长590 nm,通过PE荧光通道收集,每组细胞进行3次重复。
1.2.7 激光共聚焦显微镜检测成骨分化关键基因荧光表达 将盖玻片平铺入24孔细胞培养板中,将干预后的细胞消化、吹散并接种于6孔板中,汇合度控制在20%左右,进行培养。待细胞汇合度达到60%~70%时,每个孔中加1 mL 4%多聚甲醛,室温固定20 min,弃多聚甲醛,再加入1 mL甲醇继续固定5 min。弃甲醇,加入1 mL免疫荧光用Blocking buffer,室温封闭10 min。弃封闭液,加入含兔抗Runx2抗体(1∶500)和Osterix抗体(1∶500)的Blocking buffer,慢摇过夜。PBS液,洗3遍后,加入1 mL含Alexa Fluor® 488 F(ab)羊抗兔荧光二抗(500∶1)的Blocking buffer,避光慢摇1 h。PBS液润洗细胞5遍,每遍5 min。载玻片上滴加含DAPI染料的封片液,将盖玻片取出并倒扣在封片液上,于激光共聚焦显微镜下观察,每组细胞随机挑选3个视野,每个视野随机选择10个细胞进行荧光定量,荧光表达水平通过FV10-ASW 2.1 Viewer软件进行分析。
1.2.8 RT-PCR检测成骨分化关键基因表达水平 干预完成后,提取各组细胞中RNA并进行浓度测定。以20 μL的体系反转录合成cDNA,并进行实时荧光定量检测,检测成骨分化关键基因Runx2、Osterix的转录水平,反应条件:95 ℃变性1 min;[95 ℃ 10 s,57 ℃ 20 s,72 ℃ 20 s收集荧光]40个循环;熔解曲线制备65~95 ℃,0.5 ℃·s-1。

2 结 果
2.1 TFDR对低氧环境中BMSCs形态学的影响
分别于诱导成骨分化第4、7、14天在倒置相差显微镜下观察细胞变化。空白对照组细胞生成较多高密度钙结节,成片分布;与空白对照组细胞相比,在分化前期(第0~7天),低氧条件下BMSCs高密度钙结节较少,后期(第8~14天)更明显;与低氧组相比,加TFDR组细胞诱导分化钙结节均明显增多(图1)。

图1 TFDR对低氧环境中 BMSCs形态学的影响
2.2 TFDR对低氧环境中BMSCs钙盐茜素红染色的影响
诱导各组细胞向成骨方向分化14 d,茜素红染色后倒置显微镜下观察,空白对照组BMSCs呈鲜红色,着色均匀,紧密连接成片;而低氧组细胞红色钙结节分布较为分散,结节明显较小;相较于低氧组,加TFDR组细胞生成钙结节沉积数量增多(图2)。

图2 TFDR对低氧环境中BMSCs 茜素红染色的影响(10×4)
2.3 TFDR对低氧环境中BMSCs ALP活性的影响
在405 nm波长条件下,检测各组细胞ALP活性值,与空白对照组细胞相比,低氧组细胞ALP活性明显降低,差异极显著(P<0.01);与低氧组相比,TFDR组细胞ALP活性升高,差异显著(P<0.05)(图3)。

与Control组相比,*.P<0.05,**.P<0.01;与Hyp组相比,#.P<0.05
2.4 TFDR对低氧环境中BMSCs线粒体膜电位的影响
通过流式细胞术检测各组细胞膜电位变化情况(图4A~C),结果显示,与空白对照组BMSCs相比,低氧组细胞线粒体膜电位降低,差异显著(P<0.05);与低氧组比较,TFDR干预组细胞线粒体膜电位增强,差异显著(P<0.05)(图4D)。

A.Control组;B.Hyp组;C.Hyp+TFDR组;D.各组线粒体膜电位;与Control组相比,*.P<0.05;与Hyp组相比,#.P<0.05
2.5 TFDR对低氧环境中BMSCs成骨关键基因Runx2和Osterix荧光表达的影响
激光共聚焦显微镜观察各组细胞Runx2和Osterix的表达,结果显示,与空白对照组BMSCs相比,低氧组细胞Runx2和Osterix荧光表达强度明显减弱,差异显著或极显著(P<0.05或0.01);与低氧组比较,TFDR干预组细胞Runx2和Osterix荧光表达强度增强,差异显著(P<0.05)(图5~7)。

图5 激光共聚焦显微镜观察各组BMSCs细胞Runx2的表达(10×40)
2.6 TFDR对低氧环境中BMSCs Runx2和Osterix基因水平表达的影响
通过RT-PCR检测各组细胞Runx2和Osterix的转录水平,结果显示,与空白对照组相比,低氧组细胞Runx2和Osterix基因转录水平降低;与低氧组比较,TFDR干预组细胞Runx2和Osterix基因转录水平增强(表2)。

表2 TFDR对低氧环境中BMSCs成骨相关转录因子的影响
3 讨 论
多向分化潜能是BMSCs的重要特点,在经过诱导后,其可以向多个胚层的组织细胞进行分化,其中包括骨细胞[1-2]。因此,BMSCs在组织再生科学方面的应用是现在的研究热点之一。目前,大量研究证实,BMSCs能够修复骨组织损伤,因而,BMSCs在骨损伤的修复方面具有开发潜力[1-2, 9]。但是,骨损伤通常也会引起肌肉组织的水肿或者是血肿的形成,肿胀将造成局部压迫,最终导致损伤局部形成缺氧环境[3]。尽管BMSCs的再生修复能力已经得到认可,但通过文献可发现,缺氧环境十分容易导致其生物学特性的改变,在不同的低氧浓度下均能造成大鼠间充质干细胞成骨、成脂分化能力的降低[10],这也可能成为制约BMSCs进一步应用于临床的关键。因此,有效地维持低氧环境下BMSCs成骨分化潜能,是其运用于临床损伤修复的前提之一。
ALP广泛分布于人体骨骼中,对骨形成具有重要意义,是BMSCs早期成骨分化能力评估的关键指标之一[11];Runx2是骨细胞的特异性转录因子,能够调节骨组织的形成和重建,并与破骨细胞分化及细胞外基质的形成密切相关[12-13]。Osterix(Osx)处于Runx2 的下游位置,受到Runx2的表达影响,Osterix是干细胞向成骨细胞分化过程中的重要标志基因。Runx2主要是在成骨细胞早期未成熟分化时期进行调节,而成骨细胞在成熟分化时期主要由 Osterix 进行调控[14-15]。而在成骨分化终末期,钙结节形成的多少是评估骨分化程度最关键的效应性指标。本研究以10%的氧浓度为缺氧标准进行低氧环境的模拟,并发现缺氧导致BMSCs成骨分化的早期调控酶ALP和早期调节基因Runx2的降低,成熟分化时期的调节基因Osterix表达降低,同时也引起关键的终末效应性标志物钙结节形成的明显减少。通过对成骨分化早期、成熟期及终末期相关标志物和基因的检测结果均提示,在模拟的低氧环境中BMSCs成骨分化的能力降低明显。细胞的分化需要能量供给,线粒体是细胞通过呼吸链进行能量代谢的关键场所,而在缺氧条件下,线粒体会因为产生的能量不足,无法持续支持BMSCs成骨分化,导致了成骨分化能力减弱[16-17]。通过检测细胞线粒体膜电位来评估线粒体的活性,发现低氧条件下,BMSCs线粒体膜电位明显下降,证实缺氧可以导致线粒体活性降低。
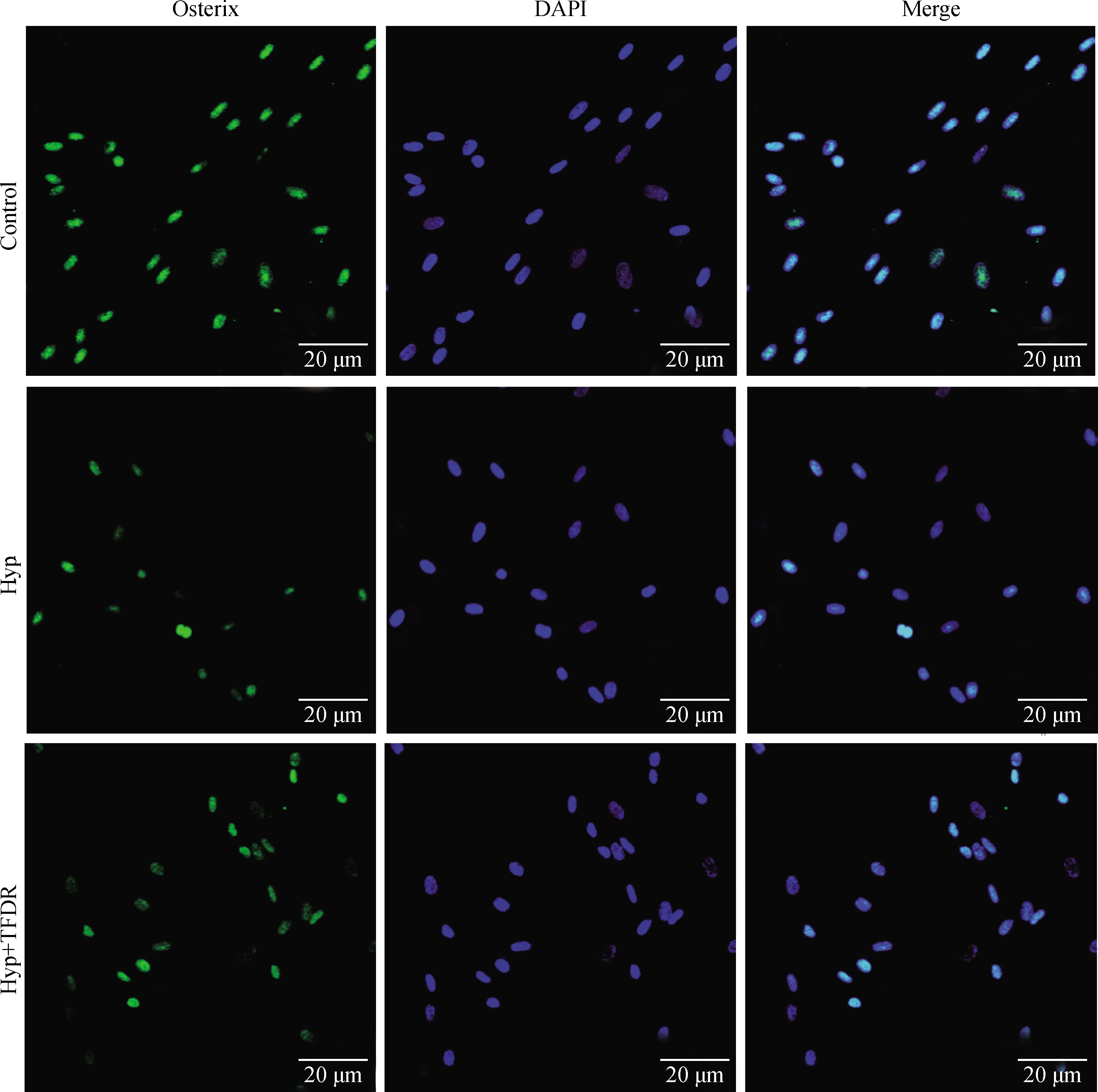
图6 激光共聚焦显微镜观察各组BMSCs细胞Osterix的表达(10×40)

与Control组相比,*.P<0.05,**.P<0.01;与Hyp组相比,#.P<0.05
传统中药骨碎补具有补肾强骨、活血止痛的功效,根据“肾主骨生髓”理论,骨碎补对骨相关疾病具有较好的治疗作用[18]。而骨碎补的主要成分骨碎补总黄酮(TFDR)在免疫调节、抗炎、骨修复等方面具有明显功效[5-6,19]。本研究用浓度为50 μg·mL-1的TFDR对低氧环境中BMSCs进行干预后,通过检测上述指标,发现TFDR能够有效地提高BMSCs成骨分化关键转录因子Runx2和Osterix表达,并促进其对成骨分化相关的酶ALP的转录、表达,增加末期的钙盐沉积量,线粒体活性升高,有效维持BMSCs在低氧环境中成骨分化能力的相对稳定。
综上,缺氧环境会导致BMSCs成骨分化能力降低,而TFDR能够维持缺氧环境中BMSCs成骨分化能力稳定。但是,体外模拟的低氧环境无法完全构建出体内的状况,研究还应进一步通过体内成骨试验证实TFDR对低氧环境中BMSCs成骨分化潜能的保护作用,但TFDR仍然值得被作为维护缺氧条件下干细胞生物稳定性的天然化合物进行进一步的研究。
4 结 论
骨碎补总黄酮能够维持低氧浓度下犬BMSCs线粒体活性、促进成骨分化关键基因Runx和Osterix基因表达,增加钙结节生成,进而提高低氧环境中犬BMSCs成骨分化能力,为骨碎补总黄酮防护缺氧环境中犬BMSCs的成骨分化能力降低以及BMSCs在骨折疾病治疗中的应用提供试验依据。

