circ-MTHFD1L促进胰腺导管腺癌进展的作用机制
郑坚江,阿木提江·马合木提,郭磊,刘跃全,张涛
(新疆维吾尔自治区人民医院 胰腺外科,新疆 乌鲁木齐 830001)
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是一种高度致死性的癌症,目前研究显示PDAC患者的五年生存率低于6%[1-2]。一般来说,胰腺导管腺癌来源于成熟的腺泡细胞转化为导管样细胞,转化过程称为腺泡化生(ADM),可由致癌基因突变或胰腺炎等因素诱发[3-4]。PDAC有两种不同的病变形式,包括导管内乳头状黏液瘤和胰腺上皮内瘤变。尽管对PDAC的研究已经开展了几十年,但患者的治疗效果和生活质量仍然很差[5-6]。因此,深入探讨PDAC的发病机制以便寻找到更好的治疗靶点和诊断方法迫在眉睫。
30年前首次报道的环状RNA(circRNA)是一个复杂的RNA家族[7]。既往circRNAs被认为是由RNA的意外剪接错误所产生,直到最近几年,全基因组分析证实circRNA是一种新型的环状RNA。circRNA通常有三种类型:外显子环状RNA、内含子环状RNA和基因间环状RNA,其中以外显子环状RNA最常见[8-9]。目前证据表明,circRNA在多种疾病中发挥着重要作用,例如帕金森病、动脉粥样硬化,尤其是在癌症中。例如,与正常结肠样本相比,肿瘤组织中环状RNA的比例总体下降,尤其是在结直肠癌样本中[10]。另有研究显示circRNA在PDAC中显著失调[11],circ-MTHFD1L是从MTHFD1L mRNA的chr6:151336015-151413723 位置剪接而成[11]。miR-217 作为一种与肿瘤相关的miRNA,已在非小细胞肺癌、喉癌及宫颈癌等肿瘤中进行报道[12-14]。此外,一项关于非小细胞肺癌的研究中发现miR-217 能够通过调控E2F3 影响其肿瘤进程[12]。这些数据表明miR-217和E2F3在肿瘤进程中扮演重要角色。然而circ-MTHFD1L在PDAC中扮演的作用尚不明确,因此本研究试图通过分子生物学手段深入探讨circ-MTHFD1L在PDAC中作为生物标志物的选择及靶向疗法的开发提供依据。
1 材料和方法
1.1 临床样本微阵列分析
GPL19978平台数据来分析GSE79634的微阵列数据集来筛选差异表达的circRNA。微阵列数据集包括20个PDAC样本和20个配对癌旁组织样本。以Fold change>2且P<0.05的筛选标准筛选出差异表达的circRNA并用R软件包进行火山图和热图展示。
1.2 临床组织样本
回顾性分析2018年1月至2019年12月新疆维吾尔自治区人民医院治疗的20例PDAC患者的癌组织及相应癌旁组织样本用于我们的研究,患者一般资料见表1。本研究方案通过我院医学伦理委员会批准(20171203),所有参与患者均签署知情同意书。癌组织和癌旁组织标本术后立即置于液氮中长时间保存。
纳入标准:(1)均经组织病理学活检诊断为 PDAC;(2)术前均未接受放疗和化疗或其他治疗;(3)患者依从性较好。
排除标准:同时患有其他恶性疾病患者。
1.3 细胞培养
人PDAC 细胞系,包括PANC-1、HPAC、CFPAC-1、BXPC-3 和人正常胰腺导管上皮细胞系HPDE6-C7,购自北京北纳生物有限公司。其中PANC-1、HPAC和HPDE6-C7 在含有10%胎牛血清的高葡萄糖DMEM培养基中培养,CFPAC-1 在Iscoves改良培养基(IMDM)(Gibco公司,美国)中培养。所有细胞置于5% CO2和37 ℃培养条件下培养。
1.4 RNase R处理
用circ-MTHFD1L和GAPDH在20 μL反应缓冲液在37 ℃温度中进行RNaseR消化反应45 min。通过乙醇沉淀法以除去酶和盐。以3U酶/1 μg RNA的比例重复消化和沉淀反应两次。用2.0% TAEAgarose凝胶电泳或2100生物分析仪(Aglient)对处理过RNA样品进行分析,并与未处理的RNaseR样品进行比较。所有实验重复三次。
1.5 shRNA质粒载体的构建
利用RNAi干扰序列设计软件BLOCK-iTTRNAi Designer(Invitrogen公司,美国)设计circ-MTHFD1L和E2F3 的干扰核苷酸序列,合成碱基数相同的无关核酸序列作为阴性对照。表1 显示干扰物的相关序列。circ-MTHFD1L和E2F3上构建质粒表达载体,在shRNA的5’和3’端分别引入BbsI和BamHI限制性位点合成单链寡核苷酸和互补链,然后购买pGPH1/GFP/Neo质粒载体含有新霉素抗性筛选标记并表达GFP蛋白的Gene Pharma(中国)分别与shRNA连接。重组质粒转化的大肠杆菌感受态细胞DH5α经广泛扩增后提取,分别命名为shRNA-circ-MTHFD1L、shRNA-E2F3和非特异性序列(shRNA-NC)。
1.6 细胞转染
pcDNA3.1-circ-MTHFD1L载体(p-MTHFD1L)、pcDNA3.1 载体、shRNA-circ-MTHFD1L载体、shRNA-E2F3 载体、pGPH1/GFP/Neo质粒载体、miR-217模拟物和miR-217抑制剂来自上海吉玛基因公司。转染前24 h,将处于对数生长期的PANC-1细胞用胰蛋白酶消化后重悬于完全培养基中,用移液管混合制成细胞悬液。细胞在6孔板(1×106/孔)中培养,置于5% CO2、37 ℃条件下培养18~24 h,直至细胞融合度达到80%~90%。转染前3 h,将原始培养基更换为不含血清和抗生素的新鲜基础(FBS)培养基。使用Gene Pharma(中国)的Lipofectamine 2000按照试剂盒说明进行转染,37 ℃、5% CO2培养箱中培养48 h。
1.7 实时荧光定量PCR(qRT-PCR)
组织样品和细胞系中的总RNA 由TRIzol 试剂(Invitrogen,美国)按照制造商的方案制备。然后,使用Prime Script RT试剂盒(宝生物,中国)合成cDNA。MiRNA和miRNA的QRT-PCR分析使用TaqMan MicroRNA Assay Kit(Applied Biosystems,美国)和SYBR®Premix Ex Tag™ Ⅱ(宝生物,中国)在ABI 7500 Real-Time上进行PCR系统(Applied Biosystems,美国)。PCR条件如下:95 ℃(30 s),95 ℃(5 s)和60 ℃(34 s)40个循环。GAPDH和U6作为研究的内参基因。基因的相对表达量采用2-ΔΔCT法进行评价。本研究涉及的引物序列见表2。
1.8 蛋白质印迹分析
转染后72 h后收集细胞,制备总蛋白后通过二辛可宁酸(CCA)蛋白质测定试剂盒(Beyotime Biotechnology,中国)测量蛋白质浓度。随后,蛋白质样品通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后转移到聚偏二氟乙烯(PVDF)膜(Millipore,美国)上,该膜在Tris缓冲盐水和吐温中封闭用5%脱脂奶粉浸泡2 h。接下来,将膜与兔抗一抗(1∶1 000)在4 ℃孵育过夜。之后,用TBST清洗,然后在室温下进行二抗孵育2 h。通过化学发光检测系统测量蛋白质水平。内参蛋白为GAPDH。
1.9 细胞活力检测
采用MTT法测定转染后48 h的细胞增殖水平,每个孔用含有100 μL新鲜0.5 g/L MTT的无血清培养基代替转染培养基。在37 ˚C孵育4 h后,吸除MTT培养基,并在每孔中加入50 μL DMSO。然后在37 ℃ 孵育10 min,用微板光度计测量455 nm处的吸光度。所有实验重复3次。
1.10 细胞迁移和侵袭检测
对于侵袭和迁移测定,transwell室分别用或不用基质胶(BD Biosciences,美国)进行预处理。当底部小室含有含FBS的DMEM培养基时,顶部小室含有无血清培养基。37 ˚C培养48 h后,用棉签清除留在上表面的细胞。同时,将黏附在底部表面的那些用4%的甲醛固定并用0.1%的结晶紫染色以使用显微镜(Olympus,日本)检测图像。
1.11 双荧光素酶报告基因检测
将含有miR-491 靶位点的扩增的TPX2 野生型或突变型3’UTR插入pMIR-GLO荧光素酶报告载体(Ambion,美国)。然后,根据制造商的方案,使用Lipofectamine™ 2000(Invitrogen,美国)将TPX2基因的宽型或突变型 3’UTR的miR-491模拟物和荧光素酶报告载体转染到MCF-7细胞中。双荧光素酶报告基因检测系统(Promega,美国)用于测量转染后48 h MCF-7的荧光素酶活性。
1.12 流式细胞术检测细胞凋亡
转染48 h后,收集转染组和对照组的PDAC细胞,洗涤并悬浮。根据生产商的说明,使用来自BD Biosciences(San Jose,美国)的PE/Annexin V细胞凋亡检测试剂盒检测PDAC细胞。用FACS Calibur流式细胞仪检测细胞凋亡,利用FACS Diva软件进行分析。每个实验重复三次。
1.13 裸鼠成瘤实验
shRNA-circ-MTHFD1L和pGPH1/GFP/Neo重组质粒用于转化大肠杆菌感受态细胞。大量扩增后,提取质粒。脂质体转染对数生长期人PDAC细胞PANC-1细胞制备1×107细胞/mL无血清细胞溶液,裸鼠左右皮下接种0.2 mL/鼠背部的一层,每组6只裸鼠。每3天用游标卡尺测量1次肿瘤体积。第25天后处死所有裸鼠并取出肿瘤组织用于体积和重量测量。
1.14 统计学分析
2 结果
2.1 circ-MTHFD1L在胰腺导管癌中表达及预后情况
利用GPL19978 平台对GSE79634 芯片进行分析,通过筛选在肿瘤样本中发现了10个显著上调和10个显著下调的circRNA,并且circ-MTHFD1L(hascirc-104227)是胰腺导管腺癌组织中表达差异最高的circRNA(图1A~B)。根据CircBase数据库注释,circ-MTHFD1L是从MTHFD1基因的chr6:151336015-151413723 剪接的,最终长度为661 nt(图1C)。利用反向引物在PANC-1细胞circ-MTHFD1L连接位点下游和上游扩增circ-MTHFD1L的cDNA约100 bp,Sanger的测序结果与CircBase数据相似。用RNase R处理后,细胞中circ-MTHFD1L的含量无明显改变,证明其环状结构属性(图1D)。进一步qRT-PCR结果(图1E~F)显示,PDAC组织中circ-MTHFD1L表达水平明显高于癌旁组织,且在PDAC细胞系中circ-MTHFD1L表达水平也较高,尤其是PANC-1 细胞。因此,本研究选择PANC-1 细胞系进行后续实验的细胞模型。此外,本研究通过分析TCGA数据库中Kaplan-Meier生存曲线发现,高表达cicr-MTHFD1L 的PDAC患者的生存率低于低表达cicr-MTHFD1L的患者(P<0.05,图1G)。

图1 circ-MTHFD1L在PDAC组织和细胞中表达情况
2.2 circ-MTHFD1L促进胰腺导管腺癌细胞的发生发展
为了探索circ-MTHFD1L在PDAC中的作用,本研究构建了pcDNA3.1-circ-MTHFD1L(p-MTHFD1L)和sh-circ-MTHFD1L(sh-MTHFD1L)载体以转染PANC-1细胞(图2A)。然后,通过qRT-PCR检测不同转染组中circ-MTHFD1L的表达水平,结果(图2B~C)显示,与sh-MTHFD1L组相比,p-MTHFD1L组中circ-MTHFD1L表达显著升高,在sh-MTHFD1L组中显著降低。MTT测定结果(图2D)表明circ-MTHFD1L促进了PDAC细胞的增殖,并且当敲除circ-MTHFD1L时,PDAC细胞的活力受到抑制。此外,流式细胞术细胞凋亡测定的结果(图2E)表明circ-MTHFD1L具有降低细胞凋亡率的能力,但当circ-MTHFD1L的表达被抑制时我们观察到相反的现象。如图2F所示,circ-MTHFD1L过表达的PDAC细胞具有很强的迁移和侵袭能力,而sh-MTHFD1L细胞则表现出相反的结果。综上所述,circ-MTHFD1L具有促进胰腺导管腺癌细胞发生发展的能力。
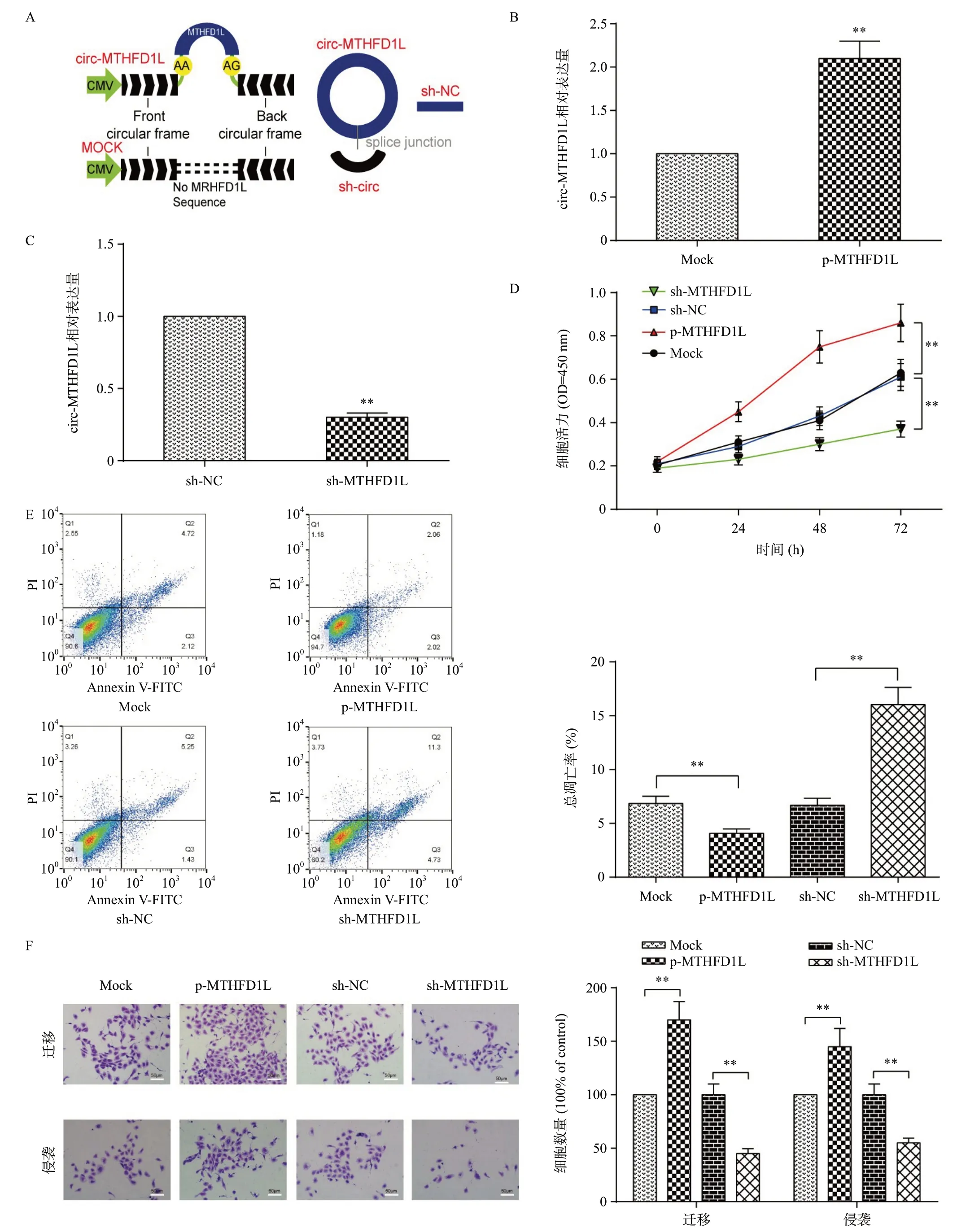
图2 circ-MTHFD1L在PDAC细胞中的作用情况
2.3 敲除circ-MTHFD1L抑制体内肿瘤生长
为了进一步探讨circ-MTHFD1L对体内裸鼠肿瘤发展速度的影响,将sh-MTHFD1L质粒载体转染的PANC-1 细胞和阴性对照(NC)通过皮下组织注射到裸鼠体内。经过连续25 天的观察,发现circ-MTHFD1L的敲低显著抑制了肿瘤生长(P<0.01,图3A~B)。在第25天处死所有裸鼠取出肿瘤,并测量肿瘤的重量,显示sh-MTHFD1L组的肿瘤重量与NC组相比较小(P<0.01,图3C)。此外,通过qRTPCR检测,sh-MTHFD1L组中circ-MTHFD1L的表达低于NC组(P<0.01,图3D)。

图3 circ-MTHFD1L对体内肿瘤生长的影响
2.4 circ-MTHFD1L与miR-217的靶向关系情况验证
本研究通过miRbase数据库预测发现miR-217可能是circ-MTHFD1L的靶基因(图4A)。为了验证 circ-MTHFD1L和miR-217之间的关系,采用双荧光素酶报告基因检测miR-217 对研究野生型和突变型circ-MTHFD1L的荧光素酶活性的影响。如图4B所示,miR-217显著抑制了circ-MTHFD1L-WT组的荧光素酶活性。qRT-PCR结果(图4C)显示miR-217的表达在circ-MTHFD1L过表达的PANC-1细胞中显著下调,但当circ-MTHFD1L被敲低时显著增加。然而,无论miR-217的表达水平如何,都不会影响circ-MTHFD1L的表达水平(图4D)。

图4 irc-MTHFD1L与miR-217的靶向关系验证
2.5 circ-MTHFD1L通过调控miR-217影响E2F3的表达
TargetScan 7.1数据库预测了miR-217和E2F3基因之间的两个潜在结合位点(图5A)。然后,通过双荧光素酶报告基因测定验证了PANC-1细胞中E2F3-3'UTR和miR-217 之间的靶向关系。结果表明miR-217模拟物能够显著抑制E2F3-WT1或E2F3-WT2的荧光素酶活性,但miR-217 模拟物和E2F3-MUT组在PANC-1 细胞中与NC组相比荧光素酶表达无明显差异(图5B~C)。使用蛋白质印迹研究敲低circ-MTHFD1L和上调miR-217表达后E2F3蛋白表达水平的变化。发现当miR-217 过表达时E2F3 蛋白表达降低,sh-circ-MTHFD1L也可以通过竞争性吸附miR-217下调E2F3蛋白(P<0.01,图5D)。

图5 circ-MTHFD1L和miR-217对E2F3表达的影响
2.6 miR-217通过抑制E2F3影响胰腺导管腺癌细胞的发育
用sh-E2F3 质粒载体和miR-217 抑制剂转染PANC-1细胞后,将PANC-1细胞系分为4个转染组:NC组、sh-E2F3组、miR-217抑制剂组和sh-E2F3+miR-217抑制剂组。CCK-8检测结果发现,sh-E2F3组PANC-1细胞增殖受抑制,而miR-217抑制剂组则促进(P<0.01,图6A)。流式细胞术检测结果显示E2F3的低表达促进了PANC-1细胞的凋亡,而miR-217抑制剂降低了PANC-1细胞的凋亡。此外,miR-217 抑制了E2F3 对PDAC细胞的影响并使PDAC细胞的凋亡恢复至正常水平(P<0.01,图6B-C)。Transwell迁移和侵袭实验结果显示E2F3低表达降低细胞迁移和侵袭,但miR-217抑制剂与NC组相比增加迁移和侵袭细胞数,miR-217逆转E2F3对细胞迁移和侵袭的影响(P<0.01,图6D)。

图6 miR-217通过抑制E2F3调控肿瘤进程
3 讨论
本研究探讨circ-MTHFD1L、miR-217 和E2F3在PDAC中的作用及其相互作用。通过Arraystar Human circRNAs基因芯片分析并筛选出在肿瘤组织和癌旁组织差异表达的circ-MTHFD1L。此外,PDAC组织和癌旁组织的qRT-PCR检测结果显示,与癌旁组织相比,PDAC组织中circ-MTHFD1L的表达显著升高。此外,TCGA数据库的数据显示高表达circ-MTHFD1L与不良预后存在相关且差异具有统计学意义(P<0.05)。进一步结果表明,敲低circ-MTHFD1L可以有效减少细胞增殖、迁移和侵袭并促进细胞凋亡。同时,当circ-MTHFD1L表达低时,体内肿瘤生长率会受到抑制。最后,采用双荧光素酶报告基因检测和蛋白质印迹分析来探索circ-MTHFD1L、miR-217和E2F3之间的关系。以上结果证实了我们之前的假设,即circ-MTHFD1L可以通过抑制miR-217的表达来调节E2F3以控制PDAC的发展。
由于细胞类型特异性的特点,circRNA在包括癌症、神经系统疾病、心血管等疾病在内的多种疾病中发挥重要作用[5]。然而目前关于circ-MTHFD1L的研究还很少,但以往关于其母基因MTHFD1L的许多研究结果都得出了与本研究相似的结论。在食管鳞状细胞癌中,MTHFD1L在影响食管鳞状细胞癌细胞进展的叶酸循环中起关键作用[15]。另有研究显示MTHFD1L在肝细胞癌中具有相同的机制,即MTHFD1L的敲低可以通过影响叶酸途径阻碍肝细胞癌细胞增殖[16]。此外,circRNAs作为近年来的研究热点。目前有研究揭示了在PDAC中表达不同的七种环状RNA,这意味着各种环状RNA与PDAC之间可能存在关系[17]。此外,hsa-circ-000977 经证实可在circRNA沉默时显著抑制PDAC进展,与circ-MTHFD1L显示出相同的功能[18]。
此外,之前的研究已经研究了E2F3 和其他miRNA之间的联系。有研究证实miR-152影响E2F3以调节C2C12成肌细胞的分化和增殖[18]。另有研究表明miR-203可以通过调节E2F3抑制胶质瘤细胞侵袭。在人肝细胞癌中,miR-214 可以通过靶向E2F3抑制肝细胞癌的细胞增殖[19]。而miR-217是一种在各种细胞进程中的关键基因,其功能已被研究miR-217具有激活Wnt信号通路来促进肝细胞癌干细胞特性的能力[20]。另有研究显示miR-217 作为一种癌症抑制剂,可以通过抑制AEG-1和PD-L1的表达来抑制喉癌细胞转移[21]。然而,miR-217和E2F3在PDAC中的作用仍不清楚[20]。例如,E2F3 为什么会影响PDAC及其下游目标是什么并未深入探讨。这些问题都需要在以后的研究中进一步探讨。
——一道江苏高考题的奥秘解读和拓展

