环巴胺对良性前列腺增生大鼠Hedgehog通路相关因子的影响*
朱文雄,袁轶峰△,张 熙,刘 涛,李 博,陈其华
(1.湖南中医药大学第一附属医院男科,湖南长沙 410007;2.湖南省第二人民医院,湖南长沙 410007)
良性前列腺增生(benign prostatic hyperplasia,BPH)是指1组由前列腺细胞增生为实质改变而引起的症候群。BPH为引起中老年男性排尿障碍原因中最为常见的1种良性疾病[1]。其病理学特点为前列腺上皮与间质细胞的过度增生,前列腺体积增大,当引起临床症状时则称为临床BPH。据1组国外尸解资料报告显示,80.1% 40岁以上男性,90.5% 80岁以上男性有组织学BPH。关于临床BPH的发病率,国内有报告称60~69岁的男性有中到重度症状者达到了60%[2]。BPH的主要临床表现为尿频、尿急、排尿踌躇、排尿费力、尿线变低、尿流无力、尿末滴沥、排尿时间延长,严重时出现尿潴留及急迫性或充溢性尿失禁等。此外,还可继发血尿、泌尿系感染、膀胱结石及上尿路积水和肾功能损害等严重合并症。因此,寻找1种对BPH行之有效的药物对维护中老年患者的健康及提高其生活质量具有重要意义。新近研究发现Hedgehog通路在胚胎发育、干细胞自稳态、细胞分化、组织极化和细胞增殖等过程起着非常重要的调控作用,众多增生性疾病、肿瘤发生都与该通路的异常密切相关。环巴胺是1种强大的Hedgehog通路阻断剂,该化合物在前列腺癌治疗中的地位越来越高,但其对BPH的干预作用尚不明确[3]。本研究旨在探究环巴胺对BPH大鼠Hedgehog通路相关因子的影响。
1 材料与方法
1.1 动物
成年雄性SD大鼠,体重400~450 g,购自湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2019-0006。
1.2 主要试剂与仪器
环巴胺购自以色列Fermentek公司。丙酸睾酮购自襄阳华中药业股份有限公司。二甲苯购自上海明投工贸有限公司。苏木素购自上海盈公试剂有限公司。胎牛血清(FBS)购自上海依科赛生物制品有限公司。3,3-二氨基联苯胺购自北京博奥森生物技术有限公司。碘化丙啶(PI)购自美国Sigma公司。链霉素抗生物素蛋白-过氧化物酶溶液购自北京中山生物技术有限公司。细胞裂解液购自上海远慕生物科技有限公司。ECL超敏发光液购自美国Biomiga公司。Annexin-V-FITC细胞凋亡检测试剂盒购自美国Biovision公司。TaqMan MicroRNA Assays Reverse Transcription Primer购自美国Applied Biosystems公司。BCA试剂盒购自上海翊圣生物科技有限公司。Ki67单克隆抗体购自南京巴傲得生物科技有限公司。多克隆抗体Shh、Gli1、Ptc1、b-FGF、TGF-β、Bax、Bcl-2、GAPDH,小鼠抗羊IgG二抗购自美国Abcam公司。光学显微镜购自深圳博视达光学仪器有限公司。流式细胞仪CytoFLEX购自美国Beckman Coulter公司。
1.3 BPH大鼠模型的构建[4]
先按剂量40 mg/kg腹腔注射2%戊巴比妥钠的方式进行麻醉,对大鼠皮肤进行消毒,在无菌环境下经阴囊摘除双侧睾丸。术后大鼠恢复7 d,于第8天选取已去势且状态恢复较好的模型大鼠,每天按剂量4 mg/kg皮下注射丙酸睾酮(将丙酸睾酮溶于植物油中),持续30 d。造模成功的评价标准:穿刺获取前列腺组织,光镜下可见整个前列腺腺腔充满增生的腺上皮细胞,腺上皮细胞及间质组织出现了不同程度的增生。
1.4 分组、给药与标本获取
将造模成功的30只BPH大鼠随机分为模型组(BPH组)和环巴胺组,未造模的15只大鼠作为正常对照组(Normal组)。环巴胺组大鼠按剂量50 mL/kg腹腔注射10 μmol/L环巴胺,1次/天,连续7 d;Normal组和BPH组大鼠腹腔注射等剂量生理盐水,1次/天,连续7 d。给药结束后,CO2处死大鼠,获得各组大鼠前列腺组织,对每组大鼠进行以下指标的测定。用分析天平测前列腺组织湿重,用容积法测各组大鼠前列腺体积,计算前列腺指数(PI),PI =前列腺湿重/体积。所有动物实验均经过相关伦理委员会的批准。
1.5 前列腺细胞的提取、培养
取大鼠的前列腺组织,前列腺每叶各取部分,D-Hanks液清洗2次后剪碎,去除肉眼可见的大血管组织,用2%胰蛋白酶室温消化前列腺各叶30 min,离心后用0.06% Ⅱ型胶原酶室温消化15 min,过滤,取滤液加细胞培养液混匀,接种于包被有纤维连接蛋白的培养瓶内,置于5% CO2、37 ℃培养箱内培养。每48~72 小时换液1次。培养液为细胞培养液,加入10%胎牛血清,添加体积比为1∶100的胰岛素-转铁蛋白-硒添加物、0.5 μg/L β-内皮细胞生长因子(ECGF)、1×105U/L青霉素和链霉素双抗。取前列腺移动带组织按上述方法处理,提取培养前列腺间质细胞。
1.6 免疫组织化学法检测各组大鼠前列腺组织中增殖因子Ki67蛋白表达阳性率
取甲醛固定标本,石蜡包埋,连续4 μm厚切片。将组织切片放入60 ℃温箱烘1 h,常规二甲苯脱蜡,梯度乙醇脱水,将切片放入3% H2O2中10 min,蒸馏水洗涤切片,每次3 min,共3次。高压抗原修复90 s,凉水中冷却到室温,用PBS洗涤切片,每次3 min,共3次。滴加5% 牛血清清蛋白(BSA),37 ℃孵育30 min。取出切片,将其擦干,滴加Ki67单克隆抗体(1∶200),4 ℃下孵育过夜。之后取出切片,PBS洗涤切片,每次3 min,共3次。滴加含有生物素标记的小鼠抗羊IgG二抗(1∶1 000)工作液,37 ℃孵育30 min。取出切片,PBS洗涤切片,每次3 min,共3次。滴加链霉素抗生物素蛋白-过氧化物酶溶液,37 ℃孵育30 min。取出切片,PBS洗涤切片,每次5 min,共3次。3,3-二氨基联苯胺(DAB)室温显色。在镜下控制反应时间,使用自来水冲洗中止反应。当所有切片均显色后,将其摆放在切片架上,在蒸馏水中浸泡5 min。切片架浸入苏木素染色5 min后,在自来水下冲洗。取出切片架,1%盐酸乙醇中浸洗4 s,自来水返蓝20 min。PBS代替一抗作为阴性对照,已知的阳性切片作为阳性对照。染色分为阳性和阴性2种结果,以细胞质及细胞核内出现棕黄色颗粒状着色判断为阳性,以细胞质及细胞核内无棕黄色颗粒状着色判断为阴性。光学显微镜下观察并摄片:每张切片选取5个高倍镜视野(200×),每个视野数100个细胞,阳性细胞占比小于10%为阴性,阳性细胞占比在10%~<50%为阳性,阳性细胞占比大于50%为强阳性。
1.7 流式细胞术分析细胞周期和细胞凋亡率
收集细胞,用0.25 %胰蛋白酶溶液消化,调整细胞数为1×106/mL,取1 mL细胞液1 500 r/min离心10 min,弃上清液,收集细胞,加PBS 2 mL,再离心,弃上清液后,用预冷的70%乙醇溶液固定细胞,4 ℃过夜。第2天将之前固定好的细胞用PBS洗涤2次,吸取细胞悬液100 μL (细胞不少于1×106/mL),加入50 mg/L的PI染液(含RNAase) 1 mL,避光孵育30 min后,100目尼龙网过滤,流式细胞仪记录激发波长在488 nm处红色荧光检测细胞周期。Annexin V-FITC/PI双标染色检测细胞凋亡,细胞处理方法与细胞周期检测方法相同。置于37 ℃、5% CO2培养箱中培养48 h,收集细胞,用PBS洗涤2次后离心将细胞重悬于200 μL结合缓冲液中,按照Annexin-V-FITC细胞凋亡检测试剂盒的说明,按1∶2∶60比例将Annexin-V-FITC、PI、HEPES缓存液配成Annexin-V-FITC/PI染液。加入5 μL Annexin V-FITC和10 μL PI轻轻混匀,避光室温反应15 min,加入300 μL HEPES,用流式细胞仪在激发波长488 nm处检测HEPES细胞凋亡情况。实验重复3次。
1.8 实时荧光定量PCR(RT-qPCR)检测Hedgehog通路相关因子的表达水平
TRIzol法提取各组大鼠前列腺细胞总RNA,测定总RNA的浓度和纯度。按照TaqMan MicroRNA Assays Reverse Transcription Primer说明书进行反转录,反应体系20 μL,将RNA模板、Primer Mix、dNTP Mix、DTT、RT Buffer、HiFi-MMLV和无RNA酶水置于冰上溶解备用。设定反应条件为:42 ℃ 30~50 min (反转录反应),85 ℃ 5 s (反转录酶失活反应)。上述反应获得的cDNA中加入65 μL DEPC水稀释,并充分混匀,按照以下组分配制PCR反应体系:5 μL SsoFast EvaGreen Supermix (2×),0.5 μL 正向引物 (10 μmol/L),0.5 μL 反向引物 (10 μmol/L),4.0 μL cDNA。Shh、Ptc1、Gli1、成纤维因子(b-FGF)、转化生长因子(TGF-β)、Bcl-2、Bax和GAPDH (GAPDH作为内参) PCR扩增条件:95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 30 s;30个循环。各基因引物由华大基因有限公司合成,序列见表1。实验重复3次。

表1 RT-qPCR引物序列
1.9 蛋白免疫印迹法(Western blot)检测Hedgehog通路相关蛋白的表达水平
取冻存于-80 ℃的前列腺组织80 mg (3组) 置于玻璃研磨器中加入1 mL RIPA裂解液[裂解液组成:50 mmol/L 三羟甲基氨基甲烷(Tris)、150 mmol/L 氯化钠(NaCl)、5 mmol/L 乙二胺四乙酸(EDTA)、0.1%十二烷基硫酸钠(SDS)、1%乙基苯基聚乙二醇(NP-40)、5 μg/mL 抗蛋白酶肽(Aprotinin)、2 mmol/L 苯甲基磺酰氟(PMSF)],置冰浴上研磨成匀浆;12 000 r/min 4 ℃低温离心20 min,弃除脂层,取上清液采用BCA试剂盒测定每个样品的蛋白浓度,样品与加入上样缓冲液混合,100 ℃煮沸5 min,冰浴、离心后用微量加样器各泳道加入30 μg蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,再将凝胶上的蛋白转移至硝酸纤维素膜上。5%脱脂奶粉4 ℃封闭硝酸纤维素膜过夜。加入稀释的一抗多克隆抗体Shh、Gli1、Ptc1、b-FGF、TGF-β、Bax、Bcl-2、 GAPDH(1∶1 000、1∶1 500、1∶1 500、1∶200、1∶2 000、1∶2 000、1∶500、1∶2 500) 4 ℃孵育过夜;次日室温下TBST洗膜3次,每次5 min,加二抗单克隆抗体IgG (1∶200)孵育1 h,TBST洗膜3次,每次5 min,添加ECL在暗室中显影、定影。使用凝胶分析软件BandScan 5.0对内参条带和目的条带进行灰度值检测。细胞蛋白收集步骤:转染48 h后收集细胞加入100 μL RIPA裂解液,冰浴30 min,12 000 r/min 4 ℃低温离心20 min收集上清液,后续蛋白定量与电泳实验步骤同上。实验重复3次。
1.10统计学处理
2 结 果
2.1 免疫组织化学法测Ki67蛋白表达情况
免疫组织化学结果显示,与Normal组比较,BPH组和环巴胺组Ki-67蛋白表达水平明显上升,差异有统计学意义(P<0.05);与BPH组比较,环巴胺组Ki-67蛋白表达水平明显下降,差异有统计学意义(P<0.05)。见图1。
2.2 流式细胞术检测细胞周期与凋亡情况
PI单染色法结果:与Normal组比较,BPH组和环巴胺组G0/G1期细胞比例明显减少,S期细胞比例明显增多,差异有统计学意义(P<0.05);与BPH组比较,环巴胺组G0/G1期细胞比例明显增多,S期细胞比例明显减少,差异有统计学意义(P<0.05)。Annexin V-FITC/PI双标染色法检测结果所示:与Normal组比较,BPH组和环巴胺组细胞凋亡率均有明显下降,差异有统计学意义(P<0.05);与BPH组比较,环巴胺组细胞凋亡率明显上升,差异有统计学意义(P<0.05)。见图2。

A:Ki67蛋白免疫组织化学染色(×400);B:免疫组织化学定量分析;a:P<0.05,与Normal组比较;b:P<0.05,与BPH组比较。

A:细胞周期图;B:细胞周期分析图;C:细胞凋亡图;D:细胞凋亡分析图;a:P<0.05,与Normal组比较;b:P<0.05,与BPH组比较。
2.3 各组大鼠Shh、Ptc1、Gli1、b-FGF、TGF-β、Bax、Bcl-2 mRNA的表达水平
RT-qPCR检测显示,与Normal组比较,BPH组和环巴胺组Shh、Ptc1、Gli1、TGF-β、b-FGF、Bcl-2 mRNA表达水平明显上升,Bax mRNA表达水平明显下降,差异有统计学意义(均P<0.05);与BPH组比较,环巴胺组Shh、Ptc1、Gli1、TGF-β、b-FGF、Bcl-2 mRNA表达水平明显下降,Bax mRNA表达水平明显上升,差异有统计学意义(均P<0.05)。见图3。
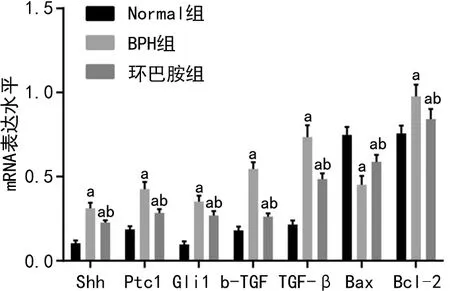
a:P<0.05,与Normal组比较;b:P<0.05,与BPH组比较。
2.4 各组大鼠Shh、Ptc1、Gli1、b-FGF、TGF-β、Bax、Bcl-2蛋白的表达水平
Western blot结果显示,与Normal组比较,BPH组和环巴胺组信号通路因子Shh、Ptc1、Gli1、TGF-β、b-FGF、Bcl-2蛋白表达水平明显上升,Bax蛋白表达水平明显下降,差异有统计学意义(均P<0.05);与BPH组比较,环巴胺组信号通路因子Shh、Ptc1、Gli1、TGF-β、b-FGF、Bcl-2蛋白表达水平明显下降,Bax蛋白表达水平明显上升,差异有统计学意义(均P<0.05)。见图4。
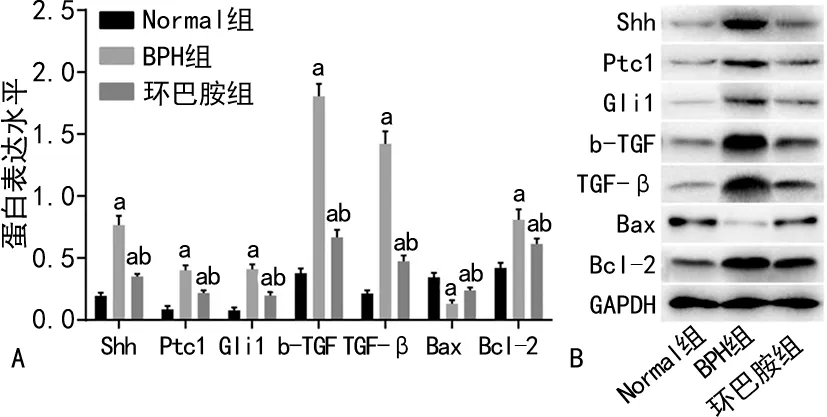
A:Western blot分析图;B:Western blot图;a:P<0.05,与Normal组比较;b:P<0.05,与BPH组比较。
3 结 论
BPH是前列腺上皮与间质细胞的过度增殖性疾病,其发生的具体机制尚不明确,随着人类研究的不断深入,生长因子与细胞凋亡这两大方面越来越得到大家的关注,BPH很可能就是由于上皮和间质细胞的增殖和细胞凋亡的平衡遭到破坏所引起[5]。故以调控细胞增殖与凋亡为干预靶点或可为防治BPH提供新的治疗途径。近年来,研究发现分泌蛋白Hedgehog家族成员在脊椎动物和非脊椎动物的发育中起着至关重要的调控作用,包括细胞增殖、分化和组织的形成等[6]。如果Hedgehog通路失调,会引起多种增生性疾病、先天畸形、恶性肿瘤、肥胖症等。脊椎动物体内发现了3种Hedgehog家族的成员:Shh、Dhh和Ihh,其中Shh信号通路的作用最广泛,对人类而言最为主要[7]。很多研究发现,Shh及其信号传导系统中的分子在增生前列腺组织中呈高表达[8]。在前列腺细胞的生长中,Hedgehog通路已经被证明是正调节剂和增殖刺激物。
Hedgehog信号通路由分泌型糖蛋白(Hh)配体、2种主要的膜蛋白受体,即Ptc(patched)和Smo(smoothened)、核转录因子Gli(Glioma)和下游靶基因4部分组成,通过1条复杂的信号转导级联反应来执行它的生物学功能[9-10]。在脊椎动物的Shh、Dhh和Ihh 3个同源基因可以编码类似的分泌蛋白即Hh配体,其本身并不具有活性,但可以通过自身催化加工的能力经修饰后产生生物学活性。Hh配体活化后,原本与Smo结合以抑制Smo活性的Ptc与Hh配体结合,Ptc-Smo复合物解离,Smo进入细胞内。Ptc是1种12次跨膜蛋白,有2个细胞外结合域和1个细胞内结合域,其可分为Ptc1和Ptc2 2个亚型。环巴胺可以与Ptc竞争性地结合Smo,从而抑制Smo的活性。Smo蛋白是具有7个疏水跨膜区的信号转导蛋白,激活的Smo可以将信号向下传导,激活Hedgeho信号通路的核心部位——含锌指结构的核转录因子,即Gli,包括Gli1、Gli2和Gli3,随后Gli进入细胞核并启动下游目标基因的表达。在没有Hh配体参与的情况下,Ptc与Smo结合并抑制Smo的活性,核转录因子Gli家族的Gli2、Gli3处于无活性的GliR复合体形式,而Gli1的活性形式Gli1A则被Sufu蛋白所抑制,需要经过磷酸化后表现出相应的生物学活性[11-14]。在Hedgehog信号通路中,Hh配体、Smo、Gli作为激动因子发挥正调节作用,而Ptc作为抑制因子发挥负调节作用。在激活转录因子Gli基因家族后,Hh可以调控VEGF、c-myc、Wnt、TGF-β、Bcl-2、Bcl-x等靶基因的表达,维持胚胎的发育、促进自我更新、血管生成、细胞增殖等多种生物学功能[15-17]。
研究结果显示,环巴胺能够降低BPH大鼠Ki67蛋白阳性表达率。Ki67蛋白已被作为诊断和评估正常前列腺组织、前列腺上皮内瘤样病变和前列腺肿瘤患者中细胞增殖活性的有用和有效工具[18]。其与细胞周期的增殖相关,其过度表达可能牵涉前列腺细胞数量的增加。环巴胺可以降低Ki67蛋白的表达。环巴胺能够抑制细胞增殖,使细胞阻滞在G0/G1期,并能促进前列腺上皮细胞的凋亡,从而减少上皮细胞的数目。本研究发现,与Normal组大鼠比较,BPH模型大鼠Shh,Ptc1,Gli1,b-FGF,TGF-β和Bcl-2的mRNA及蛋白表达水平明显增加,而Bax的mRNA及蛋白表达水平明显下降,表明了激活的Hedgehog通路可使细胞增殖增加和细胞凋亡减少。这与环巴胺的治疗使Hedgehog通路的激活被抑制,细胞增殖受抑制且细胞凋亡增强的结论一致。Shh、Ptc1、Gli1是Hedgehog通路中的3个关键成员,其表达对BPH的发展产生重要影响。成纤维因子b-FGF和TGF-β可诱导和促进BPH的上皮细胞增殖。Bcl-2和Bax均属于Bcl-2家族,前者是抗凋亡成员,后者是促凋亡成员。环巴胺可以有效阻断Hedgehog通路,下调b-FGF、TGF-β和Bcl-2的表达,增加Bax的表达,导致前列腺细胞增殖减少,细胞凋亡增加,BPH进展受到抑制。
总之,本研究提供的证据表明环巴胺通过阻断Hedgehog通路,减少前列腺细胞和增殖并促进前列腺细胞凋亡,从而能够有效抑制BPH的进展。未来可以进一步研究环巴胺阻断Hedgehog通路干预BPH进展的具体机制,并探讨其治疗BPH的临床价值。

