禽源空肠弯曲杆菌耐药性与致病性研究
王 娟,黄秀梅,张青青,刘俊辉,王 琳,刘 娜,王君玮,曲志娜
(中国动物卫生与流行病学中心,山东青岛 266032)
空肠弯曲杆菌是一种人兽共患病病原体,是在全球范围内引起人类腹泻的主要细菌性病原菌之一[1]。该菌可定殖在多种动物肠道内,正常情况下不引起动物发病,但可通过粪便对周围环境和水源造成污染。空肠弯曲杆菌肠炎的发病率在发达国家超过细菌性痢疾,在发展中国家几乎与细菌性痢疾相近,在我国该菌也是主要腹泻病原菌之一[2]。家禽是空肠弯曲杆菌群的主要携带者,是弯曲杆菌病的主要感染来源,所以加强禽源空肠弯曲杆菌监测是控制空肠弯曲杆菌流行的前提,对公共卫生具有重要意义。为了解空肠弯曲杆菌通过家禽传播给消费者的风险,本研究分析了肉鸡养殖和屠宰环节空肠弯曲杆菌的毒力基因携带、致病性及耐药情况,以期为我国动物产品安全和公共卫生监管以及空肠弯曲杆菌病防控研究提供依据。
1 材料与方法
1.1 材料
1.1.1 标准菌株 空肠弯曲杆菌(ATCC 33560),购自中国微生物菌种保藏中心。
1.1.2 主要试剂 空肠弯曲杆菌选择性琼脂基础(Skirrow)以及配套添加剂,购自Sigma 公司;哥伦比亚血琼脂基础培养基,购自英国OXOID 公司;Bolton 肉汤干粉、绵羊全血,购自青岛海博生物科技公司;微需氧产气袋,购自日本三菱MGC公司;DNA Marker、TaKaRa LATaq®酶,购自宝生物工程(大连)有限公司;2×PCR Master Mix,购自Promega 公司;抗菌药物药敏板,购自上海星佰生物有限公司。
1.1.3 试验动物 204 只ICR 小鼠,购自济南朋悦实验动物繁育有限公司。
1.1.4 主要仪器设备 生物安全柜、恒温培养箱,为美国NUAIRE 公司产品;电热恒温水浴锅,购自北京长风仪器仪表公司;PCR 仪、凝胶成像系统,购自Bio-Rad 公司。
1.2 样品采集
1.2.1 泄殖腔拭子样品 采集山东省胶东地区某养殖场肉鸡泄殖腔拭子300 份。
1.2.2 肉鸡胴体表面拭子样品 采集山东省胶东地区某肉鸡屠宰线胴体表面拭子300 份。
1.3 细菌分离与鉴定
1.3.1 细菌分离与纯化 将采集的样品拭子放入Bolton 肉汤,在微需氧条件下尽快运至实验室;42 ℃微需氧培养48 h,将增菌液转接种至Skirrow培养基,42 ℃微需氧继续培养48 h;观察菌落形态,选择透明、扁平、湿润的菌落,接种于哥伦比亚血平板进行纯化培养。
1.3.2 初步鉴定 革兰氏染色、镜检以及氧化酶试验和生长试验,均按照GB/T 4789.9—2016 进行。
1.3.3 PCR 鉴定 将纯化的弯曲杆菌菌落采用煮沸法提取模板后,应用建立的PCR 方法[3]对其进行鉴定。引物(JunF:5'-CATCTTCCCTAGTCAAGCCT-3';JunR:5'-AAGATATGGCACTAGCAAGAC-3')由青岛睿博兴科生物技术有限公司合成,扩增片段长度为773 bp。反应体系25.0 μL:2×PCR Master Mix 12.5 μL,模板DNA 2.0 μL,上下游引物各0.5 μL,去离子水9.5 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸4 min,35 个循环;72 ℃延伸10 min。反应完成后,将扩增产物进行琼脂糖凝胶电泳。
1.4 耐药性检测
按照美国临床和实验室标准协会(CLSI)2019 推荐的微量肉汤稀释法测定分离菌株对8 种抗菌药物的MIC 值。8 种抗菌药分别为阿奇霉素、环丙沙星、红霉素、庆大霉素、四环素、萘啶酸、泰利霉素、克林霉素。
1.5 毒力基因检测
毒力基因是空肠弯曲杆菌的主要致病因素。在整个致病过程中,多种毒力基因参与其中,相互协调,发挥作用。cheY、cheW等基因与趋化有关,flaA、cadF、peb1A、racR等基因与粘附定殖有关,ciaB、pldA等基因与侵袭有关,还可产生细胞致死性膨胀毒素、细胞紧张性毒素等外毒素和内毒素[4]。依据参考文献[5-6]设计16 对与上述致病机制有关的基因引物(表1),用PCR 方法对空肠弯曲杆菌分离株进行毒力基因检测。
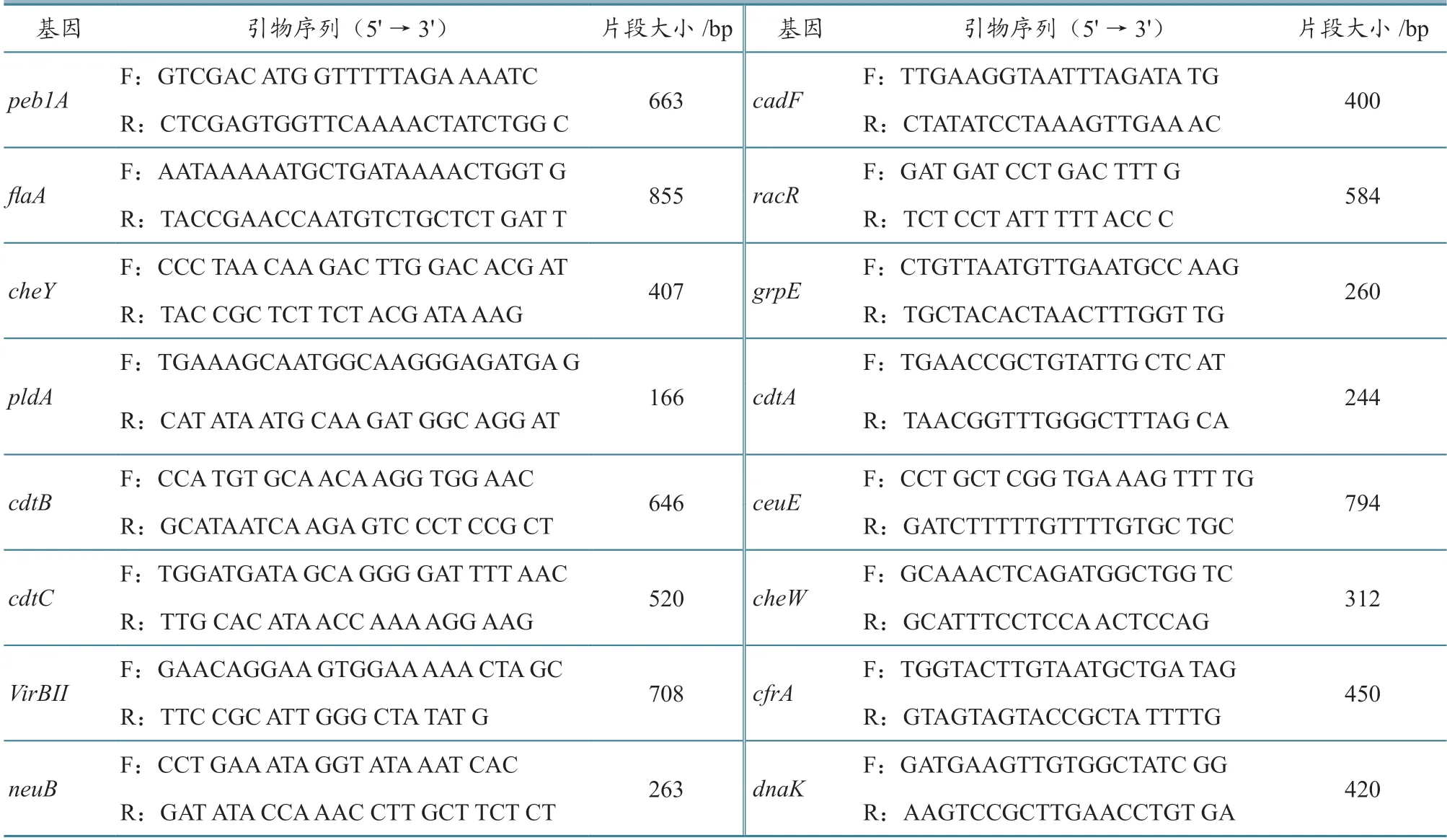
表1 毒力基因PCR 引物序列及扩增片段大小
1.6 动物试验
将分离菌株接种至哥伦比亚血平板,收集平板上的菌苔置于灭菌生理盐水中,振荡混匀,用平板计数法调整菌悬液活菌数为2×1010CFU/mL;选择携带不同组合毒力基因的代表性菌株50 株(携带15 种、11 种毒力基因菌株各4 株,携带14 种、13 种、12 种毒力基因菌株各14 株),同时将204只ICR 小鼠随机均分成51 组(50 个试验组及1 个阴性对照组),试验组小鼠每组接种一株菌,接种菌液量为0.2 mL/只,阴性对照组小鼠注射生理盐水(0.2 mL/只);接种后每12 h 观察1 次,连续观察7 d,记录病理变化;试验期间采集小鼠粪便,进行病原菌分离、鉴定;将发病小鼠解剖后对肝脏和脾脏进行病原菌分离。
2 结果
2.1 细菌分离、纯化与鉴定
经过细菌分离纯化,从采集样品中共分离到241 株细菌,其中有162 株来自肉鸡养殖场,79 株来自肉鸡屠宰线,分离率为40.17%(241/600)。分离菌在哥伦比亚血平板培养后为灰色、扁平、湿润有光泽的成片菌苔或单个菌落(图1);革兰氏染色及镜检结果显示,分离菌为革兰氏阴性,呈弯曲小逗点状或S 形、螺旋状、海鸥展翅状(图2);氧化酶试验为紫红色、紫罗兰或深蓝色;生长试验显示,无菌生长的菌落为弯曲杆菌。
对初步鉴定为弯曲杆菌的分离菌株进行PCR扩增,将大小约为773 bp 的扩增产物(图3)送青岛睿博兴科生物技术有限公司测序。所得序列NCBI(https://blast.ncbi.nlm.nih.gov/)比对结果显示,其与空肠弯曲杆菌匹配度达99.5%以上,说明扩增基因片段为空肠弯曲杆菌16S rRNA 基因的保守区序列。
2.2 药敏试验
药敏试验结果(图4)显示,241 株分离菌株对8 种抗菌药物均有不同程度耐药,对环丙沙星、萘啶酸、四环素的耐药性尤为严重,耐药率分别为97.75%、96.78%、95.18%。其中养殖环节分离菌株对环丙沙星、四环素的耐药率高达100%,对萘啶酸的耐药率为98.67%;屠宰环节分离菌株对环丙沙星、萘啶酸、四环素的耐药率分别为93.33%、93.33%、84.44%。屠宰环节分离菌株对阿奇霉素、红霉素、泰利霉素、克林霉素等4 种药物的耐药率在5.00%以下,养殖环节分离菌株对大环内酯类药物(阿奇霉素、红霉素、泰利霉素)的耐药率较屠宰环节分离菌株高约35.00%。
2.3 毒力基因检测
如表2 和图5 所示,除未检测到VirBII基因,以及neuB基因携带率较低外,其他14 种毒力基因携带率均较高,有11 种达到90%以上。针对所检测的16 种毒力基因,241 株空肠弯曲杆菌分离株中有4 株含有15 种毒力基因,占总分离数的1.66%;75 株含有14 种毒力基因,占总数的31.12%;85 株含有13 种毒力基因,占总数的35.27%;71 株含有12 种毒力基因,占总数的29.46%;4 株含有11 种毒力基因,占总数的1.66%;只有2 株含有5 种毒力基因。不同毒力基因PCR 产物电泳结果见图6。

表2 分离菌株携带毒力基因情况
2.4 动物试验
选择携带不同组合毒力基因的代表性菌株50株,对试验组小鼠腹腔注射2×1010CFU/mL 的菌悬液0.2 mL。结果显示:4×109CFU 的菌量只引发个别小鼠死亡,说明该菌致死性不强;有22 株菌腹腔注射后导致试验小鼠出现明显症状,包括全身炸毛、饮欲食欲下降、扎堆、嗜睡等,腹泻现象不明显,有的小鼠排出软便。采集试验小鼠的粪便样品直接划板,结果从14 组有症状的小鼠粪便中分离到该菌,而没有明显症状的小鼠则未分离到该菌,说明特定菌株能在肠道内定殖,导致在肠道内长期带菌和排菌。对病死小鼠剖检发现,其肝脏表面和实质散布有灰白色坏死点或出血点,有的小鼠还表现盲肠鼓气(图7)。接种携带毒力基因种类多的菌株的小鼠发病率较高,说明毒力基因与细菌致病力有一定联系。
3 讨论
近年来,弯曲杆菌病的高发及其耐药性的显著增强已引起各国研究人员广泛关注。本试验利用PCR 方法对养殖环节和屠宰环节肉鸡中的空肠弯曲杆菌进行了鉴定,阳性率为40.17%,与周倩等[7-8]的报道相符合。采用微量肉汤稀释法对获得菌株进行耐药试验发现,获得菌株对环丙沙星、四环素、萘啶酸的耐药性非常严重,耐药率均在90%以上,这与韩新锋等[9-10]的报道相符合;屠宰环节获得菌株对阿奇霉素、红霉素、泰利霉素的耐药情况好于养殖环节。氟喹诺酮类和大环内酯类药物是治疗弯曲杆菌感染的最常用药物[11],耐药菌株或者耐药因子沿着生产链和食物链进入消费者体内的概率较大,应引起高度重视。
241 株鸡源空肠弯曲杆菌毒力基因携带率较高,99%分离菌株所携带毒力基因数都超过10 种,表明毒力基因广泛存在于空肠弯曲杆菌中[12],而与菌株的分布关系不大。进一步对养殖环节和屠宰环节分离菌株的毒力基因携带情况比较发现,neuB1、cfrA、cdtA和grpE4 种毒力基因携带情况存在差异,其他毒力基因差异不明显。养殖环节分离株毒力基因携带率较高,推测这可能与鸡的生长阶段有关;此外,本试验菌株均未携带VirBII基因,低于刘珮琪等[13]报道的数据,说明该毒力基因可能与区域分布有一定关系。
空肠弯曲杆菌有较多的毒力基因携带情况,但是对宿主(本试验中的肉鸡)并不致病,可能因为该菌对动物的致病性由多种因素引起,可见空肠弯曲杆菌毒力基因在对动物致病过程中的作用还需进一步研究和探讨。该菌毒力基因分布的相似性提示,无论从何种环境和宿主分离的空肠弯曲杆菌,都具有引起空肠弯曲杆菌病的潜在危害,若消费者接触被该菌污染而未经加工的食品,很容易造成感染,故应加强动物产品各生产环节质量安全控制,保证动物源食品安全;同时,加强空肠弯曲杆菌及其毒力基因检测对空肠弯曲杆菌病防控具有重要意义。动物试验结果表明,从健康动物分离到的空肠弯曲杆菌具有一定致病性,但致病性力不强,提示可能还有其他因素导致该菌具有致病性,需加强监测并进一步探索。

