牛布鲁氏菌A19 号疫苗免疫血清几种检测方法的比较
吴小梅,李建玲,王 涛,蔡扩军,朱冠林,杨 镇,马小娟,高 敏,陈利苹,钟 旗,李爱巧
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.乌鲁木齐市动物疾病控制与诊断中心,新疆乌鲁木齐 830063;3.新疆农业大学科学技术学院,新疆乌鲁木齐 830091;4.深圳真瑞生物科技有限公司,广东深圳 518000;5.新疆畜牧科学院兽医研究所,新疆乌鲁木齐 830000)
布鲁氏菌病(以下简称布病)是由布鲁氏菌(Brucella)感染而导致的人兽共患病,主要通过病菌侵入机体的黏膜、呼吸道等导致,家畜感染后主要表现为雌性不孕、流产,以及雄性睾丸炎等。随着畜牧业发展,布病在许多国家和地区卷土重来[1]。近年来我国的畜间和人间布病病例数量逐年增多,不仅给畜牧业造成不可估量的经济损失,还严重危害人类健康、公共卫生安全。各级兽医主管部门和动物防疫机构采取了相应的家畜布病预防控制措施,以最终达到家畜布病净化的目标。
新疆是我国布病高发的一类地区。《国家布鲁氏菌病防治计划(2016—2020 年)》要求,一类地区污染严重的养殖场(户),经过报备后应实施布病免疫。关于牛布病免疫后的血清学检测方法,目前主要有虎红平板凝集试验(RBT)、试管凝集试验(SAT)、竞争酶联免疫吸附试验(cELISA)、荧光偏振试验(FPA)、间接酶联免疫吸附试验(iELISA)等。根据《动物布鲁氏菌病诊断技术》(GB/T 18646—2018)、《新疆维吾尔自治区2021 年动物疫病免疫工作实施方案》等规定,RBT、FPA 和iELISA 用于初筛,SAT 和 cELISA 用于确诊,进而再采集cELISA、SAT 均为阳性的牛阴道拭子或奶样进行分子生物学实时荧光 PCR 及环介导等温扩增技术(LAMP)检测,以确定血清学阳性牛是否仍为布鲁氏菌核酸阳性。而不同检测方法的优缺点各不相同,如尚德秋[2]研究发现,SAT 存在一定的假阳性和假阴性,而且布病免疫后很难区分检出的血清学阳性牛为感染阳性还是免疫阳性。本试验应用RBT、SAT、cELISA、iELISA 和 FPA 方法,对免疫布鲁氏菌A19 号疫苗18 个月后的牛血清进行布病抗体检测,对比这5 种血清学检测方法的敏感性、特异性、误诊率、漏诊率、符合率、Kappa 值,将LAMP 与PCR 方法比对,筛选简易、快捷、有效、科学的免疫动物布病核酸检测方法,科学区分疫苗免疫和自然感染,这将对布病防控具有重要意义。
1 材料与方法
1.1 材料
1.1.1 血清样本 新疆乌鲁木齐市送检的 1 721份免疫布鲁氏菌A19 号疫苗18 个月后的牛血清。
1.1.2 检测试剂 布病虎红平板凝集试验抗原(批号202017)、标准阳性血清(批号201501)、标准阴性血清(批号201403),布病试管凝集试验抗原(批号202003)、标准阳性血清(批号201501)、标准阴性血清(批号201403),均购自哈药集团生物疫苗有限公司;iELISA 抗体检测试剂盒(批号650112-2)、cELISA 抗体检测试剂盒(批号20190523)、FPA 检测诊断试剂盒(批号20201018),购自哈尔滨平河生物技术有限公司;实时荧光 PCR 检测试剂盒(批号BRU20201019P),购自哈尔滨元亨生物药业有限公司;LAMP 检测试剂盒(批号EP20210118),购自深圳立远生物科技有限公司
1.1.3 主要设备与耗材 恒温培养箱(BPC-250F),宁波江南仪器厂产品;荧光偏振仪(Synery H1 HIFD)、布病便携式荧光偏振检测仪(FLUPO III),均为美国博腾公司产品;酶标仪(sunrise),瑞士TECAN 公司产品;ABI Q5 荧光定量PCR 仪(Quant Studios 5)、恒温混匀仪(DIgtal Shaking Drybath),均为赛默飞公司产品;恒温混匀仪-加热(HH-100),立远(深圳)生物科技有限公司产品;单道和多道微量移液器(eppendorf Research Plus),德国eppendorf 公司产品。
1.2 试验方法
RBT、SAT、iELISA、cELISA 检测方法,参照《动物布鲁氏菌病诊断技术》(GB/T 18646—2018)步骤开展相关试验操作及结果判定;FPA 检测方法,按照新疆地方标准《牛羊布鲁氏菌病荧光偏振(FPA)检测方法》(DB65/T 4292—2020)开展试验及结果判定;PCR 及LAMP 检测方法,严格按照说明书开展相关操作和结果判定。其中:LAMP 检测方法的样品前处理,需要65℃灭活30 min;PCR 检测方法的样品前处理,需要在金属浴中灭活,试验需全程在生物安全柜中进行。
本试验采用2 种LAMP 检测方法:一种是可视法,可以现场操作,将反应管置于恒温震荡仪孔内,按照设定程序运行40 min 后取出反应管,肉眼观察颜色变化,判读并记录检测结果。另一种荧光法,可在实验室操作,将反应管置于实时荧光恒温扩增检测仪孔内,点击开始键进行反应,40 min反应结束后保存并记录检测结果。
1.3 数据处理
为了更好地评价几种检测方法的敏感性、特异性等指标,将SAT 检测结果作为参比标准,分别与RBT、iELISA、cELISA 和FPA 进行比较,将LAMP 与PCR 进行比较,将检测结果通过Excel软件录入,利用SPSS 20.0 软件对参比试验与诊断试验检测结果进行比较。按照公式计算假阴性率、假阳性率、符合率及Kappa 值(表1)[3]。假阳性率(误诊率)=(B/N1)×100%;假阴性率(漏诊率)=(C/P1)×100%;一致率(符合率/准确率)=[(A+D)/S]×100%;Kappa 值={[(A+D)-[(P1P2+N1N2)/S]}/{1-[(P1P2+N1N2)/S]}。Kappa 值,是一致性统计指标,能够反映测量方法的相关程度。一般认为:Kappa 值<0,一致性强度非常差(一般在实验室实际操作情况下发生的概率较低);0~0.20,一致性强度为微弱;0.21~0.40,一致性强度为弱;0.41~0.60,一致性强度为中度;0.61~0.80,一致性强度为高度;0.81~1.00,一致性强度为极强[4]。
2 结果与分析
2.1 SAT 与RBT、iELISA、cELISA、FPA 比较
依据检测对比结果(表2),参照各评价指标计算公式计算结果(表3),敏感性和特异性从高到低依次为iELISA、FPA、cELISA、RBT;符合率从高到低依次为iELISA、FPA、cELISA、RBT;Kappa 值方面,iELISA、cELISA、FPA、RBT 一致性均极强,均≥1.00。
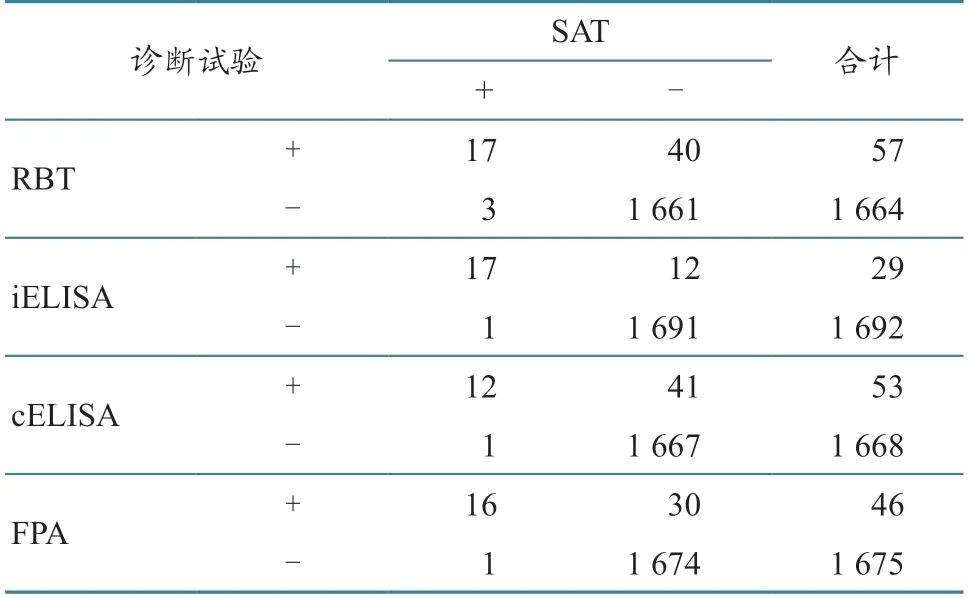
表2 SAT 检测结果与 RBT、iELISA、cELISA、FPA检测结果比较 单位:份

表3 不同检测方法准确性比较
2.2 LAMP 法检测图谱
2.2.1 可视法 同批反应的阳性对照,反应后溶液颜色由紫罗兰色变成天蓝色;而阴性对照,反应后溶液颜色仍为紫罗兰色(图1)。
2.2.2 荧光法 将反应管置于实时荧光恒温扩增检测仪孔内,点击开始键进行反应,40 min 反应结束后,在实时荧光恒温扩增检测仪上查看结果。结果(图2)显示:同批反应的阴性质控荧光值增量<2 000 000,同批反应的阳性质控荧光值增量>5 000 000,且有典型的S 型扩增曲线。
2.3 LAMP 与PCR 检测结果比较
LAMP 与PCR 比对结果(表4)显示,LAMP方法特异性强、误诊率低、漏诊率低,与PCR 符合率高、一致性强。
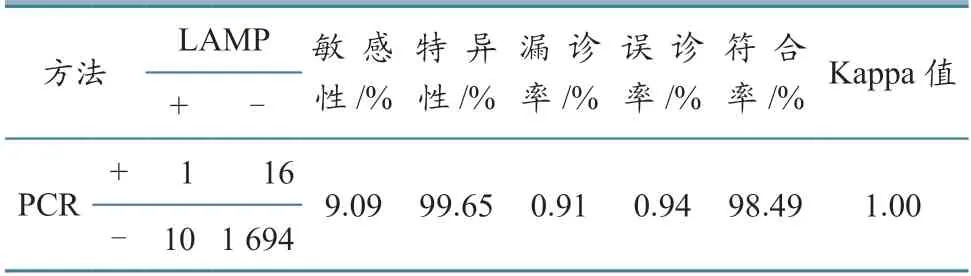
表4 LAMP 与PCR 准确性比较
3 讨论
3.1 在检疫净化阶段优先选择敏感性高的ELISA检测方法
通过试验分析发现,假阳性率能够反映检测方法的特异性,假阳性率越低,特异性就越高。本试验对iELISA、cELISA、FPA 这3 种血清学检测方法进行对比分析发现,iELISA 敏感性较高(94.44%),漏诊率最低(5.56%)。同样也有研究[5]表明,iELISA 敏感性高,特异性也优于RBT、SAT、FPA,但在基层实验室实际操作应用中血清交叉问题仍无法避免,导致试验结果出现假阴性和假阳性,试验人员也难以有效区分人工免疫和自然感染导致的阳性,因此ELISA 检测方法可用作布病的筛查。本研究发现,iELISA 与SAT的Kappa 值为1,一致性极强。SAT 方法简便、特异性高,所以在临床上得到广泛应用,这也是我国布病确诊的常用方法[6-7]。但SAT 方法检测时间需要在37 ℃条件下孵育 18~20 h,并且结果判定方面无法避免主观因素影响,单独使用 SAT 检测方法特异性较差,可能出现假阴/阳性情况,且无法区分人工免疫和自然感染阳性[8]。正因如此,该方法不适于现场应用和大批量样品检测。范伟兴等[1]的研究结果同样表明,cELISA 检测方法具有较高的特异性,可以区分自然感染和免疫阳性。李彦伟[9]研究表明,ELISA 检测方法可鉴别绝大多数布病疫苗免疫抗体,在很大程度上可将控制布病所需时间和费用降至最低,使得布病控制进程得以加快。本试验结果也显示,cELISA 与SAT 的一致性、特异性、敏感性均较高,且操作简便,可在养殖场群体检疫时发挥重要作用,同时也是布病的确诊方法。2018 年,我国现行的《动物布病实验室诊断检测技术》(GB/T 18646—2018)将ELISA(iELISA、cELISA)列入可选择布病检测方法中,为 ELISA 检测技术应用于我国布病诊断提供了有效支撑[10]。研究[11]表明,在实际检测中,cELISA检测方法更敏感,检测效率高,结果更可靠。因此,在牛布病净化中,选择敏感性高的ELISA 检测方法有利于及时发现血清学阳性牛。
3.2 理论上FPA 检测方法可以区分疫苗免疫抗体和感染抗体
FPA 检测方法简便、快速、通量大,特异性和敏感性都较高,极适合于大批量牛羊布病检疫、现场筛查和疫病监控,世界动物卫生组织(OIE)《陆生动物诊断试验和疫苗手册》第3.1.4 章布鲁氏菌病第2.6 荧光偏振分析等章节对此有详细描述。分子在溶液中作随机转动运动,转动速率与分子大小密切相关,分子越大转动速率越慢,反之转动速率越快。分子被荧光色素标记后,测量水平方向和垂直方向上的偏振光强度,就可以确定通过角度大小为68.5°的转动时间。大分子所发射出的偏振光比转速较快的小分子多。诊断牛布病时,该方法是针对牛种布鲁氏菌LPS 的小分子量片段(平均22 kD),用荧光素异硫氰酸酯(FITC)标记作为抗原,先读取1 次空白/背景值(2~3 min),再将该标记抗原添加到稀释的血清中,若有布鲁氏菌抗体存在,标记的抗原与抗体结合导致转动速度降低,然后使用荧光偏振分析仪(FPM)在添加标记抗原后约2 min 内测定出偏振值,通过偏振值mP 的大小,判断样品的阴、阳性,因此这是一种两步分析法。
FPA 在2018 年农业农村部下发的动物疫病监测方案中被确定为初步筛查试验。FPA 诊断方法检测布鲁氏菌的特异性和敏感性与cELISA 所得结果基本相同,而且操作简单方便,既适合现场检测,也适合实验室检测,可应用于大规模动物群体布病的检疫、筛查和净化工作。FPA 检测方法在一些发达国家已经被广泛应用,其同样是检测抗原/抗体相互作用的一种新技术,可以通过仪器设备现场自动化检测,反应时间短,且省去了洗板和孵育时间,能快速得出试验结果并且结果是准确、可靠的。本试验也将FPA 检测方法加入布病血清学检测方法的比对中。FPA 检测方法的优点在本研究试验结果中也得到充分展示,其敏感性达到94.12%,特异性达到98.24%。有研究[12]表明,FPA 作为筛选试验用于布病检测有较好的应用前景。本研究发现,该方法敏感性较好,漏检率较低(5.88%),一致性和特异性均在96%以上;整个检测过程在单个试管的溶液内进行,无需沉淀和洗涤,分析时间仅需几分钟,可以区分疫苗免疫抗体和感染抗体,并且可现场直接操作和判定结果。
3.3 扑杀阳性牛时,应使用敏感性高的检测方法并结合实际流行病学调查情况
本试验将LAMP 与PCR 方法进行比较,得到的结果是LAMP 与PCR 的特异性、符合率均较高,敏感性和漏诊率较低,一致性强,没有显著性差异。
2016 年7 月世界卫生组织(WHO)发布了“TB-LAMP 在结核病诊断中的应用”报告,正式推荐TB-LAMP 为结核病诊断方法,由此证明LAMP 检测方法确实准确可靠。LAMP 检测方法所需实验设施较少,生物安全要求较低,操作简单快捷,可实现快速的即时检测,在确认感染动物、消灭传染源的同时,将感染标本限定在现场,避免了带病牛污染物的转运和储存,并且病原学试验在BSL-2 实验室进行,因而降低了兽医工作者的感染风险;利用病原学检测可提高动物布病检疫的精准度,及时准确扑杀和处理病畜,进而可更加高效地实施布病净化政策。本研究发现,实时荧光PCR方法的敏感性、特异性及与LAMP 的符合率均较高,漏诊率仅为0.18%,一致性高。实时荧光PCR检测试剂盒在进行布鲁氏菌分子生物学检测时,要取得尽量精准的结果,需样本浓缩后进行核酸纯化,以纯化的核酸作为扩增模板,并且需要荧光定量PCR 仪器等特殊设备,成本较高,因而此方法不适合在基层推广和用于现场检测[13-15]。因此,在养殖场确定扑杀感染牛时,为避免假阳性,降低因误杀带来的损失,建议使用敏感性高的病原学检测方法,同时结合牛场的流行病学调查情况确定具体检测方法。
4 结论
本试验结果表明:血清学检测方法敏感性高、特异性好、漏诊率低、符合率高,而分子生物学检测方法特异性强、误诊率低、漏诊率低。对于牛群尤其是免疫牛群的布病净化,建议采用多种方法检测,进行综合分析研判,仅用一种方法可能会存在偏差。可先用iELISA 或FPA 或RBT 进行初筛,再用cELISA 或SAT 进行确诊,进而对确诊的阳性牛再进行分子生物学检测,以避免假阳性,降低因误杀带来的损失。

