氧化石墨烯的表面处理及其在生物医学领域的应用
张园园 杨宁文 何星



摘要:氧化石墨烯( graphene oxide, GO )表面具有丰富的含氧基团。通过共价键结合、疏水作用、氢键作用等吸附药物和其他大分子对 GO 表面微观结构的修饰可提升其实用性。尤其是对生物相容性的增强使得功能化的 GO 可以在临床医学领域得到广泛应用。介绍了 GO 表面处理的原理,总结了近几年国内外研究人员在 GO 表面修饰方面的研究进展,归纳了修饰后具有优异性能的功能化氧化石墨烯( functionalized graphene oxide, FGO )在生物医学领域中的广泛应用,包括疫苗载体、癌症治疗、药物输送和基因治疗等方面。最后指出,通过加强对 GO 的进一步研究,可使其在未来的生物医学领域发挥关键作用。
关键词:氧化石墨烯;表面处理;功能化氧化石墨烯;临床医学;癌症治疗
中图分类号: R 318.08文献标志码: A
Surface treatment of graphene oxide and its application in biomedical field
ZHANG Yuanyuan, YANG Ningwen, HE Xing
(School ofMaterials and Chemistry, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract: Graphene oxide (GO) surface is rich in oxygen-containing groups. Through adsorption drugs including covalent bonding, hydrophobic interaction and hydrogen bonding, and other macromolecules tomodifythesurfacemicrostructureof GO,itspracticabilitycanbeimproved. Inparticular,the enhancement of biocompatibility makes the functional GO widely used in the field of clinical medicine. The principle of GO surface treatment was introduced, the research progress of researchers at home and abroad in GO surface modification in recent years was summarized, the different modifications carried outbydomesticandforeignresearchersongoinrecentyearsweresummarized,andthewide applicationsof functionalizedgrapheneoxide (FGO) withexcellent propertiesin biomedicalfield, including vaccine carrier, cancer treatment, drug delivery and gene therapy, were concluded. Finally, it was pointed out that further research on GO could play a key role in the future biomedical field.
Keywords: grapheneoxide ; surfacetreatment; functionalizedgrapheneoxide ; clinicalmedicine ; cancer treatment
石墨烯的兴起推动了电子器件、能源等各個领域的巨大变革[1-3]。最近十几年,科学家们付出了巨大的努力来探索石墨烯,对其物理和化学性质有了更深入的了解。在碳基材料中,石墨烯及其衍生物因多功能性和可改性而备受关注,石墨烯具有大比表面积、导热、导电、容易被修饰或功能化,使它成为生物医学应用领域的独特候选材料,然而,它在水和许多有机溶剂中的不良分散性限制了它在生物医学领域中的应用。
氧化石墨烯(graphene oxide, GO)是通过对石墨烯进行氧化处理获得的,它保留了石墨烯大的平面结构和大的比表面积,同时引入了亲水基团,如环氧基、羟基(存在于片的顶面和底面)以及羧酸基团(存在于边缘)[4]。这些亲水基团可以通过氢键、静电作用、π-π堆积和共价键与其他物质相互作用,使得 GO 成为生物活性分子的潜在载体平台,因此, GO 被用作石墨烯的潜在替代品,以取代其生物应用,在药物输送、癌症治疗和治疗诊断学等生物医学方面都有广阔的应用前景。
1GO 表面处理的原理
1.1GO 的结构
GO 是一种典型的二维片层结构,具有含氧基团和单原子层[5]。GO 的片层结构由 sp2和 sp3两种碳原子排列成的六边形网格构成,使 GO 具有大的表面积和疏水性[6]。羟基、羰基[7]和环氧基等含氧基团分布在骨架的表面和边缘[8]。一般来说,GO 是由石墨烯通过各种氧化方法制备而成(见图1),其中最常用的是改进 Hummers 法[9]。虽然不同合成方法制备的 GO基本一致,但在某些方面或性质上,如横向尺寸、含氧基团数量等方面容易产生一些差异。含氧基团包括羟基、羰基和环氧基,这些基团的
引入使 GO 变成水溶性的[10]。然而,这些基团中最重要的是羧基,因为它为功能化氧化石墨烯(functionalized graphene oxide, FGO)的合成提供了基础。芳香晶格通过π-π堆积或疏水相互作用也为 GO 的修饰提供了基础[11]。用亲水性生物材料改性后, GO 在生物溶液中的溶解性和稳定性得到改善[12],因此, FGO 具有比 GO 更好的生物相容性[13]和更好的递送能力[14]。
虽然 GO 可溶于水,但由于电荷屏蔽效应,GO 在盐溶液(生理盐水)中容易聚集,其毒性也可能限制其临床应用,如诱导血小板减少、溶血、肺和肝的病理损伤等[15-16]。众所周知,纳米材料的表面化学性能是其生物相容性的关键。因此,对其进行改性以制备具有功能化的 GO 是非常重要的。一般来说, GO 的功能化有两种方法:(1)共价结合,含氧基团的反应是共价修饰的常用方法;(2)非共价结合,静电结合和疏水相互作用在非共价修饰中占主导地位。
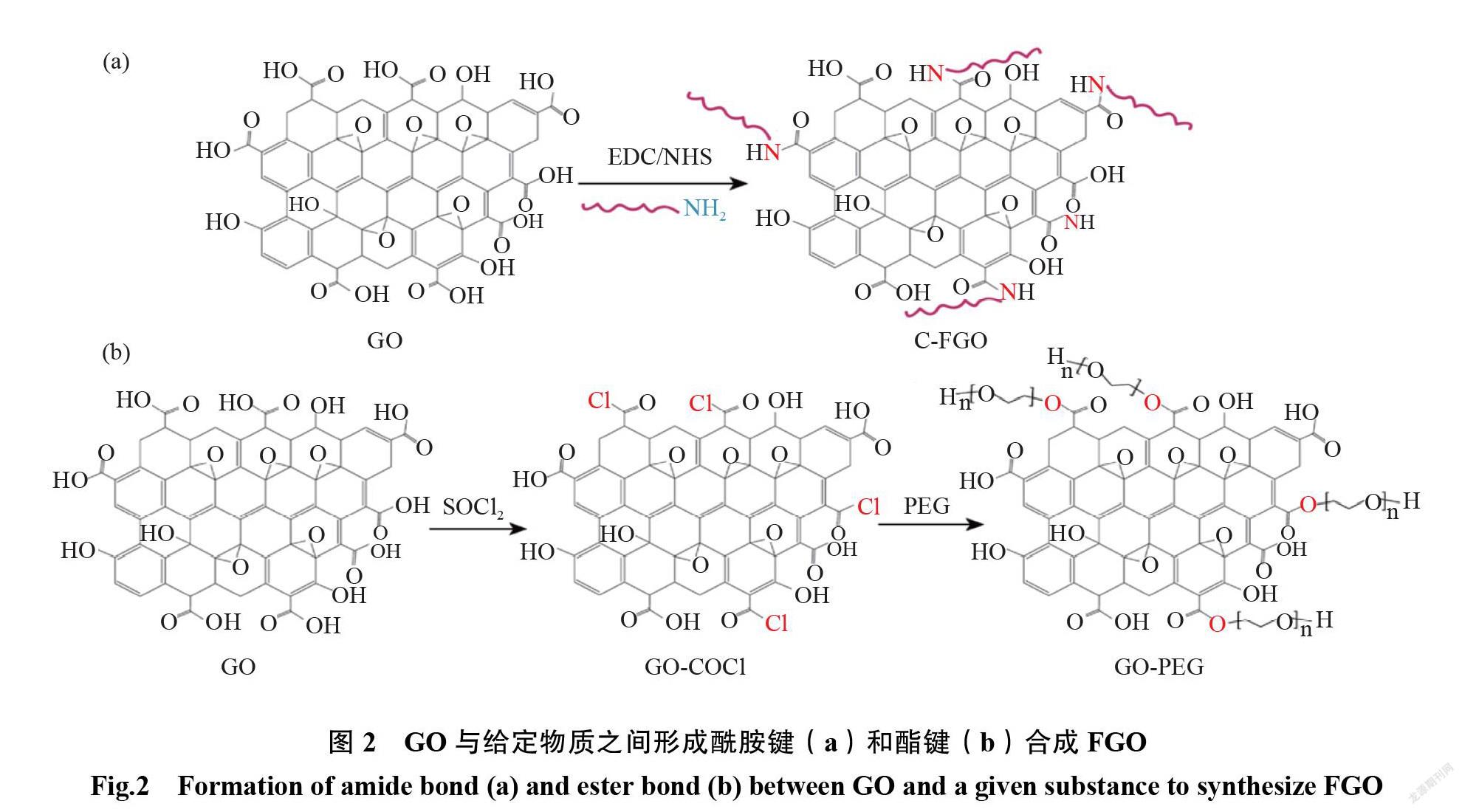
1.2GO 的共价结合
GO 中的羧基,是其共价结合的关键。通常通过在 GO 和其他给定的物质之间形成酰胺键(见图2a)或酯键(见图2b)而实现共价结合,通过上述方法已经成功地合成了一些 FGO材料,如 GO-PEI、 GO-PEG、GO-PEG-PEI、GO-PAMAM((PEI,聚醚酰亚胺; PEG,聚乙二醇; PAMAM,聚酰胺-胺型树枝状高分子)等[17-20]。给定的物质通常具有伯氨基或羟基,能与羧基表现出良好的亲核反应[21],然而,羧基不像酸酐或酰氯那样具有活性,通常需要被活化,因此,它首先被偶联试剂如 N-羟基琥珀酰亚胺(N- Hydroxysuccinimide,NHS)和1-乙基-3-(3′-二甲基氨基丙基)碳二亚胺(1-(3-dimethylaminopropyl)-3- ethylcarbodiinide hydrochloride,EDC)活化,或者用亚硫酰氯(Thionyl chloride,SOCl2)分别官能化以产生酰亚胺或酰氯基团。然后,通过活化的羧基与给定物质的一个或多个羟基、氨基或巯基反应,获得 FGO,其化学和电学性能可以通过共价修饰的调控来实现[22]。
1.3GO 的非共价结合
虽然共价结合是制备 FGO 的常用方法,但是 GO 的带负电荷性和局域π电子的存在使得非共价结合成为 GO 功能化的另一种重要的方法(见图3)。通过简单地将 GO 与给定物质混合,并进行短时间的超声处理,很容易制备非共价 FGO。
带负电荷的羧基使 GO 具有负的 zeta 电位,这赋予它与带正电荷的分子可以通过静电作用而结合[23]。Bao 等[24]报道了通过带阳离子的壳聚糖(chitosan, CS)和带负电荷的 GO 之间的静电作用来制备 CS 功能化的 GO(GO-CS)。CS 赋予 GO-CS 正 zeta 电势,这可能促使 GO-CS 与带负电荷的细胞膜相互作用,以促进细胞摄取。同CS 一样,多环芳烃也带有正电荷,可以与 GO 通过静电作用结合[25]。蛋白质、多肽等通过多种氨基酸组合的复杂大分子物质由于其疏水性和芳香性,可以通过π-π堆积或疏水作用使 GO 功能化。如牛血清白蛋白和转铁蛋白,两者都可以通过π-π堆积或疏水作用使 GO功能化;靶向分子与某些蛋白质的复合物也可以物理吸附到 GO 上来构建基于 GO 的靶向递送载体,应用于药物输送。
2FGO 的应用
2.1 疫苗載体
疫苗是预防和控制传染病、非传染病和癌症的最有效策略之一。佐剂和载体已被适当地添加到疫苗配方中,以提高抗原的免疫原性并诱导持久的免疫。一些批准用于人体的佐剂功能有限,迫切需要开发新的通用佐剂。 GO 在装载和递送抗原方面表现优异,而且显示出激活免疫系统的潜力,因此,广泛应用于生物分子的递送。
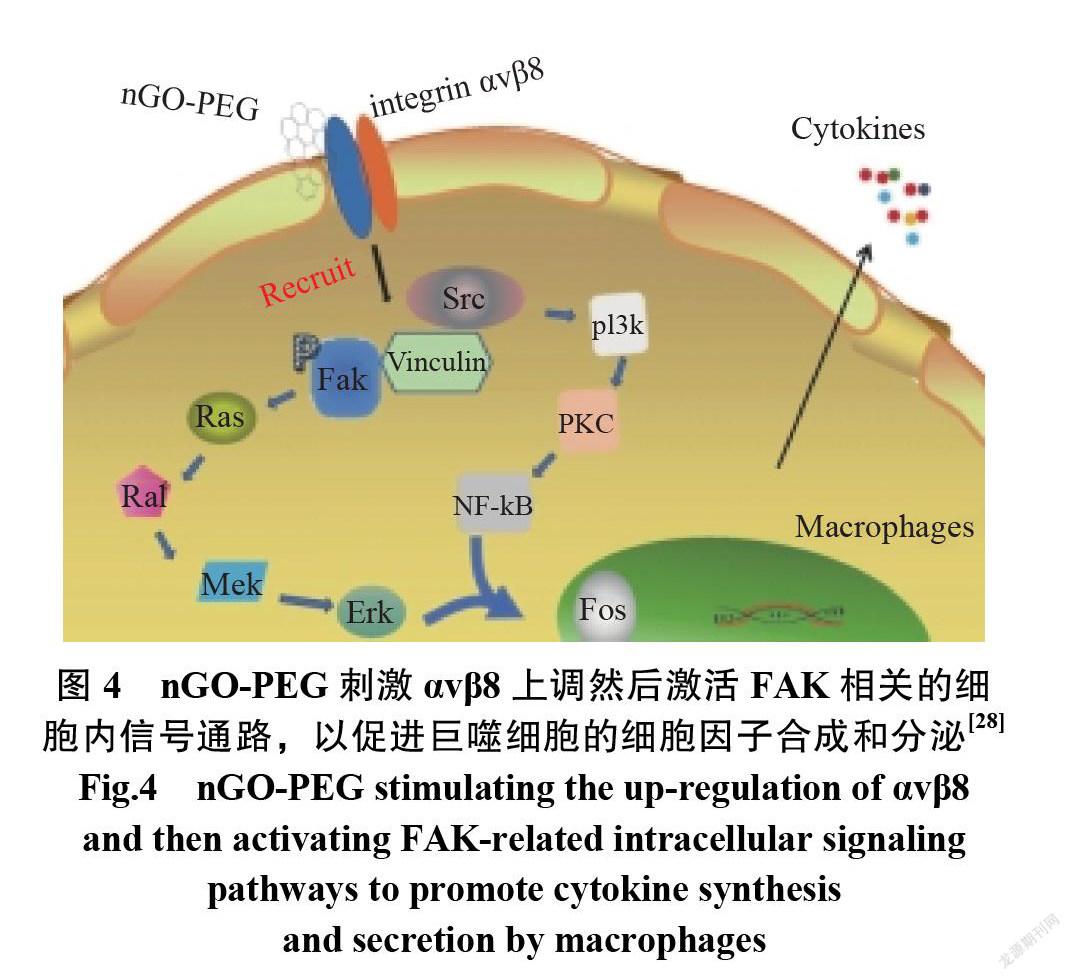
2013年,王亚培[26]在 GO 表面共价修饰靶向分子透明质酸(hyaluronic acid, HA),形成 GO-HA 纳米药物载体材料,并进一步研究了所得材料的生物相容性以及载药材料对荷瘤裸鼠的治疗效果。2017年,Zhang 等[27]报道了GO-CS(77.6μg/mg)比GO (小于40μg/mg)表现出更高的负载效率;另一种FGO-PEG-PEI 作为 CpG ODNs(CpG oligonucleotide) 的高效载体,也促进了细胞对 CpG ODNs 的摄取和细胞因子的表达,这归因于带正电荷的 PEI 和带负电荷的细胞膜之间的相互作用。2016年, Luo 等[28]证实整合素(αvβ8)通过与插膜或膜吸附的 GO- PEG 相互作用而被激活,随后触发下游信号通路的激活和细胞因子的有效释放而激活巨噬细胞。图4为nGO-PEG 刺激αvβ8上调,然后激活 FAK 相关细胞内的信号通路,以促进巨噬细胞的细胞因子合成和分泌示意图。随后,免疫系统被这些细胞因子激活,包括白细胞介素-6(Interleukin-6, IL-6)、肿瘤坏死因子-α(Tumor necrosis factor-α, TNF-α)和干扰素-γ(Interferon-γ, IFN-γ),PEG 引发强烈的免疫反应,而不会显著损伤巨噬细胞,这使得它成为疫苗配方中一种有前途的佐剂。另一项研究报告表明, PEG 可以诱导RAW264.7细胞(小鼠单核巨噬细胞白血病细胞)高分泌 IL-6,这也证明了其免疫激活的活性[17]。
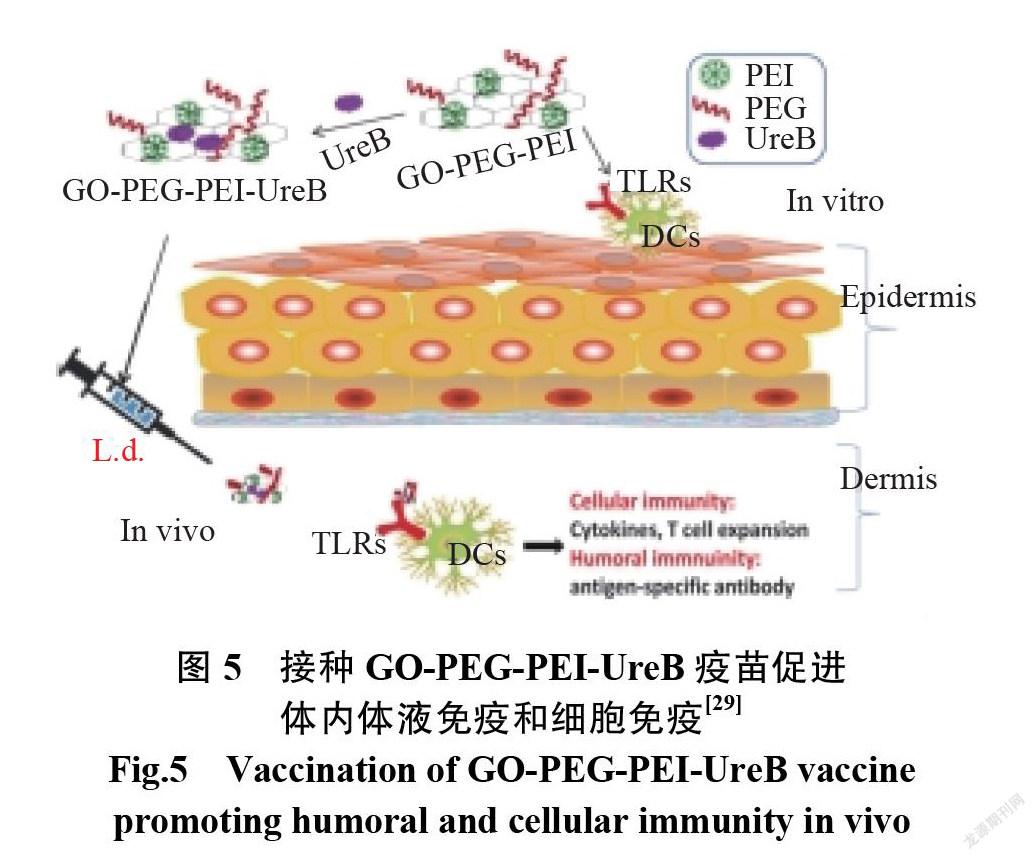
结合 GO-PEG-PEI 的树突状细胞( dendritic cells, DCs)与未经处理的 DCs 相比,会导致对toll样受体(toll-like receptor, TLR) TLR2(1.5倍)和 TLR4(1.7倍)的上调,及 TLR2和 TLR4阳性的比例增加了1.4倍和5.7倍。通过与过度表达的 TLR 结合, GO-PEG-PEI 可以有效地诱导 CD80和 CD86等共刺激分子的调节(CD80、CD86是活化 T 淋巴细胞时的协同刺激因子),导致 DCs 的成熟达到一个更高的水平。结合UreB(幽门螺杆菌尿素酶 B)后,GO-PEG-PEI-UreB疫苗大大增强了 T 细胞增殖和 TNF-α、IFN-γ和 IL-17(白细胞介素17,interleukin 17)等的分泌。这些结果证实了 GO-PEG-PEI 可以改善抗原的免疫原性,并刺激强大的细胞免疫力,从而, GO 可以作为潜在的辅助剂[29]。图 5为接种 GO-PEG-PEI-UreB疫苗促进体内体液免疫和细胞免疫示意图,表1为FGO 在疫苗载体中的应用。
2.2 癌症治疗
癌症是一种高度复杂的疾病,目前,癌症的治疗方式包括手术、化疗、放疗、激素、靶向和联合治疗等[33-34]。化疗具有广谱、高效的抑制作用,是临床抗癌应用中最常用的策略。然而,抗癌药物,如阿霉素(doxorubicin,DOX)、喜树碱(camptothecin,CPT)、紫杉醇(paclitaxel,PTX)、血根碱(sanguinarine, Sa)等,通常不溶于水,给临床应用带来很大不便,生物利用度较差。此外,抗癌药物还具有非特异肿瘤靶向性、血液循环时间短、通过代谢迅速消除等缺点[35]。大量研究指出,将 GO 用作抗癌药物的载体可显著改善其理化性质并增强其抗癌功效。最初的研究主要集中在 GO 的高载药量和生理稳定性方面。 Zhou 等[36]报道的 GO 的载药率在200%以上,高载药率主要是由于单层 GO 两侧药物分子通过π-π堆积和疏水作用的高效吸附。对于临床应用来说,载体上的药物浓度越高,意味着对癌细胞的杀伤更高效,另一方面,细胞对药物的吸收也是一个重要问题。通过能量介导的内吞途径,载药 GO 可以有效进入细胞,然后释放药物杀死癌细胞[37]。大多数用于癌症治疗的化疗剂都具有一些缺点,包括对生物降解的敏感性、在血液循环中的低半衰期、差的药物代谢动力学性质和向细胞中的被动扩散等。外排泵和药物转运体通常在癌细胞中过度表达,如糖蛋白,进一步降低细胞内的药物浓度,限制了其治疗效果[38-39]。这产生了对合适的药物递送载体的需求。 GO 载体,像其他纳米材料一样,可以保护药物免受降解,并以所需的剂量直接将药物(包括药代动力学性质较差的药物)输送到细胞、细胞质中。
杜士彬[40]通过改良的 Hummers 法制备出的 GO,平均粒径为(204.20±4.56)nm,电势为−34.2 mV,用 PEG 与 GO 共价耦合得到复合物 GO-PEG。相比 GO,GO-PEG 生物相容性更好、毒性更低。许多肿瘤细胞表面叶酸受体过表达,叶酸受体可以与叶酸特异性结合。将叶酸(folate acid, FA)共价偶联到 GO 表面,得到一种具有细胞靶向功能的载体 GO- PEG-FA,GO 的载药率高达17.79%。GO-PEG-FA 将药物 DOX 靶向输送到肿瘤细胞,释放出药物杀死肿瘤细胞,达到肿瘤治疗的目的。
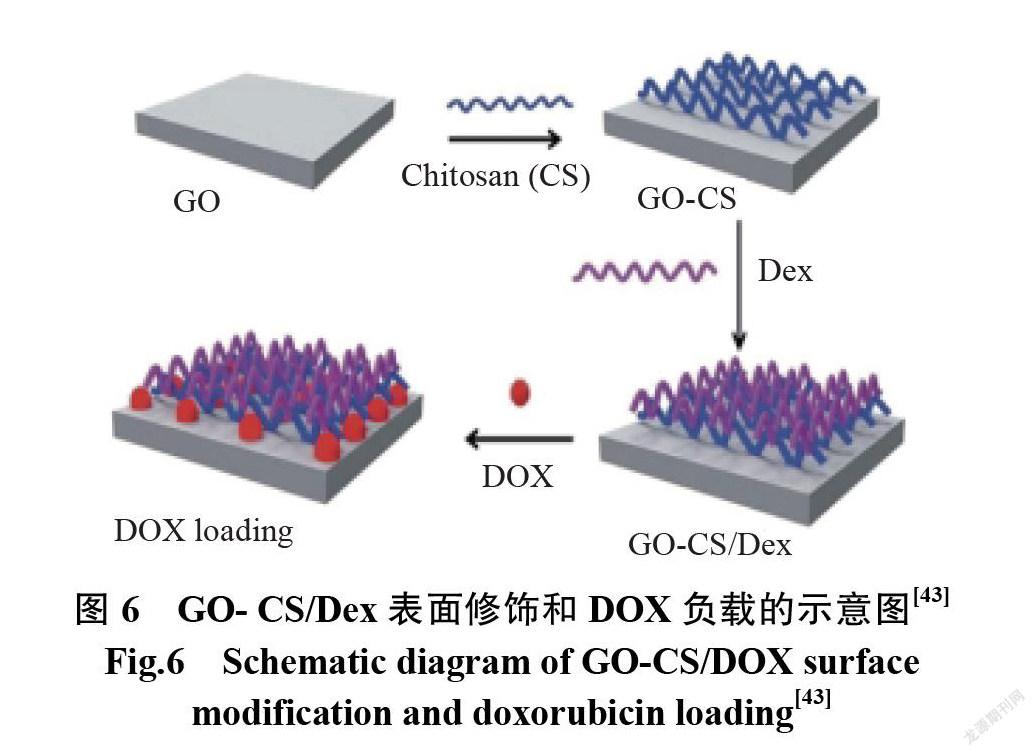
据报道,羧甲基纤维素(carboxymethyl cellulose, CMC)共轭 GO 的 GO-CMC 负载 DOX 的复合物,在 pH 为5.5时,100 h 内释放出约65%的负载药物。然而,较高的 pH 时(6.5和7.4),药物释放分别限制在20%和10%[41]。在另一项研究中,GO 与 PEG 和多巴胺(dopamine, DA)修饰的聚丙烯酰胺(polyacrylamide,PAM)共轭,然后装载 DOX。与 pH 为7.4(药物释放约6%)相比,制备的复合材料在 pH 为5.0(药物释放约31%)时,显示出显著增强的 DOX 释放性能。负载药物在酸性条件下的快速释放主要是由于质子化介導的 DOX 溶解度增强,这也与 DA 的表面修饰有关[42]。CS 在 GO 纳米片上的层层自组装被用于开发新的 DOX 传递载体[43]。图6为 GO- CS/Dex表面修饰和 DOX 负载的示意图。体外药物释放研究表明,在 pH 为5时,药物释放高于在 pH为7.4时的。除了 pH外,基于谷胱甘肽的氧化还原、近红外光或酶的存在/不存在也被用作触发药物释放的潜在刺激。在谷胱甘肽介导的氧化-还原反应的帮助下,纳米复合材料的累积释放进一步增加。除此之外,用近红外(波长808 nm)照射也导致在 pH 为7.4时药物释放的突然增加[44]。
王萍悦[45]在普朗克127(Pluronic F127)修饰 GO(PF127-GO)载盐酸阿霉素抗人神经胶质瘤的体外研究中发现,在低浓度时, PF127-GO 及 GO 对人星形胶质细胞和人神经胶质瘤细胞无毒性作用,体外试验中, PF127-GO-DOX对人神经胶质瘤细胞有较强的杀伤作用。
2.3 药物输送
医用药物在临床实践中发挥着不可替代的作用,但游离药物在体内的释放往往存在缺陷,包括非特异性靶向性、血液循环时间短、突释等,导致其可用性低、治疗效果差、副作用大[46]。为了避免上述游离药物的缺点,实现智能可控的治疗性能,药物传递系统(drug delivery system, DDS)是通过将药物封装在特定载体中而开发的。在过去的几十年中,开发了脂质体、聚合物胶束、树枝状大分子、无机介孔材料、金属有机框架、金属氧化物、贵金属和碳纳米材料等作为DDS 的载体[47-48]。其中,石墨烯基材料,尤其是 GO,由于其独特的二维结构、超大的表面积、优异的稳定性、易修饰的表面特性、良好的生物相容性,以及有前景的产业化潜力,引起了人们的极大兴趣[49]。单原子层骨架结构有利于药物分子在 GO 表面的吸附和锚定,有助于提高药物的负载能力。 GO 边缘和表面丰富的含氧官能团赋予其优异的水溶性,这将大大提高不溶性药物的亲水性。此外,含氧基团易于修饰,为特定需求带来多功能和可控的表面改性潜力。
例如,结合 CS 的 GO 被用于递送 DOX 和聚对苯二甲酸丙二醇酯(polypropanediol terephthalate, PTT),对细胞发挥抗癌活性[43]。将负载半胱氨酸和HNPa(感光剂)的 CS 进行改性,然后与 GO 相结合用于肝癌细胞的化疗、靶向治疗[50]。这种颗粒表现出靶向受体的细胞内递送,其中 DOX 和HNPa被释放(刺激反应性化疗的一部分)。HNPa和 GO 被近红外光照射导致活性氧(reactive oxygen species, ROS)产生,从而 PDT(PDT,光动力疗法)产生良好的协同疗效。
吴少玲[51]在用 GO 吸附 DOX 的试验中发现, GO 在研究的浓度范围内(0~100 mg/L)对多发性骨髓瘤细胞有低毒性; GO 不降低 DOX对多发性骨髓瘤细胞的细胞毒性,也不影响多发性骨髓瘤细胞的细胞周期; GO 不诱导多发性骨髓瘤细胞调亡,也不影响 DOX 诱导细胞凋亡的能力。表明 GO 是一种良好的纳米药物载体。
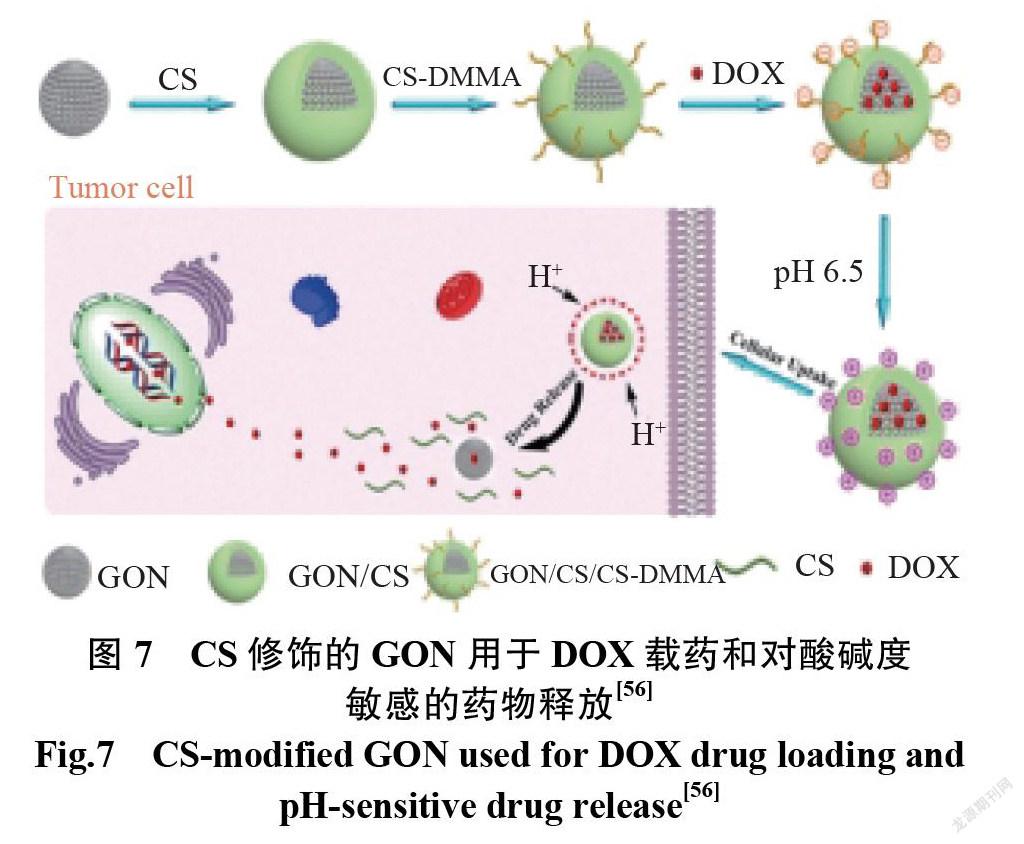
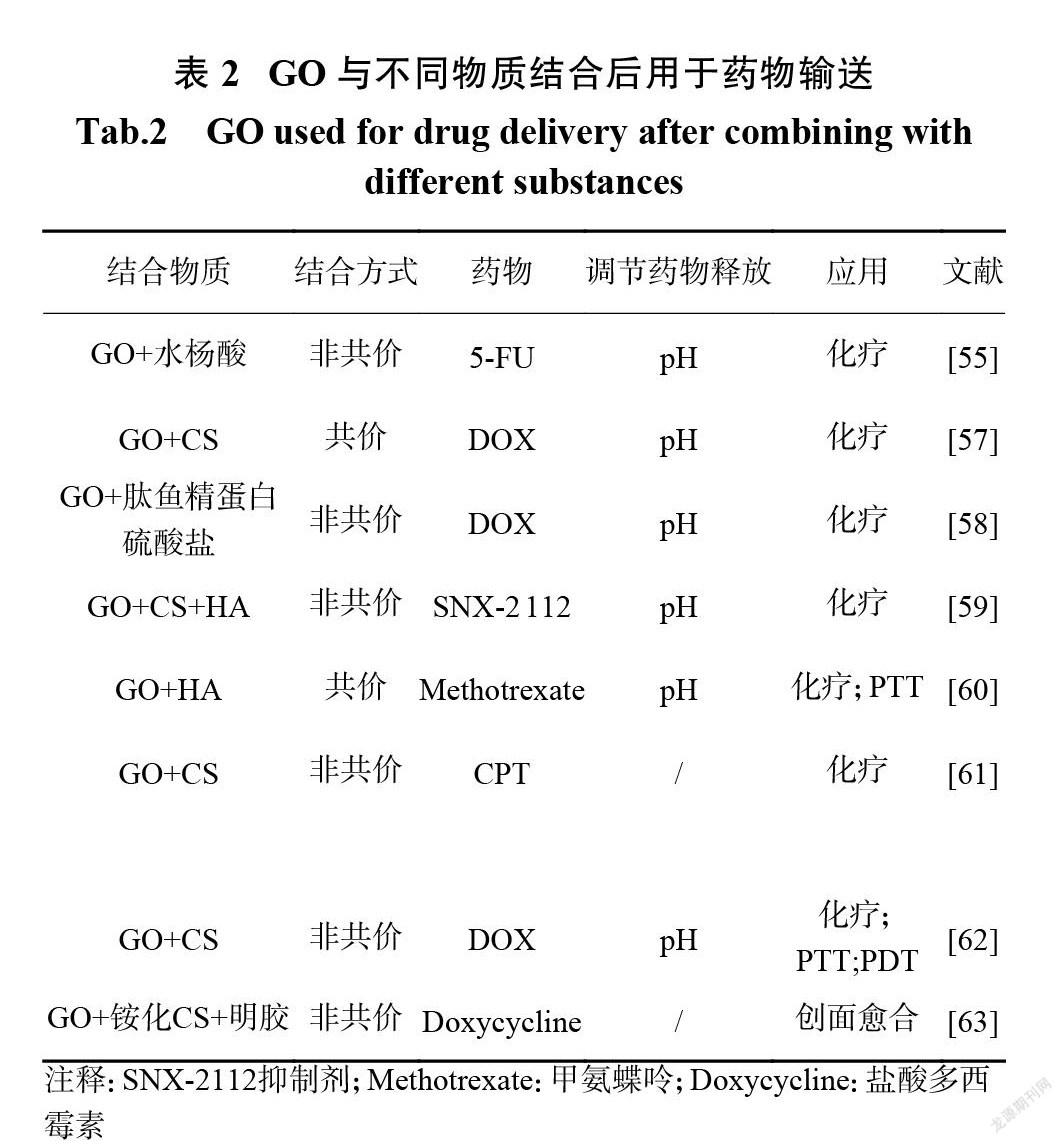
PEG 是一种应用广泛的表面改性聚合物,可以避免 GO 在生理环境中的非特异性蛋白质吸附和聚集。因此, PEG 修饰的 GO 表现出更好的生理稳定性和更高的生物安全性[13]。Xu 等[52]利用 PEG 修饰的 GO 的独特性质,采用 GO-PEG 作为 PTX 递送的纳米载体,所制备的 GO-PEG-PTX 在磷酸盐缓冲液和培养基中均表现出良好的稳定性,而未改性的 GO 样品发生聚集和沉淀。聚丙烯酸(polyacrylic acid, PAA)用于提高生物材料的水溶性,增强其生理稳定性。对于 GO 的表面改性, PAA 被认为是比 PEG 更合适的聚合物[53]。PAA 的接枝不仅增加了 GO 在生理溶液中的分散性和溶解性,而且保持了 GO 超高的抗癌药物负载量。 Lu 等[54]报道了利用 GO-PAA 递送卡莫司汀(carmustine,BCNU),并评价了其化疗效果。负载 BCNU 的 GO-PAA 显示出良好的溶解性和稳定性,优异的载药性能,并显著增强了对 GL261(小鼠神经胶质瘤细胞系,immortalised cell line)的毒性。水杨酸修饰的 GO 也具有良好的生物安全性和稳定性,高的 DOX 负载量,对 Hela 细胞(宫颈癌细胞系)有很好的抑制作用,并能传递5-氟尿嘧啶(5-fluorouracil,5-FU)用于肺癌治疗[55]。Zhao 等[56]已报道了使用 CS 修饰的 GO 纳米粒子 GON作为 DOX 的载体,并实现了对装载、运输和释放的控制。图7为 CS 修饰的 GON 用于 DOX 载药和对酸碱度敏感的药物释放示意图。由于肿瘤细胞所处的酸性微环境中 CS 的溶解,当纳米粒子在肿瘤中积累时,载体崩解,释放更多的药物分子,导致化疗增强。表2为 GO 与不同物质结合后用于药物输送数据。
2.4 基因治疗
基因治疗被广泛认为是治疗疾病的理想策略,包括癌症,这是与基因损伤相关的最严重的疾病之一[64]。成功的基因治疗需要强大的载体将基因转运到细胞中,被认为克服了传统方法的非特异性传递、潜在的细胞毒性和免疫原性[65]。在各种基因传递载体中, GO 因其超高的比表面积和吸附能力、良好的生物相容性和生物安全性、易于表面修饰而被认为是优良的载体。
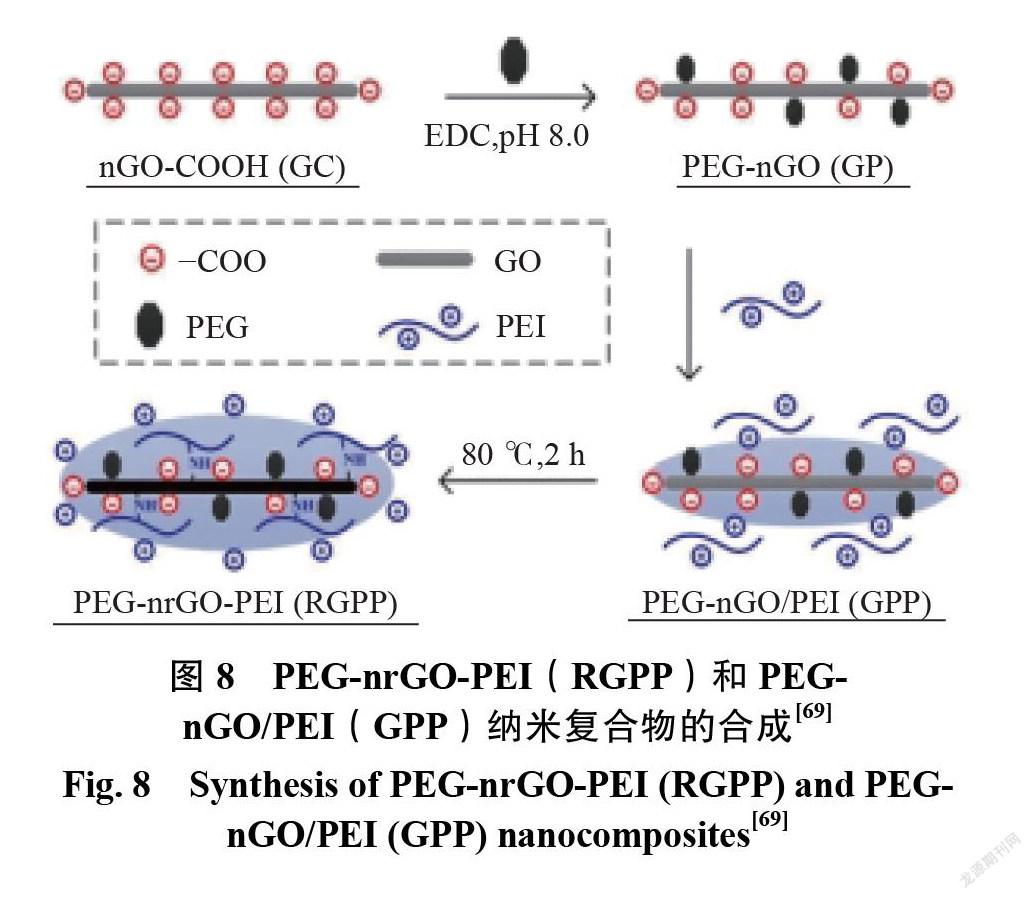
在初期的研究中, Lu 等[66]发现 GO 可以有效地吸附单链 DNA,显示了 GO 作为基因传递载体的潜力。从那时起,基于基因工程的基因传递系统被广泛研究。例如,Chen 等[67]报道了一种用于质粒DNA 递送的 PEI 修饰 GO。该基因能有效地进入 Hela 细胞,并显示出增强的转染效率。 PEI 是一种带正电荷的水溶性聚合物,可被细胞有效吸收并与核酸牢固结合。 PEI 的使用可以提高基因转染效率,但它也存在固有毒性和稳定性差的缺点。与 GO 结合后, PEI 的毒性降低,转染效率提高。为了进一步提高基因的传递效率,获得更高的转染效果,采用无创可控近红外光进行刺激,精确调节基因的表达和沉默。为此,Feng 等[68]设计了一种 PEG 和 PEI 共同修饰的 GO (GO-PEG-PEI)作为 DNA 的载体。他们证明了 GO-PEG-PEI 可以被细胞有效地吸收,并且通过近红外光谱的调整提高了基因转染效率。利用 GO-PEG-PEI作为近红外敏感基因载体,可控近红外辐射还可以促进 siRNA 传递,调节基因的表达或沉默。在另一项研究中, Kim 等[69]也证明了 PEG 和 PEI 共价修饰的 GO 具有良好的稳定性和高的pDNA递送能力,并且通过受控的近红外辐射介导的光热效应显示出增强的转染效率。图8为 EG-nrGO-PEI(RGPP)和 PEG- nGO/PEI(GPP)纳米复合物的合成示意图。
3.结论
随着生物医学材料需求的快速增长,石墨烯及其衍生物在疫苗载体、癌症治疗、药物输送和基因治疗等领域显示出光明的前景。由于生理环境的物理化学特性, GO 因其突出的亲水性和易修饰的表面特性而优于石墨烯。 GO 大的表面积、疏水的六元芳香环结构和易修饰的氧官能团,使抗癌药物、基因、蛋白质、成像剂、治疗剂和表面修饰基团等可以通过π-π堆积、静电相互作用或共价键有效地与 GO 结合,形成 FGO,在生物医学领域有广泛的应用,特别是癌症的诊断和治疗。目前为止,研究人员通过使用合理设计的 FGO,从最初用于药物/基因的递送系统、单一诊断或治疗方式的载体,到用于指导成像以提高精确肿瘤治疗的组装,形成良好的治疗平台,已经取得了很大的进展。多项研究表明, GO 在纳米医学领域具有广阔的应用前景,但其在临床应用中仍存在一些问题和迫切的挑战,如 GO 在生理条件下的稳定性、GO 与细胞的相互作用、细胞对 GO 的反应、GO 的细胞摄取方式、GO 在不同组织/器官中的生物分布和积累、GO 在体内的转化和代谢途径以及 GO 的急性/潜在毒性等等。
总之,在纳米材料、纳米技术和纳米生物医学快速发展的基础上, GO 将是生物医学领域中的一种杰出的物质,在疾病的诊断和治疗中发挥关键作用。
參考文献:
[1] ZHANG X,YAN XB,CHENJT,etal. Large-sizegraphene microsheets as a protective layer for transparentconductive silver nanowire film heaters[J]. Carbon, 2014,69:437–443.
[2] MA J Z, ZHANG J T, XIONG Z G, et al. Preparation,characterizationandantibacterialpropertiesofsilver- modifiedgrapheneoxide[J]. JournalofMaterials Chemistry, 2011, 21(10):3350–3352.
[3] ROBINSON J T, TABAKMAN S M, LIANG Y Y, et al.Ultrasmallreducedgrapheneoxidewithhighnear- infrared absorbance for photothermal therapy[J]. Journal oftheAmericanChemicalSociety, 2011, 133(17):6825–6831.
[4] DREYER D R, PARK S, BIELAWSKI C W, et al. Thechemistryofgrapheneoxide[J]. ChemicalSociety Reviews, 2010, 39(1):228–240.
[5] YE S Y, SHAO K, LI Z H, et al. Antiviral activity ofgraphene oxide: how sharp edged structure and charge matter[J]. ACSAppliedMaterials & Interfaces, 2015, 7(38):21571–21579.
[6] DIKIND A,STANKOVICHS,ZIMNEYEJ,etal.Preparationandcharacterizationofgrapheneoxide paper[J]. Nature, 2007, 448(7152):457–460.
[7] SHARMAA,VARSHNEYM,NANDASS,etal.Structural, electronic structure and antibacterial propertiesof graphene-oxidenano-sheets[J]. Chemical Physics Letters, 2018, 698:85–92.
[8] YAN T, ZHANG H J, HUANG D D, et al. Chitosan-functionalized graphene oxide as a potential immunoadjuvant[J]. Nanomaterials (Basel), 2017, 7(3):59.
[9] YU H T, ZHANG B W, BULIN C, et al. High-efficientsynthesis of graphene oxide based on improved hummers method[J]. Scientific Reports, 2016, 6:36143.
[10] KONIOS D, STYLIANAKIS M M, STRATAKIS E, etal. Dispersion behaviour of graphene oxide and reduced grapheneoxide[J]. JournalofColloidandInterface Science, 2014, 430:108–112.
[11] XULG,XIANGJ,LIUY,etal. Functionalizedgraphene oxide serves as a novel vaccine nano-adjuvant forrobuststimulationofcellularimmunity[J]. Nanoscale, 2016, 8(6):3785–3795.
[12] WANG L, YU D L, DAI R, et al. PEGylated doxorubicincloakednano-grapheneoxidefordual-responsive photochemicaltherapy[J].InternationalJournalof Pharmaceutics, 2019, 557:66–73.
[13] LI Y J, FENG L Z,SHI X Z, et al. Surface coating-dependentcytotoxicityanddegradationofgraphene derivatives: towards the design of non-toxic, degradable nano-graphene[J]. Small, 2014, 10(8):1544–1554.
[14] MANX,LIUJ,HEWX,etal. Folicacid-graftedbovineserumalbumindecoratedgrapheneoxide: an efficientdrugcarrierfortargetedcancertherapy[J]. Journalof ColloidandInterfaceScience, 2017, 490:598–607.
[15] LIAO K H, LI Y S, MACOSKO C W, et al. Cytotoxicityof graphene oxide and graphene in human erythrocytes andskinfibroblasts[J]. ACSAppliedMaterials & Interfaces, 2011, 3(7):2607–2615.
[16]陳小洁, 何星, 韩卓.氧化石墨烯尺寸分级及细胞毒性研究进展[J].有色金属材料与工程 , 2021, 42(6):48–54.
[17] WANGB,SUXP,LIANGJL,etal. Synthesisofpolymer-functionalizednanoscalegrapheneoxidewith different surface charge and its cellular uptake, biosafety andimmuneresponsesinRaw264.7 macrophages[J]. MaterialsScienceandEngineering:C,2018,90:514–522.
[18] ZHOU T, ZHANG B, WEI P, et al. Energy metabolismanalysis reveals the mechanismof inhibitionof breast cancer cell metastasis by PEG-modified graphene oxide nanosheets[J]. Biomaterials, 2014, 35(37):9833–9843.
[19] ZHANGL,ZHOUQ,SONGW,etal. Dual-functionalizedgrapheneoxidebasedsiRNAdelivery systemforimplantsurfacebiomodificationwith enhancedosteogenesis[J]. ACSAppliedMaterials & Interfaces, 2017, 9(40):34722–34735.
[20] GUYM,GUOYZ,WANGCY,etal. Apolyamidoamnedendrimerfunctionalizedgraphene oxideforDOXandMMP-9 shRNAplasmidco- delivery[J]. Materials Science and Engineering:C, 2017,70:572–585.
[21] KASPRZAK A, ZUCHOWSKA A, POPLAWSKA M.Functionalizationofgraphene:doestheorganic chemistrymatter?[J]. BeilsteinJournalofOrganic Chemistry, 2018, 14:2018–2026.
[22] FITZMAURICE D A, ACCETTAG, HAASS,etal.Comparisonofinternationalnormalizedratioaudit parameters in patients enrolled in GARFIELD-AF and treated with vitamin K antagonists[J]. British Journal of Haematology, 2016, 174(4):610–623.
[23] KRASTEVAN,KEREMIDARSKA-MARKOVAM,HRISTOVA-PANUSHEVA K, et al. Aminated graphene oxide as a potential new therapy for colorectal cancer[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019:3738980.
[24] BAOHQ,PANYZ,PINGY,etal. Chitosan-functionalized graphene oxide as a nanocarrier for drug and gene delivery[J]. Small, 2011, 7(11):1569–1578.
[25] NASROLLAHI F, VARSHOSAZJ, KHODADADI AA,etal. Targeteddeliveryofdocetaxelbyuseof transferrin/poly(allylamine hydrochloride)-functionalizedgraphene oxide nanocarrier[J]. ACS Applied Materials & Interfaces, 2016, 8(21):13282–13293.
[26]王亞培.功能化氧化石墨烯的制备及其在药物传输与磁共振成像上的应用[D].上海:上海师范大学, 2013.
[27] ZHANG HJ, YANT, XUS,etal. Grapheneoxide-chitosannanocompositesforintracellulardeliveryofimmunostimulatoryMaterialsScience144–151.CpG oligodeoxynucleotides[J]. andEngineering:C,2017,73:
[28] LUO N N, WEBER J K, WANGS, et al. PEGylatedgrapheneoxideelicitsstrongimmunological responses despite surface passivation[J]. Nature Communications, 2017, 8:14537.
[29] ZHANG L M, XIA J G, ZHAO Q H, et al. Functionalgraphene oxide as a nanocarrier for controlled loading andtargeteddeliveryofmixedanticancerdrugs[J]. Small, 2010, 6(4):537–544.
[30] WANGW,LIZJ,DUANJH,etal. Invitroenhancementofdendriticcell-mediatedanti-gliomaimmuneresponsebygrapheneoxide[J]. Nanoscale Research Letters, 2014, 9(1):331.
[31] YUE H, WEI W, GU Z L, et al. Exploration of grapheneoxide as an intelligent platform for cancer vaccines[J]. Nanoscale, 2015, 7(47):19949–19957.
[32] MENGCC,ZHIX,LIC,etal. Grapheneoxidesdecoratedwithcarnosineasanadjuvanttomodulateinnateimmuneandimproveadaptiveimmunityin vivo[J]. ACS Nano, 2016, 10(2):2203–2213.
[33] SAMAANTMA,SAMECM,LISKOVAA,etal.Paclitaxel'smechanisticandclinicaleffectsonbreast cancer[J]. Biomolecules, 2019, 9(12):789.
[34] MORTEZAEE K, NAJAFI M, FARHOOD B, et al. NF-κB targeting for overcoming tumor resistance and normal tissues toxicity[J]. Journal of Cellular Physiology, 2019, 234(10):17187–17204.
[35] NICOLAS J, MURA S, BRAMBILLA D, et al. Design,functionalizationstrategies and biomedical applications of targeted biodegradable/biocompatible polymer-based nanocarriersfordrugdelivery[J]. ChemicalSociety Reviews, 2013, 42(3):1147–1235.
[36] ZHOU T, ZHOU X M, XING D. Controlled release ofdoxorubicin from graphene oxide based charge-reversal nanocarrier[J]. Biomaterials, 2014, 35(13):4185–4194.
[37] NURUNNABI M, PARVEZ K, NAFIUJJAMAN M, etal. Bioapplicationofgrapheneoxidederivatives: drug/genedelivery,imaging,polymericmodification, toxicology,therapeuticsandchallenges[J].RSCAdvances, 2015, 5(52):42141–42161.
[38] FAHMYSA,BRÜßLERJ,ALAWAKM,etal.Chemotherapybasedonsupramolecularchemistry: a promising strategy in cancer therapy[J]. Pharmaceutics, 2019, 11(6):292.
[39] MARTÍNEZ-CHÁVEZ A, VAN HOPPE S, ROSING H,et al. P-glycoprotein limits ribociclib brain exposure and CYP3A4 restrictsitsoralbioavailability[J]. MolecularPharmaceutics, 2019, 16(9):3842–3852.
[40]杜士彬.功能化氧化石墨烯作為药物基因载体在肿瘤治疗中的应用[D].天津:天津工业大学, 2018.
[41] RAO ZQ,GE H Y,LIULL,etal. Carboxymethylcellulose modified graphene oxide as pH-sensitive drug deliverysystem[J]. InternationalJournalof Biological Macromolecules, 2018, 107:1184–1192.
[42] NAMJ,LAWG,HWANGS,etal. pH-responsiveassemblyof goldnanoparticlesand "spatiotemporally concerted" drug release for synergistic cancer therapy[J]. ACS Nano, 2013, 7(4):3388–3402.
[43] SREEHARSHA N, MAHESHWARI R, AL-DHUBIABBE,etal. Graphene-basedhybridnanoparticleof doxorubicinforcancerchemotherapy[J]. InternationalJournal ofNanomedicine, 2019, 14:7419–7429.
[44] MAKVANDI P, GHOMI M, ASHRAFIZADEH M, etal.A review on advances in graphene- derivative/polysaccharidebionanocomposites: therapeutics, pharmacogenomics and toxicity[J]. Carbohydrate Polymers, 2020, 250:116952.
[45]王萍悦.普朗克127修饰氧化石墨烯载盐酸阿霉素抗人神经胶质瘤的体外实验研究[D].长春:吉林大学, 2016.
[46] WANGL,ZHENGM,XIEZG. Nanoscalemetal-organicframeworksfordrugdelivery: aconventional platformwithnewpromise[J]. JournalofMaterials Chemistry B, 2018, 6(5):707–717.
[47]陈小波, 何星.羟基磷灰石基生物材料培养破骨细胞研究现状[J].有色金属材料与工程, 2020, 41(5):54–60.
[48] ZHANGSF,LANGERR,TRAVERSOG.Nanoparticulatedrugdelivery systemstargetinginflammationfortreatmentofinflammatorybowel disease[J]. Nano Today, 2017, 16:82–96.
[49] SHIM G, KIM M G, PARK J Y, et al. Graphene-basednanosheetsfordeliveryofchemotherapeuticsand biological drugs[J]. Advanced Drug Delivery Reviews,2016, 105:205–227.
[50] QIN X, WANG Z Q, GUO C H, et al. Multi-responsivedrug delivery nanoplatform for tumor-targeted synergistic photothermal/dynamictherapyand chemotherapy[J]. NewJournalofChemistry, 2020,44(9):3593–3603.
[51]吳少玲.氧化石墨烯装载多柔比星的性能及抗多发性骨髓瘤细胞效应的研究[D].济南:山东大学, 2013.
[52] XU Z Y, ZHUS J, WANG M W,et al. Delivery ofpaclitaxelusingPEGylatedgrapheneoxideasa nanocarrier[J]. ACSAppliedMaterials & Interfaces, 2015, 7(2):1355–1363.
[53] LEITNERVM,WALKERGF,BERNKOP-SCHNÜRCH A. Thiolated polymers: evidencefor the formation ofdisulphide bonds with mucus glycoproteins[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2003, 56(2):207–214.
[54] LU YJ, YANG H W, HUNGSC,etal. ImprovingthermalstabilityandefficacyofBCNUintreating gliomacellsusingPAA-functionalizedgraphene oxide[J]. International Journal ofNanomedicine, 2012, 7:1737–1747.
[55] ZHANGB,YANYY,SHENQJ,etal. Acolontargeteddrugdeliverysystembasedonalginate modificatedgrapheneoxideforcolorectalliver metastasis[J]. MaterialsScienceandEngineering:C,2017, 79:185–190.
[56] ZHAO X B, WEI Z H, ZHAO Z P, et al. Design anddevelopmentofgrapheneoxidenanoparticle/chitosan hybridsshowing pH-sensitivesurface charge-reversible ability for efficient intracellular doxorubicin delivery[J]. ACSAppliedMaterials &Interfaces, 2018, 10(7):6608–6617.
[57] MAHMOODZADEHF,ABBASIANM,JAYMANDM,etal. Anoveldualstimuli-responsivethiol-end- capped ABC triblock copolymer: synthesis via reversibleaddition –fragmentationchaintransfertechnique,and investigationof itsself-assembly behavior[J]. Polymer International, 2017, 66(11):1651–1661.
[58] XIE M, ZHANG F, LIU L J, et al. Surface modificationof graphene oxide nanosheets by protamine sulfate/sodiumalginateforanti-cancerdrugdeliveryapplication[J]. AppliedSurfaceScience, 2018, 440:853–860.
[59] LIUX,CHENGXZ,WANGFZ,etal. TargeteddeliveryofSNX-2112 bypolysaccharide-modified grapheneoxidenanocompositesfortreatmentof lung cancer[J]. Carbohydrate Polymers, 2018, 185:85–95.
[60] ZAHNGHB,LIY,PANZ,etal. Multifunctionalnanosystembasedongrapheneoxideforsynergistic multistagetumor-targetingandcombinedchemo- photothermal therapy[J]. Molecular Pharmaceutics, 2019, 16(5):1982–1998.
[61] DEBA,ANDREWSNG,RAGHAVANV. Naturalpolymer functionalized graphene oxide for co-delivery of anticancerdrugs: in-vitroandin-vivo[J]. International JournalofBiologicalMacromolecules, 2018, 113:515–525.
[62] ZAHARIE-BUTUCEL D, POTARA M, SUARASAN S,et al. Efficient combined near-infrared-triggered therapy: phototherapyoverchemotherapyinchitosan-reducedgraphene oxide-IR820 dye-doxorubicinnanoplatforms[J]. JournalofColloidandInterface Science, 2019, 552:218–229.
[63] LIANGYP,CHENBJ,LIM,etal. Injectableantimicrobial conductive hydrogels for wound disinfection and infectious wound healing[J]. Biomacromolecules, 2020, 21(5):1841–1852.
[64] DI SANTO R, QUAGLIARINI E, PALCHETTI S, et al.Microfluidic-generatedlipid-grapheneoxide nanoparticlesforgenedelivery[J]. AppliedPhysics Letters, 2019, 114(23):233701.
[65] DI SANTO R, DIGIACOMO L, PALCHETTI S, et al.Microfluidicmanufacturingofsurface-functionalized grapheneoxidenanoflakesforgenedelivery[J]. Nanoscale, 2019, 11(6):2733–2741.
[66] LUCH, YANGHH,ZHUCL,etal. Agrapheneplatformforsensingbiomolecules[J]. AngewandteChemie International Edition, 2009, 48(26):4785–4787.
[67] CHEN B, LIU M, ZHANG L M, et al. Polyethylenimine-functionalizedgrapheneoxideasanefficientgene delivery vector[J]. Journal of Materials Chemistry, 2011, 21(21):7736–7741.
[68] FENG L Z, YANG X Z, SHI X Z, et al. Polyethyleneglycolandpolyethyleniminedual-functionalizednano- grapheneoxideforphotothermallyenhancedgene delivery[J]. Small, 2013, 9(11):1989–1997.
[69] KIMH,KIMWJ. Photothermallycontrolledgenedeliverybyreducedgrapheneoxide-polyethylenimine nanocomposite[J]. Small, 2014, 10(1):117–126.

