PTEN磷酸化在胃癌组织中的表达与临床病理特征及预后的相关性
成亮 吴显峰 周恩成 邢铭
胃癌是消化道常见的恶性肿瘤,多数病人术后因肿瘤复发转移而死亡[1]。胃癌病死率在癌症中高居第3位[2]。早期胃癌5年生存率达到95%,中晚期5年生存率不足20%[3]。胃癌缺乏早期确诊指标,病人发现时多为中晚期,手术的病人也会出现复发和转移,寻找与胃癌早期相关的生物学标志物就至关重要。第10号染色体缺失的磷酸酶和张力蛋白同源物基因(PTEN)是一种可同时作用于多肽和磷酸肌醇底物的具有脂质磷酸酶活性的抑癌基因,在信号转导中具有重要作用[4]。PTEN的主要功能是其脂质磷酸化活性,改变下游PI3K/AKT信号通路,调节细胞增殖、代谢及细胞结构的形成[5],PTEN还与细胞周期调节、迁移及肿瘤进展密切相关[6]。有研究表明,PTEN在细胞核内具有非磷酸酶活性和独立于PI3K/AKT信号通路的功能[7],PTEN水平的轻微改变都可能影响着肿瘤的发生发展。本研究探讨PTEN磷酸化(p-PTEN)在胃癌组织中的表达与胃癌发生、发展及预后的关系。
对象与方法
一、对象
2015年1月~2016年1月于我院行胃癌根治术并经病理证实的胃癌病人85例;收集其胃癌组织标本和距癌灶边缘5cm以上且病理证实为在正常胃黏膜的癌旁组织。85例病人中,男性48例,女性37例;年龄35~73岁,平均年龄(61.23±5.14)岁。收集病人的性别、年龄、分化程度、肿瘤直径、浸润深度、癌坯抗原(CEA)、糖链抗原(CA)19-9、脉管癌栓、神经侵犯、TNM 分期、淋巴结转移等。所有病人胃癌标本均经本院病理证实,病人术前均未行放疗、化疗及生物治疗,入组胃癌病人术后联合化学药物治疗,其中以奥沙利铂+替吉奥(SOX)等化疗药物为主。在组织样本收集之前均获得病人知情同意并签署了知情同意书,排除因各种原因造成的失访病人。
二、方法
1.p-PTEN水平检测:采用免疫组化链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase,SP) 法检测。所有标本取材后经固定、脱水、石蜡包埋,对石蜡块予以4 μm连续切片,随后3%的双氧水孵育10分钟后,高温高压修复切片10分钟,滴加一抗二抗,DAB显色。用已知阳性的胃癌切片作为阳性对照,用PBS代替一抗作为阴性对照。p-PTEN抗体购自英国Abcam公司(ab47332)。免疫组化SP试剂盒、二抗及DAB 显色液均购自北京中杉金桥生物技术有限公司。
2.免疫组化染色结果判定:由两名经验丰富的病理科医师对免疫组化结果进行评估。由病理科医师镜下随机选取5个高倍镜视野计数阳性细胞,每个视野计数100个肿瘤细胞,根据染色细胞比例和染色强度进行计分。(1)染色阳性率<5%计0分,5.1%~25%计1分,25.1%~50%计2分,50.1%~75%计3分,>75%计4分。(2)染色强度:未着色计0分,淡黄色计1分,黄色计2分,棕褐色计3分。根据两种评分相加将p-PTEN分为两组,0~1分为低表达组,2分以上为高表达组[8]。
3.随访:对所有病人通过电话或查阅病例的方式进行随访,随访截止时间至2020年1月。随访时间为为4~59个月。记录下病人的总生存期(overall survival,OS)。
三、统计学处理
采用SPSS 16.0软件对数据进行分析,计数资料用例(%)表示,用χ2检验;生存分析采用Kaplan-Meier法;两者生存期的比较采用Log-rank 法;预后危险因素采用Cox 比例风险模型进行单因素和多因素分析。P<0.05为差异有统计学意义。
结果
1.胃癌组织和癌旁组织中p-PTEN的表达见表1。结果表明,p-PTEN主要存在于胞核或胞浆内,胃癌组织中的p-PTEN表达水平高于癌旁组织,两组比较差异有统计学意义(P<0.05)。
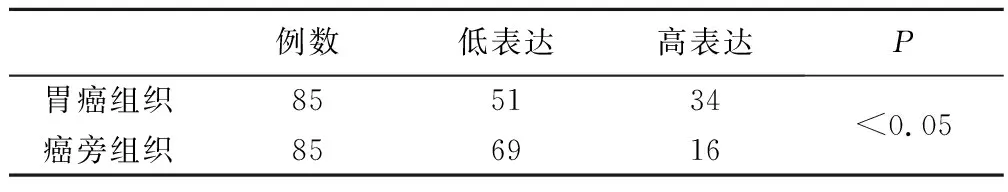
表1 胃癌组织和癌旁组织中p-PTEN表达的比较(例)
2.胃癌病人p-PTEN的表达与临床病理特征的相关分析:胃癌组织中p-PTEN的表达与病人的年龄、性别及肿瘤直径无关,差异无统计学意义(P>0.05);胃癌组织中p-PTEN的表达与分化程度、浸润深度、TNM分期及淋巴结转移有关,p-PTEN的高表达有较高的分化程度、浸润深度及TNM分期,同时p-PTEN的高表达也有较高的转移率(P<0.05)。见表2。

表2 胃癌病人p-PTEN的表达与其临床病理特征的相关分析
3.p-PTEN的表达与胃癌病人预后的关系:85例胃癌病人随访时间为4~59个月,中位OS为36.269个月;至随访结束,共有49例病人存活,36例死亡。 p-PTEN高表达病人的OS 范围为3~39个月,中位OS为24.576个月;Kaplan-Meier分析结果表明,p-PTEN高表达病人的OS较p-PTEN低表达病人明显缩短(P<0.05) 。见图1。

图1 p-PTEN的表达与胃癌病人预后的关系
4.影响胃癌病人OS的危险因素分析:将年龄、性别、CEA、CA19-9、脉管癌栓、神经侵犯等临床相关因素及p-PTEN纳入单因素Cox比例风险回归模型分析,结果显示,CEA、CA19-9、分化程度、浸润深度、TNM分期、淋巴结转移及p-PTEN表达水平是影响胃癌病人OS的影响因素,见表3;将上述影响因素纳入多因素Cox比例风险回归模型分析显示,CEA、CA19-9、TNM分期、淋巴结转移及p-PTEN表达水平是影响胃癌病人OS的独立风险因素(P<0.05)。见表4。

表3 影响胃癌病人OS的单因素分析

表4 影响胃癌病人OS的多因素分析
讨论
WHO在2020年全球癌症报告中指出,胃癌的年均标化死亡率(ASIR)较高,发病例数达到100万,死亡例数达到78.3万[9]。在我国,胃癌在男性恶性肿瘤的发病率位于第2位,女性位于第4位,总病死率居第2位[10]。早期胃癌症状不典型,诊断率低,确诊时多处于中晚期。筛选出与胃癌早期相关的生物学标志物就显得至关重要。
正常情况下,PTEN通过PI3K/AKT信号通路、MAPK途径和FAK/p130 cas途径参与调控胰岛素信号转导、诱导细胞凋亡抑制细胞不断增殖、抑制肿瘤血管形成以及细胞的侵袭和迁移[11-12]。在多种人类肿瘤中均发现PTEN的缺失或失活,PTEN的磷酸化是PTEN失活的一种新机制,PTEN的磷酸化可以有多种激酶诱导,如CK2、LKB1、GSK-3β等[13-14],PTEN的失活会影响细胞信号转导及非磷酸酶依赖的生物学功能。
我们运用免疫组化法检测p-PTEN在胃癌组织和癌旁组织中的表达情况,结果发现胃癌组织中的p-PTEN表达水平高于癌旁组织,与Papakonstanti 等[15]研究结果一致,说明胃癌病人的PTEN发生了失活。胃癌组织中p-PTEN的表达与病人的年龄、性别及肿瘤直径无关;胃癌组织中p-PTEN的表达与分化程度、浸润深度、TNM分期及淋巴结转移有关,同时p-PTEN的高表达也有较高的转移率,董爱芬等[16]研究认为,PTEN的表达与癌症的淋巴结转移具有相关性。以上结果可推测p-PTEN可能会提高肿瘤细胞的侵袭性,刺进肿瘤细胞的发生发展。本研究发现,胃癌病人中p-PTEN 高表达病人的总生存期较p-PTEN低表达病人缩短。单因素Cox比例风险回归模型和多因素Cox比例风险回归显示,p-PTEN表达水平是影响胃癌病人OS的独立风险因素。提示p-PTEN的高表达在胃癌病人中可能预示着不良结局,可作为胃癌早期诊断的分子生物学指标。

