坏死性凋亡在脑卒中疾病中的研究进展
鲁正刚,魏民,李琛,胡政伟,张恒柱
脑卒中是一种急性脑血管疾病,是由于脑部血管突然破裂,或因血管阻塞导致血液不能流入大脑相应区域,而引起脑组织损伤的一组疾病,目前主要分为缺血性卒中和出血性卒中。脑卒中因其发病率高、死亡率高和致残率高的特点,已成为危害中老年人群健康和生命的主要疾病,是全球第二大死亡原因,仅次于缺血性心脏病[1]。快速恢复脑血流量是缺血性卒中治疗的首要目标,也是神经保护治疗的前提。重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rtPA)静脉溶栓是FDA批准的治疗急性缺血性脑卒中的唯一药物。然而,由于rtPA治疗窗口狭窄及其引起的再灌注损伤,只有5%的患者从rtPA治疗中受益[2],因此迫切需要新的治疗措施来干预。坏死性凋亡是一种独特的非半胱氨酸的天冬氨酸蛋白水解酶(caspase)依赖的程序性死亡,在形态学上具有明显的坏死特征。近年来,许多研究表明坏死性凋亡涉及脑卒中相关疾病的发生机制,并且通过干预坏死性凋亡信号通路,对包括缺血再灌注损伤、脑出血、蛛网膜下腔出血等脑卒中相关疾病具有一定的保护作用,有望为治疗这些疾病的药物开发提供潜在新靶点。因此,深入阐明坏死性凋亡信号通路与脑卒中之间的关系具有一定的临床指导意义。
1 坏死性凋亡的信号转导机制
1.1 坏死性凋亡的诱导 坏死性凋亡可由多种诱因诱导,包括肿瘤坏死因子(tumor necrosis factor,TNF)家族,如TNF、TNF相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)和凋亡相关因子配体(FasL);活性氧(reactive oxidative species,ROS)[3]:脂多糖和某些病原体和损伤相关分子模式(damage related molecular model,DAMPs)等。其中由TNF-α/肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)[4]诱导的通路是目前研究最为广泛和深入的导致坏死性凋亡的通路(图1),因此将进一步讨论该途径以阐明关键的信号成分。
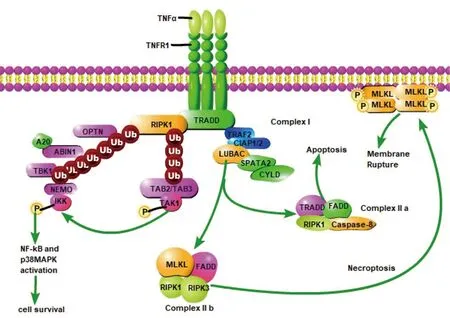
图1 TNF-α诱导的细胞死亡分子机制
1.2 复合体1的形成 TNFα与TNFR1结合后,TNFR1发生构象改变三聚化,继而通过募集多种蛋白质来触发复合体I的快速形成。这些募集的蛋白质包括:TNFR1相关死亡结构域蛋白(TNFR1-associated death domain protein,TRADD),受体相互作用蛋白激酶1(receptor-interacting protein kinase 1,RIPK1),TNFR 相关因子2(TNFR associated factor2,TRAF2),TRAF5和E3泛素连接酶细胞凋亡抑制剂(cIAP1/2)和线性泛素链组装复合体(LUBAC)。TRADD通过其死亡结构域(death domain,DD)和初始信号转导募集到TNFR1上,紧接着RIPK1与TRAF2/5通过自身DD与TRADD相互作用被招募。然后,TRAF蛋白招募cIAP1/2,后者介导复合体I成员包括RIPK1的K63泛素化。LUBAC通过与复合体I中的K63泛素链结合而被招募,并对RIPK1进行线性(M1)泛素化。去泛素化酶CYLD及其SPATA2与A20和LUBAC一起被募集到复合体I中[5]。NEMO(NF-κB必需调节剂),也称为IKKγ,与RIPK1的K63多泛素链特异性结合,进而导致IkB激酶(IKKs)复合体(IKKα和IKKβ)的后续募集。此外,RIPK1的多聚泛素化对于募集转化生长因子β活化激酶(transforming growth factor β activated kinase,TAK)复合体[TAK1和TAK1结合蛋白(TAB)1/2]也是必不可少的[6]。
1.3 RIPK1的激活 复合体I中RIPK1的广泛翻译后修饰,包括泛素化、去泛素化和磷酸化,影响着RIPK1的激活,进而决定细胞的生存或死亡以及细胞如何死亡。
1.3.1 RIPK1的泛素化和去泛素化修饰 在复合体I中,RIPK1受到多种泛素修饰,包括K63、M1和K48泛素化,这些泛素修饰在调节RIPK1的活化方面具有关键作用[7]。 RIPK1的K63泛素化由cIAP1/2催化,继而介导了LUBAC的招募。LUBAC介导RIPK1的MI泛素化,通过募集多种含有UBAN的泛素结合蛋白,包括NF-B必需调节剂(NEMO)、NF-κB激活的A20结合抑制因子1(ABIN1)和optineurin(OPTN),这些蛋白可以促进IKKs的激活、招募A20或调控RIPK1的K48泛素化,从而抑制RIPK1的激活[8-9]。Annibaldi等[10]发现CIAP1还介导RIPK1的K48泛素化,抑制其活性,促进其降解。
RIPK1上M1/K63泛素化与去泛素化复合体CYLD/SPATA2的比例对于调节其激活是至关重要[5,9]。缺乏LUBAC,例如在HOIP缺陷的细胞中,细胞对RIPK1激酶的激活和对TNFα诱导的死亡高度敏感。另一方面,CYLD主要通过去除RIPK1上的M1泛素链和K63泛素链来促进RIPK1的活化,CYLD和SPATA2缺乏部分程度上保护了细胞免受TNFα诱导的凋亡和坏死性凋亡的影响[5]。SPATA2的丢失损害了CYLD到复合体I的招募,并保留了RIPK1的M1泛素链,RIPK1的激活受到了阻碍[11]。LUBAC和去泛素化复合体的同时募集表明,复合体I中的成员,如TNFR1和RIPK1,既受泛素化又受去泛素化的调节。
1.3.2 RIPK1的磷酸化修饰 RIPK1激活也受TAK1介导的磷酸化调节。有证据表明TAK1可通过磷酸化直接抑制RIPK1的激活,也可通过激活下游激酶,包括MAPK激活的蛋白激酶2(MK2)和IKKs[12-13]间接抑制RIPK1的激活。此外,IKKα/β,也可以介导抑制性磷酸化。IKKα/β在Ser25处RIPK1的磷酸化会直接抑制RIPK1激酶活性,并阻止复合体II的组装[14]。因此,TAK1和IKKα/β通过促进NF-κB介导的基因转录和抑制RIPK1活化介导重要的促生存反应。
1.3.3 一种独特的RIPK1激活模式 Geng等[12]报道了一种独特的RIPK1激活模式,它由一种不溶于洗涤剂、高度泛素化、活化的RIPK1物种(iuRIPK1)介导;在RIPK1依赖的凋亡(RDA)中,iuRIPK1在复合体Ⅰ和复合体Ⅱ的组装之间起着关键的中介作用。此外,DD不仅在TNFR1信号的启动中起关键作用,而且在复合体Ⅰ向复合体Ⅱ的转变过程中介导RIPK1的二聚化,这对RIPK1的激活也是不可或缺的。
1.4 RDA和坏死性凋亡 RIPK1的激活代表TNFR1途径中的一个关键信号事件,并指示下游细胞死亡或存活。在正常条件下,RIPK1由于受到多种泛素化或磷酸化修饰抑制其激活,继而诱导TAK和IKK复合体的形成,二者协同触发NF-κB、p38MAPK及其下游效应激酶MK2的激活,从而促进多种促炎性和促存活基因转录和翻译[6]。当受到如HOIP缺陷、缺乏LUBAC等各种因素干扰时,RIPK1被激活,RIPK1的激活可通过驱动RIPK1-TRADD-Fas相关DD蛋白(FADD)-caspase-8复合体(复合体Ⅱa)的形成触发caspase激活并导致RIPK1依赖的凋亡(RDA)[12]。相反,当细胞在激活凋亡介质caspase-8方面有缺陷时,RIPK1激活通过形成RIPK1-RIPK3-混合系激酶结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)复合体(复合体Ⅱb)导致坏死性凋亡。像RIPK1一样,RIPK3具有N端激酶结构域,其后是包含RIP同型相互作用基序(RIP homotypic interaction motif,RHIM)的中间结构域;RIPK3通过RHIM被招募到RIPK1上被磷酸化激活。MLKL随后被磷酸化的RIPK3招募并与RIPK1和RIPK3形成一个坏死体,在坏死体中RIPK3介导MLKL的磷酸化激活。在结构上,MLKL由一个N-末端四螺旋束结构域(N-terminal four-helical bundle domain,NTD)、一个带有两个α-螺旋的支撑区(brace region,BR)和一个含有螺旋激活环和ATP结合口袋的C-末端激酶样结构域(kinase like domain,KLD)组成。MLKL的磷酸化导致BR的释放,形成四聚体和随后的八聚体而激发NTD与质膜的结合[15]。即当MLKL八聚体从坏死体上解离后,移位到质膜上,破坏了膜的完整性,导致细胞坏死性凋亡。
2 坏死性凋亡在脑卒中的研究进展
2.1 缺血性脑卒中 缺血是由于组织的血流受阻引起的,继而因氧气和营养供应不足导致细胞死亡;血流恢复后的再灌注可能导致ROS的爆发,ROS可介导RIPK1自磷酸化,继而促进RIPK3依赖的坏死性凋亡[3]。
2.1.1 坏死性凋亡与缺血性脑卒中 Degterev等[16]首次发现坏死性凋亡参与导致小鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)脑损伤,其机制不同于细胞凋亡。此外,该研究还发现了一种特异性强的坏死性凋亡小分子抑制剂NEC-1,后来被证明可抑制坏死性凋亡的关键步骤RIPK1的激活。此后,一系列研究表明坏死性凋亡与缺血性脑卒中的发病机制密切相关,针对坏死性凋亡相关蛋白的药物抑制或基因敲除能改善缺血性脑卒中后的脑损伤和神经功能。
在模拟缺血性脑卒中条件的缺氧-葡萄糖剥夺(oxygen-glu-cose deprivation,OGD)和MCAO模型中,Yang等[17]发现坏死性凋亡的相关蛋白RIPK1、RIPK3、MLKL以及缺氧条件下重要的转录因子缺氧诱导因子-1α(hypoxia-inducible factor 1-Alpha,HIF-1α)表达上调。RIPK3抑制剂GSK‘872、凋亡抑制剂zVAD-fmk与GSK‘872的联合处理和RIPK3 siRNA可抑制这些蛋白的表达,减轻细胞死亡、局灶性脑缺血和神经功能缺损,而单独使用zVAD-fmk却做不到。此外,研究还发现zVAD-fmk与GSK‘872的联合处理比单一抑制剂处理效果更好。在Qu等[18]用OGD/zVAD-fmk处理的神经元中,RIPK1和RIPK3表达上调,并且RIPK1、RIPK3与MLKL的相互作用增加,而siRNA介导的MLKL抑制减轻了神经元死亡。在小鼠缺氧/缺血(hypoxic/ischemic,H/I)脑损伤模型中,Nec-1s治疗可以减少高血糖小鼠梗死面积,表明在高血糖条件下,坏死性凋亡是导致脑损伤加剧的原因[19],而且Xuan等[20]也发现预防坏死性凋亡可以减轻H/I介导的2型糖尿病小鼠脑损伤。在小鼠脑缺血/再灌注(Ischemia/ Reperfusion,I/R)模型中,Zhou等[21]发现在12 h后MLKL表达明显增加,48 h达高峰,腹腔注射MLKL抑制剂Necrosulfonamide(NSA)后,脑梗死体积明显缩小,神经功能缺损程度明显缓解。进一步研究发现NSA通过泛素化蛋白酶体途径而不是抑制RNA转录途径降低MLKL水平。据报道,女贞苷(Ligustroflavone) 可以保护大鼠大脑免受缺血性损伤,其益处与通过抑制RIPK3与RIPK1或MLKL的相互作用有关[22]。
以上这些发现表明,坏死性凋亡与OGD、MCAO、H/I和I/R所致缺血性脑损伤有关,并且RIPK1、RIPK3和MLKL是治疗坏死性凋亡的潜在靶点,促进它们的降解可能是减少缺血性脑损伤的有效途径。
2.1.2 酸中毒通过介导坏死性凋亡促进缺血性脑卒中的发生 酸中毒在缺血性脑卒中等神经疾病中很常见。传统上,钙离子通过酸敏感离子通道1a(acid-sensing ion channel 1a,ASIC1a)内流被认为是缺血性酸中毒的主要原因。Wang等[23]发现一种新形式的神经元坏死性凋亡,ASIC1a通过将RIPK1招募到其C端(CT)促使其磷酸化激活来介导坏死性凋亡,而不依赖于其离子传导功能。在MCAO模型小鼠脑区发现ASIC1a-RIPK1相互作用和RIPK1磷酸化,ASIC1a缺乏显著阻止了RIPK1磷酸化和脑损伤,这表明ASIC1a介导的RIPK1激活参与了缺血性神经元损伤。最近,Wang等[24]证明了ASIC1a的N端(NT)与其CT相互作用,形成一种自动抑制,在静止条件下阻止RIPK1的招募和激活。具体来说,酸中毒破坏NT末端的谷氨酸残基,进而影响了ASIC1a的NT-CT的相互作用,显示出这种自抑制作用的破坏是ASIC1a构象信号转导诱导神经元坏死的基础。此外,代表远端20个ASIC1a-NT残基的膜穿透合成肽NT1-20在体外酸中毒模型和在小鼠缺血性卒中模型中都减少了神经元损伤,显示了针对ASIC1a自身抑制的治疗潜力,对抗酸中毒来起到神经保护作用。
2.2 出血性卒中 出血性脑卒中,包括脑出血(intracerebral hemorrhage,ICH)和蛛网膜下腔出血(subarachnoid hemorrhage,SAH),是一个重要的公共卫生问题,在全球范围内发病率和死亡率都很高[25-26]。脑出血后的原发性损伤通常是由于血肿对周围脑组织的机械性损伤所致。继原发性损伤之后的继发性损伤,包括炎症和细胞死亡,广泛地参与了出血后的病理过程[27]。
2.2.1 坏死性凋亡与ICH 有研究通过使用NEC-1减少细胞死亡和改善神经功能来抑制坏死性凋亡,从而间接证明在出血性脑卒中后的病理机制中存在坏死性凋亡[28]。在胶原酶诱导的ICH小鼠模型中,Zhu等[29]通过电子显微镜发现RIPK3缺陷的ICH小鼠坏死细胞较少。在自体血诱导的大鼠脑出血模型中,Shen等[30]采用小干扰RNA(Small interfering RNA,SiRNA)干扰敲除和重组腺病毒转染RIP1过表达的方法治疗大鼠脑出血模型,结果发现RIP1基因敲除使脑出血后碘化丙锭阳性细胞减少,而RIP1过表达使脑出血后脑组织碘化丙锭阳性细胞增加,免疫组化结果还表明,RIP1和RIP3、RIP1和MLKL、RIP1和caspase-8的相互作用被RIP1敲除显著抑制,但被RIP1过表达增强;在类似模型中,Zhang等[31]发现模型大鼠的血肿周围区域,E3泛素连接酶CHIP的表达增加,并且AAV/BBB-CHIP治疗可改善脑出血后大鼠的脑损伤。Seo等[32]也报道,CHIP可介导RIPK1和RIPK3的泛素化并导致它们降解,具有CHIP缺陷的细胞模型显示RIPK1和RIPK3的表达水平升高。此外,RIPK3基因敲除可以减轻因CHIP缺陷引起的炎症和早期死亡。Cai等[33]在ICH模型大鼠脑内检测到坏死性标志物p-MLKL,并发现交叉电针(cross electro-nape acupuncture,CENA)可通过阻断RIPK1和RIPK3之间的相互作用,进而抑制RIPK1介导的坏死性凋亡。另外体内实验结果显示,CENA可降低ICH模型大鼠炎症细胞因子TNF-α、IL-6和IL-8的表达。
2.2.2 坏死性凋亡与SAH RIPK1/RIPK3介导的坏死性凋亡通路也参与了SAH后的病理生理改变。Yuan等[34]采用自体输血模型,发现在SAH所致大鼠脑损伤中RIP3表达增强,24 h达高峰。基因或药物抑制RIP3或TNF-α可减轻SAH所致的脑损伤,而过表达RIP3则加重脑损伤。此外Chen等[35]发现RIPK3选择性抑制剂GSK‘872降低RIPK3和MLKL的蛋白水平,减少了RIPK3介导的细胞坏死性凋亡和随后的促炎蛋白HMGB1的胞浆转位和表达,改善了脑水肿和神经功能缺损。综上,坏死性凋亡参与了ICH和SAH所致的脑损伤,并且干扰RIPK1、RIPK3和MLKL及其相互作用是减少出血性脑损伤的有效途径。
2.3 褪黑素通过上调A20的表达抑制坏死性凋亡 褪黑素被报道在脑卒中后具有神经保护作用,无论是缺血性的[36]还是出血性的[37]。Lu等[36]发现褪黑素通过上调脑出血后去泛素化酶A20的表达,特别是小胶质细胞中A20的表达来抑制RIP3介导的坏死性凋亡。这些发现暗示A20可能成为治疗脑出血的新的潜在靶点。
3 结论与展望
坏死性凋亡,又称程序性坏死,是除凋亡之外的一种重要的细胞程序性死亡类型。自坏死性凋亡首次被报道以来,只有不到20年时间,但对其信号分子机制及其与脑卒中疾病相关性的认识有了很大的提高。坏死性凋亡参与了脑卒中所致的脑损伤,RIPK1和RIPK3以及MLKL是坏死性凋亡的重要调节因子,针对坏死性凋亡相关蛋白的抑制治疗已被证实在不同动物模型和不同细胞类型中具有神经保护作用。然而目前除rtPA外,很少有药理药物在临床上被证明是有效的,正如许多药物所显示的那样,临床前研究取得良好的效果,但在临床实践中观察到的效果较差。因此,未来需要更多类似于坏死性凋亡抑制剂或基因修饰等研究来探讨坏死性凋亡在脑卒中临床上的作用。此外,脑卒中疾病病理过程中多种死亡机制同时发生[38-39],并且与炎症机制[30]有着密不可分的联系,一些研究者通过联合使用针对不同损伤机制的抑制剂也取得了比单一抑制剂更好的治疗效果[30,40],因此未来寻找这些信号通路的共同效应因子显得十分必要。
利益冲突:所有作者均声明不存在利益冲突。

