高效降解脱铬皮屑的菌株筛选
张晓伟 ,卢欣雨 ,陈琴 ,赵胜宗 ,刘彦 *
(1. 四川大学皮革化学与工程教育部重点实验室,四川 成都 610065;2. 四川大学轻工科学与工程学院,四川 成都 610065)
1 前言
化学法(酸法、碱法)和生物法(酶法和微生物法)是制革废弃物降解的主要方式[1-4]。化学法主要是通过利用较 强的酸性试剂或碱性试剂在剧烈的条件下将制革废弃物水解,该方法不仅耗能 大、腐蚀设备,而且对环境具有一定程度的二次污染[5-6]。近年来,随着环境问题的日益突出和科技的 发展,采用生物技术处理制革废弃物受到了广泛的关 注 。其实酶法和微生物法处理制革废弃物的原理相同,皆是利用酶对底物的水解作用,但是微生物法处理不需要单独加酶,而是依靠微生物自身代谢产 生 的酶来水解底物。与酶法相比,微生物发酵法才是农业制备有机肥料的主要方式,因为皮蛋白经酶法降解 后,产物成分单一 ,主要为氨基酸和多肽[7],而 经微生物发酵尤其是经过植物益生菌发酵后,其产物中不仅含有大量的游离氨基酸、多肽等植物营养物质 ,还含有微生物代谢产生的植物内源酶 、抗菌活性物质以及植物生长调节剂(细胞分裂素 、吲 哚 乙酸等)等有利于植物生长的生物活性物质[8-10]。
含铬废革料的主要成分为胶原蛋白,其结构稳定,要想采用微生物法充分降解制革废料就需要筛选出特定的胶原蛋白降解菌。由于发酵产物是用于制备生物有机肥料,因此筛选出的菌株不仅要 能 快速高效降解胶原蛋白,还应为农业中常用的有益菌(NY/T1109—2017 中的第一级菌株)。此类菌株不会产生对植物有毒害作用的物质,还会对大多数植物有一定的促生作用[11],因此,采用此类菌株进行脱铬皮的发酵及将其发酵产物应用于农业方面更安全、更可靠。
蓝湿皮屑是含胶原蛋白的高铬含量制革废料[12],用 微 生 物 直 接 对 其 进 行 降 解 处 理 对 微 生 物 的 要 求较高,处理难度较大。需要高耐铬的胶原蛋白降解菌[13],同时降解液中还会含有极高浓度的铬,无法达到农业应用的要求。因此,本实验研究将用经过脱铬处理的皮屑作为微生物发酵的原料,通过初筛和复 筛[14-17],筛 选 获 得 最 优 的 胶 原 蛋 白 降 解 菌 同 时 又是农业益生菌的菌株,为下一步对脱铬皮屑进行发酵 处理,得到富 含 游 离 氨 基 酸 、多 肽 的 发 酵 液 打 下基础。
2 实验部分
2.1 实验材料和仪器
2.1.1 实验材料
菌 种 来源,自然降解 的 牛皮 废 料 ;牛 肉 膏(BR),酵母粉(BR),蛋白胨(BR),北京奥博星生物技术有限责任公司;明胶(AR),天津市科密欧化学试剂有限公司;硫酸铵(AR),磷酸二氢钾(AR),磷酸氢二钾(AR),硫酸镁 (AR),葡萄糖(AR),乙酸 (AR),碘酸钾(AR),成都 市 科 隆 化 学 品 有 限 公 司 ;氯 化 钠 (AR),氢 氧 化 钠(AR),柠 檬 酸钠 (AR),成 都市 科 龙化工 试 剂厂 ;乙 酸钠 (AR),茚 三酮 (AR),成 都金 山 化学试 剂 有限 公 司 ;无水乙醇(AR),成都长联化工试剂有限公司。
2.1.2 实验仪器
SHA-B 双功能水浴恒温振荡器,常州市亿能实验仪器厂;HSP-80B 恒温恒湿培养箱,上海坤天实验仪器有限公司;SQP 电子天平,赛多利斯科学仪器(北京)有限公司;UV-1100 型紫外可见分光光度计,上海美谱达仪器有限公司;PHS-3C 精密酸度计,上海仪分科学仪器有限公司。
2.2 实验内容与方法
2.2.1 发酵菌株筛选用培养基[5-6]
种子培养基:牛肉膏 3.0 g,蛋白胨 10.0 g,NaCl 5.0 g,水 1000 mL,pH 用氢氧化钠调至 8.0。
明胶培养基:明胶 25.0 g,KH2PO42.0 g,NaCl 5.0 g,MgSO4·7H2O 0.2 g,琼脂 20.0 g,水 1000 mL,pH 用氢氧化钠调至 8.0。
基础培养基:酵母粉 2.5 g,葡萄 糖 5.0 g,KH2PO414.0 g,KH2PO46.0 g,NaCl 5.0g,MgSO4·7H2O 0.2 g,
柠檬酸钠 1.0 g,硫酸铵 2.0 g,琼脂 20.0 g,水1000 mL,pH 用氢氧化钠调至 8.0。
LB 培养基:酵母粉 5.0 g,蛋白胨 10.0 g,NaCl 10.0 g,水 1000 mL,pH 用氢氧化钠调至 8.0。
2.2.2 菌株初筛
取 1 mL 自然降解的牛皮废料浸出液,用无菌水稀释后,在明胶培养基上进行划线分离,将划好线的培养基置于 37 ℃下培养 48 h。观察菌落生长情况,挑选出培养基上具有明显透明圈的单菌落,并做好编号。将有编号的单菌落置于液体种子培养基中活化 12 h,然后取种子液在固体种子培养基上划线并培养 24 h 以获取单菌落。将获取的单菌落通过点种接种到明胶培养基上,培养 36 h 后,在菌落周围滴加酸性汞试剂,观察并记录水解圈的大小。
2.2.3 菌株复筛及发酵培养基的确定
将基础培养基和 LB 培养基分别作为初筛菌株的发酵培养基,并往发酵培养基中添加一定量的脱铬皮屑(脱铬皮屑质量与发酵培养基体积比为 1∶20),脱铬皮屑与发酵培养基混匀后,置于灭菌锅中于121 ℃灭菌 20 min,放置备用。将初筛获取的菌株于液体种子培养基中培养 24 h 后,以 1%的接种量接种到发酵培养基中,发酵开始后每隔 6 h 取一次样,测定样品中游离氨基含量。根据发酵液中游离氨基的含量,筛选出能够快速降解脱铬皮屑的菌株,并对用基础培养基和 LB 培养基作为发酵培养基的效果进行比较,以获取较优的发酵培养基。空白对照组不加脱铬皮屑,其它操作相同。
2.2.4 菌株鉴定
将复筛获取的最优菌株送往北京擎科伟业生物技术有限公司进行 16S rDNA测序,根据测序结果对菌株进行初步鉴定。引物选择细菌通用引物 27F、1492R。PCR 反应体系(20 μL):10 μL 2×Pre Mix,0.8 μL 引物 27F(10 mmol/L),0.8 μL 引物 1492R(10 mmol/L),1 μL DNA 模板,7.4 μL ddH2O。PCR 反应程序:95 ℃预变性 3 min;95 ℃变性 15 s,55 ℃退火15 s,72 ℃延伸 15 s,运行 30 个循环;72 ℃延伸 5 min。
2.2.5 游离氨基的测定
游离氨基的测定方法参照罗艳华等[18]对蛋白水解物中游离氨基的测定,并对该方法中乙酸—乙酸钠缓冲液的配制进行了改进。原方法中乙酸—乙酸钠缓冲液的配制较为繁琐,因此采用应贤强等[19]的乙酸—乙酸钠缓冲液配制方法,来替换原方法中缓冲液的配制方法。
2.2.5.1 测试用溶液的配制
(1)茚三酮溶液
准确称取 0.5 g 茚三酮,用无水乙醇溶解并定容于 100 mL 棕色容量瓶中。
(2)乙酸—乙酸钠缓冲液
称取 120.0 g 乙酸钠,加入 4.0 mL 的无水乙酸或冰醋酸,加水定容于 1000 mL 的容量瓶中。
(3)碘酸钾溶液
准确称取 0.3 g 碘酸钾,加入 90 mL 蒸馏水溶解后,再加入 60 mL 的无水乙醇,使其混合均匀。
(4)标准溶液
准确称取 0.1 g 甘氨酸,加水定容于 100 mL 棕色容量瓶中,再分别取 0、1、2、3、4、5 mL 该甘氨酸溶液于 6 个 100 mL 容量瓶中定容,并按浓度从小到大的顺序依次做好编号。
2.2.5.2 游离氨基的测定
(1)标准曲线的绘制
准确吸取 1 mL 上述 6 组标准溶液分别置于 6支比色管中,再依次加入 1 mL 缓冲液、1 mL 茚三酮溶液,封好摇匀后于沸水浴中加热 15 min,然后取出放到冷水中冷却 15 min。冷却结束后,向每支比色管中分别加入 5 mL 碘酸钾溶液,并用蒸馏水定容至 10 mL。将紫外可见分光光度计波长调至 568 nm,将 0 号比色管中的空白样吸光度调为 0,然后依次测出其他 5 组样品的吸光度。以游离氨基含量为横坐标,吸光度为纵坐标绘制标准曲线,并得到线性回归方程。
(2)发酵液中游离氨基的测定
将发酵液进行一定的稀释后,准确吸取 1 mL置于比色管中,再依次加入 1 mL 缓冲液、1 mL 茚三酮溶液,封好摇匀后于沸水浴中加热 15 min 后取出,放到冷水中冷却 15 min,再加入 5 mL 碘酸钾溶液,并用蒸馏水定容至 10 mL。用紫外分光光度计在波长 568 nm 处,测定样品的吸光值。根据标准曲线中游离氨基含量与吸光度的对应关系,得到发酵液中游离氨基的含量。
3 结果与讨论
3.1 菌株初筛结果
初筛主要以富含明胶的培养基作为筛选培养基,因为明胶是胶原蛋白的部分降解产物,其结构和成分都与胶原蛋白相似,理论上能够降解明胶的微生物,在很大程度上也能降解胶原蛋白。
将水解圈大的单菌落通过点种接种到明胶培养基上,培养 36 h 后,各菌株水解圈的大小如图 1所示。
通过初筛,共获取 6 株具有水解圈的菌株,其编号分别为 P-1、P-2、P-3、P-4、P-5 和 P-6。由图 1直观观察可以看出:获取的 6 株菌株在明胶培养基上具有大小不一的水解圈,其中,P-6 的水解圈和菌落大小都是最大的,P-4 的水解圈大小次之,P-2、P-3 和 P-5 的水解圈较小,P-1 的水解圈最小,说明P-6 和 P-4 的菌株都能够快速降解明胶。

图1 菌落水解圈图Fig.1 Pictures of colony hydrolysis cycles
对各菌株的水解圈和菌落大小进行测定,测定的结果如表 1 所示。
由表 1 可知,在明胶培养基上培养 36 h 后,P-4菌的水解圈直径与菌落直径的比值最大,达到了4.57,P-2 和 P-6 菌的水解圈直径与菌落直径的比值也都达到 4 及以上,分别为 4.00 和 4.13,其它菌的水解圈直径与菌落直径的比值也皆大于等于3.20,可见该 6 株菌对明胶皆有一定的降解作用。考虑到明胶和皮蛋白在分子大小和结构上有差异,将进行复筛,以获取对脱铬皮屑具有最强降解 作用的菌株。

表1 初筛菌的菌落和水解圈大小Tab.1 Diameters of the colony of the screened strains and hydrolysis circles
3.2 菌株复筛及发酵培养基的确定
3.2.1 菌株复筛
复筛以胶原蛋白为微生物的主要营养源,通过测定蛋白质的水解度来评估菌株对胶原蛋白降解能力的大小。比较直观、可靠,实际中应用较多的是游离氨基含量测定法。因为蛋白质的水解是靠肽键的断裂来实现的,蛋白质每断开一个肽键,就会产生一个游离氨基,游离氨基越多就说明蛋白质的水解越充分,菌株对蛋白质的水解作用就越强。
3.2.1.1 发酵培养基为基础培养基
以基础培养基为发酵培养基,以 1%的接种量接种。发酵开始后每隔一定时间取一次样,并测定相应时间点下发酵液中游离氨基的含量。实验测定的不同时间点下、不同菌株的游离氨基含量如表 2所示。
由表 2 可知,菌株发酵液中的游离氨基含量均随着发酵时间的延长呈上升趋势。其中 P-1、P-2、P-3 和 P-5 菌发酵液中 的 游 离 氨基含量随发 酵 时间的延长增加缓慢,而 P-4 和 P-6 菌发酵液中的游离氨基含量随发酵时间的延长增加较快,且从 6 h开始,这两株菌产生的游离氨基含量皆明显高于其它 4 株菌,说明 P-4 和 P-6 菌对脱铬皮屑具有更强的水解作用。这与初筛得到结果相一致,说明以明胶作为底物的初筛方式是比较可行的。

表2 基础培养基为发酵培养基时发酵液中的游离氨基浓度Tab.2 Free amino content of the fermentation broth in basic medium
P-4 菌和 P-6 菌相比,P-4 菌发酵液中游离氨基含量随发酵时间的延长增加更快,在发酵 24 h 后发酵液中的总游离氨基浓度更高,达到了 5.56×10-5mol/mL, 比 P-6 菌 的 总 游 离 氨 基 含 量 高 了13.93%。因此,以基础培养基为发酵培养基时,P-4菌株对脱铬皮屑的水解作用最强。
3.2.1.2 发酵培养基为 LB 培养基
以 LB 培养基为发酵培养基进行发酵实验,每隔一定时间取样测定发酵液中游离氨基的含量。菌株发酵培养不同时间,其发酵液中的游离氨基含量如表 3 所示。

表3 LB 培养基为发酵培养基时发酵液中游离氨基的浓度Tab.3 Free amino content of the fermentation broth in LB medium
以 LB 培养基为发酵培养基,与表 2 的实验结果相似,不同菌株发酵液中游离氨基浓度随发酵时间的延长都呈现上升的趋势,如表 3 所示。而且在不同发酵时间段发酵液中游离氨基浓度均比表 2中显示的相同时间段内的要高,这是由于 LB 培养基的营养更丰富,其自身就含有较多的氨基酸、多肽等具有游离氨基的化合物。
发酵 24 h,实验菌株发酵液中游离氨基浓度皆在 4.5×10-5~5.5×10-5mol/mL 之间,游离氨基浓度相差不大,而 P-4 菌株发酵液中的游离氨基浓度还是明显高于其它 5 株菌,达到了 7.77×10-5mol/mL,比 P-6 菌 株 发 酵 液 中 的 游 离 氨 基 浓 度 还 高 了46.88%。因此,以 LB 培养基为发酵培养基时,P-4菌株也表现出了对脱铬皮屑较强的水解作用。
以两种不同的培养基作为发酵培养基实验结果表明,不论是以基础培养基还是以 LB 培养基为发酵培养基,P-4 菌株的发酵液中游离氨基浓度都是最高的,说明 P-4 菌株对脱铬皮屑的水解作用最强。因此选 P-4 菌株作为进一步实验用菌株。
3.2.2 发酵培养基的确定
由 3.2.1 的实验结果可知:以基础培养基和 LB培养基为发酵培养基,P-4 菌株发酵液中游离氨基浓度都是最高的,但 P-4 在这两种培养基中产生的游离氨基的浓度却不相同,实验结果见表 4。
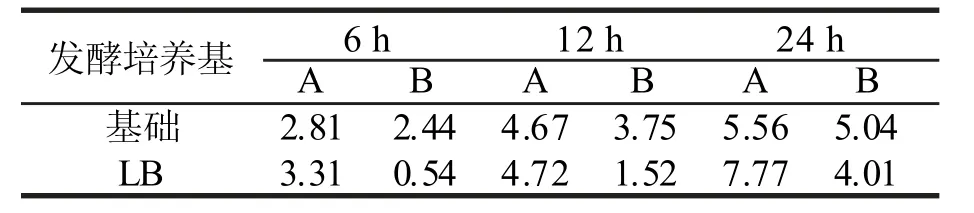
表4 发酵液中游离氨基的浓度Tab.4 Free amino content of fermentation broth
由表 4 可以看出:相同发酵时间内,发酵培养基为 LB 培养基的发酵液中总游离氨基含量都比基础培养基的高,而游离氨基浓度的增加值(与空白组未加脱铬皮屑相比) 却都比基础培养基的要低。造成这一现象的原因可能是 LB 培养基本身就含有大量的游离氨基酸、多肽类等营养物,此类营养物的分子皆比脱铬皮屑的分子要小得多,更容易为P-4 菌株所利用,脱铬皮屑被分解利用的量相对较少,因此发酵液中游离氨基的 增加自然较少;而以基础培养基作为发酵培养基,其营养成分相对匮乏,P-4 菌株只能以脱铬皮屑为营养源,因此发酵液中游离氨基的增值均比 LB 培养基高。对基础培养基和 LB 培养基的游离氨基含量进行测定,测得基础培养基游离氨基浓度为 2.80×10-6mol/mL,LB 培养基游离氨基浓度为 2.77×10-5mol/mL。LB 培养基的游离氨基含量远高于基础培养基。由此可见以基础培养基为发酵培养基更有 利于脱铬皮屑的微生物降解。
3.3 菌株鉴定
将 P-4 菌的 16S rDNA 序列 (GenBank 登录号为 OL347900) 提 交 到 https://www.ezbiocloud.net/identify[20],通过 identify 进行检索和同源性比较,用MEGA7.0 软件,以 Neighbor-joining 法构建系统发育树,结果如图 2 所示。

图2 P-4 菌的系统发育树结构图Fig.2 Phylogenetic tree of P-4 strain
筛 选 出 的 P-4 菌 株 与 Bacillus licheniformis ATCC 14580T(AE017333)的 16S rDNA 的相似水平达到了 99%以上,可基本确定筛选出的 P-4 菌为地衣芽孢杆菌。
由菌株鉴定结果显示,P-4 菌为地衣芽孢杆菌。由农业部标准 《微生物肥料生物安全通用技术规范》(NY/ T1109—2017)可知地衣芽孢杆菌为农用较高安全级别的菌株,具有促生以及分解磷钾化合 物的作用,所以筛选得到的 P-4 菌株为能够发酵降解脱铬皮屑的农用有益菌。
4 结论
(1)通过明胶培养基初筛,共 获 得 6 株具有水解圈的菌株。
(2)通过发酵培养基复筛,优选出 P-4 菌株作为脱铬皮屑发酵水解菌株。
(3) 通过基础培养基和 LB 培养基为发酵培养基的实验结果比较,确定基础培养基作为脱铬皮屑的微生物发酵降解培养基。
(4)P-4 菌株经过 16S rDNA 法鉴定,初步确定为地衣芽孢杆菌,因此满足了菌株筛选既要能够有效发酵水解脱铬皮屑,又要为农业益生菌的要求。

