蔗糖异构酶产生菌的常压室温等离子体诱变育种及发酵条件优化
彭丹丹,刘亚楠,汪佳人,孙康辉,黄继红,刘 娜
河南工业大学 生物工程学院,河南 郑州 450001
异麦芽酮糖(α-D-吡喃葡糖基-1,6-D-果糖),又名帕拉金糖,存在于蜂蜜及甘蔗提取物中[1],是由果糖和葡萄糖单体通过α-1,6糖苷键连接而成的还原性二糖[2],与蔗糖、海藻酮糖互为异构体,由微生物蔗糖异构酶(sucrose isomerase,简称SIase)催化蔗糖的酶促转化过程获得[3]。异麦芽酮糖甜度约为蔗糖的50%,具有低热量、抗龋齿及多种益生元特性,可当作蔗糖的非致龋替代品,因此在食品中被广泛用作糖的替代品[4]。
目前,异麦芽酮糖的生产主要依靠SIase异构化蔗糖获得,SIase的生产菌株主要包括:沙雷氏菌(Serratiaplymuthica)[5]、红色精朊杆菌(Protaminobacterrubrum)[6]、大欧文氏菌(Erwiniarhapontici)[7]等。众多菌属中优先选择的是能高效转化蔗糖、副产物少的菌株,因此选育高转化率的菌株对工业化生产异麦芽酮糖至关重要。微生物诱变育种仍是广泛使用的菌株选育技术,其中常压室温等离子体(ARTP)是一种新兴的诱变技术,与常用的紫外诱变、化学诱变方法相比,具有安全可控、诱变速度快、操作灵活性高、对环境友好等优势,已应用于细菌[8]、真菌孢子[9]等的诱变,选择合适的诱变条件可实现微生物的快速、多样性突变。
含有SIase的全细胞转化蔗糖是常用的异麦芽酮糖生产工艺,提高游离细胞中SIase酶活对使用全细胞生产异麦芽酮糖具有积极作用。Zhan等[10]构建工程菌B.subtilis168-SIase,并利用农业副产品甜菜糖蜜及大豆粉优化其发酵培养基,得到酶活最高为7.2 U/mL。汪晨等[11]优化重组菌E.coilBL21(DE3)的发酵培养基,优化后酶活达29.1 U/mL,较原始ErwiniarhaponticiNX-5提高了21.4倍。目前利用游离细胞催化蔗糖生产异麦芽酮糖的工艺通常存在生产周期长,菌体发酵液黏度大且成分复杂,不易与产物分离,使得分离成本增大等缺点[12]。
在利用ARTP诱变技术提高SIase活性方面,仅有张洪达等[13]对Klebsiellasp. LX3进行诱变,得到诱变后菌株Klebsiellasp. LX3-1 SIase酶活较原始菌提高了20.67%。基于ARTP诱变的菌株具有遗传稳定、诱变效果明显等特点,为进一步提高全细胞的SIase产量及酶活,得到能降低发酵液黏度的菌株,作者以购买的大黄欧文氏菌为出发菌株进行ARTP诱变,得到一株酶活相对较高且发酵液黏度有所降低的突变菌株(DXL-13)。在此基础上,结合单因素及响应面(RSM)试验,对该菌株发酵产酶条件进行优化,从而提高SIase酶活。本研究旨在为固定化细胞生产异麦芽酮糖、SIase的分离纯化、酶学性质研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种及培养基
菌种:ErwiniarhaponticiYS-1,购自中国普通微生物菌种保藏管理中心。
固体培养基(g/L):蛋白胨10,氯化钠5,牛肉膏3,琼脂15,pH自然。
种子及发酵培养基(g/L):蔗糖40,蛋白胨10,氯化钠5,牛肉膏3,pH自然。
1.1.2 主要试剂
异麦芽酮糖标准品:郑州百基生物科技有限公司;色谱级乙腈:天津市四友精细化学品有限公司;蔗糖、蛋白胨、氯化钠、牛肉膏、琼脂、Na2HPO4·12H2O、壳聚糖、醋酸等为国产分析纯。
1.2 仪器与设备
KYC-100B恒温培养摇床:上海新苗医疗器械制造有限公司;Spark多功能酶标仪:瑞士Tecan有限公司;MANDELA多功能等离子体诱变仪:北京韦恩斯技术有限公司;LC-2030C高效液相色谱仪:日本岛津。
1.3 试验方法
1.3.1 原始菌株生长曲线的建立
比浊法测菌液OD600[14]。将YS-1接种于种子培养基,30 ℃、180 r/min振荡培养,0~12 h每隔1 h取样,12~24 h每隔2 h取样,24~36 h每隔4 h取样,测定OD600。分别以培养时间、OD600为横纵坐标,绘制菌株生长曲线。
1.3.2 ARTP诱变
(1)菌悬液的制备。菌悬液制备参考周旭波等[15]的方法并略做修改。将YS-1接种于种子培养基,30 ℃、180 r/min恒温振荡培养至对数生长中后期。取发酵液1 mL,在4 ℃、10 000g的条件下离心10 min,收集菌体,无菌水洗涤之后5%甘油重悬,并梯度稀释菌液至10-6,即为诱变所需菌悬液。
(2)ARTP诱变时间的确定。采用高纯氮气作为等离子体诱变的工作气体。将诱变所需菌悬液均匀涂至金属诱变皿内表面,在300 W、28 ℃、相对湿度38%、12.0 L/min和照射距离2 mm的条件下对菌体进行诱变处理,处理时间从10 s开始,依次增加至90 s。样品诱变完毕,把附着在诱变皿内表面的微生物洗脱至液体中,形成新的菌悬液。将新的菌悬液均匀涂布至平板,30 ℃恒温培养1~2 d。平板菌落计数法计算致死率,绘制致死率曲线[16],确定最佳诱变处理时间。
致死率=(X0-X1)/X0×100%,
式中:X0为未诱变的总菌数;X1为诱变组的存活菌数。
1.3.3 菌株筛选
最佳诱变时间下处理样品并涂布,30 ℃条件下培养,初步筛选形态均匀、色泽良好的单菌落。将其编号并分别接种于种子培养基,复筛出酶活相对较高、黏度低的突变株再次诱变,最后筛选得到酶活最高的突变株。
1.3.4 SIase酶活的测定
酶活测定参考滕菲等[17]使用的方法并略做修改。取1 mL发酵液于4 ℃、10 000g条件下离心10 min收集菌体,洗涤3遍,200 μL无菌水重悬制成菌悬液,加至800 μL蔗糖底物(40 g/L)中,30 ℃水浴转化40 min,水浴完成后沸水浴5 min灭酶以终止反应。相同条件离心反应混合物,吸取适量上清液过0.22 μm滤膜,高效液相色谱法测定异麦芽酮糖的含量,计算比酶活。HPLC测定按照Zhang等[18]使用的方法进行。检测条件:安捷伦 ZORBAX Carbohydrate Analysis Colum(4.6 mm×250 mm, 5 μm);流动相:乙腈-水(体积比为75∶ 25),流速1.0 mL/min,柱温30 ℃,进样量10 μL,运行时间25 min;检测器:示差折光检测器(RID)。
酶活定义:在上述条件下,每分钟转化蔗糖为1 μmol异麦芽酮糖所需的酶量,定义为1 U[19]。
1.3.5 絮凝效果的检测
絮凝效果的检测方法参考文献[13]。
去除率=1-A1/A0×100%,
A1=A2X/V0,
式中:A0为原始菌液的OD600;A1为絮凝后实际上清液的OD600;A2为絮凝后测得上清液的OD600;X为发酵液稀释倍数;V0为加入壳聚糖后溶液总体积,mL。
1.3.6 突变株遗传稳定性试验
将经过诱变复筛得到的高酶活突变菌株在斜面培养基上转接6次,测定各菌株每代SIase酶活,检测菌株的遗传稳定性。
1.3.7 培养条件的优化
单因素试验:接种DXL-13于种子培养基,培养10 h至对数中期,以5%接种量接种于发酵培养基,30 ℃、180 r/min振荡培养。探究蔗糖质量浓度(20、40、60、80、100、120 g/L)、Na2HPO4·12H2O质量浓度(1.0、1.5、2.0、2.5、3.0、3.5 g/L)、发酵时间(6、8、10、12、14 h)、pH值(5.0、5.5、6.0、6.5、7.0)对SIase酶活的影响。
响应面试验设计:基于单因素试验的结果,根据Box-Behnken设计原理设计了三因素三水平的试验。
2 结果与分析
2.1 原始菌株的生长曲线
由图1可知:0~5 h为菌株生长的延滞期,在此期间细菌生长迟缓、繁殖极少;6 h时开始迅速繁殖,进入对数生长期,培养时间为10 h时菌株生长速度最快,因此选择10 h作为种子培养基的培养时间;20 h时逐步向稳定期过渡,有害代谢产物积累,繁殖速率逐渐下降;26 h时细菌生长进入衰亡期。鉴于对数生长中后期的细菌菌体浓度适宜、生理状态同步,且对理化因素较为敏感,有利于诱变处理,因而在实际育种工作中常选用对数生长中后期的细菌营养体进行诱变[20]。故本试验中选用18 h作为待诱变菌株的培养时间。

图1 大黄欧文氏菌YS-1生长曲线
2.2 致死率曲线
按照1.3.2方法对ErwiniarhaponticiYS-1进行ARTP诱变,以时间为自变量,存活的菌落数为因变量绘制致死率曲线。如图2所示,0~10 s菌体死亡率急剧上升,致死率达到60%以上;10~40 s照射时间逐渐延长,但由于菌体细胞壁具有一定保护作用,致死率上升速度相对缓慢;当照射处理50 s时,致死率达到92.65%;照射处理时间达到70 s以上时,ARTP作用较为强烈,细胞损伤严重,无菌体存活,死亡率达到100%。有研究[21-22]表明,当菌体致死率为90%左右时菌体的正突变率最高,梁剑光等[23]也验证了这一结论。因此确定最佳诱变时间为50 s,以得到较高的正突变率和较大的突变幅度。
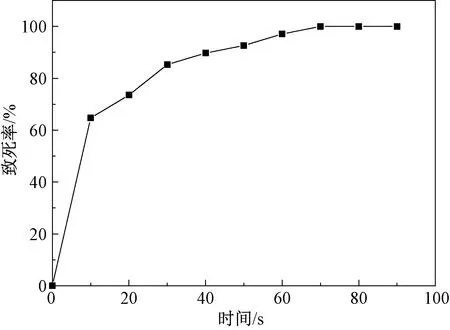
图2 ARTP注入时间对大黄欧文氏菌YS-1致死率的影响
2.3 最优菌株筛选
多轮诱变得到380株突变株,从中挑选菌落均匀、无色素产生、发酵液黏度低的菌株,将得到的正突变菌株培养18 h,测定SIase的酶活及絮凝后菌体去除率。通过对突变菌株的筛选,共获得7株酶活及菌体去除率有明显提升的菌株,分别命名为D-50、DX-58、D-56、DXL-13、DX-77、DX-59、DX-118。
如图3所示,与原始菌株相比,7株突变菌株的酶活和菌体去除率均有所提高,其中突变株DXL-13的SIase酶活最高达14.75 U/mL,较原始菌株酶活(1.34 U/mL)提高10.01倍;絮凝后菌体去除率达85.62%,较原始菌株菌体去除率(59.19%)提高44.65%。菌体去除率低说明发酵液黏度大,含有较多胶体物质,实际生产中增大了产物分离纯化的成本。DXL-13的菌体去除率达85.62%,表明发酵液黏度有大幅降低,因此选择DXL-13进行发酵条件优化。

图3 突变型菌株的SIase酶活、菌体去除率
2.4 遗传稳定性分析
将突变株DXL-13连续传代6次,测定每一代的SIase酶活。由图4可知,DXL-13经6次传代培养后,其酶活依次为14.75、14.91、15.57、15.26、13.84、14.31 U/mL,平均值为14.77 U/mL。由此可见,突变株DXL-13的遗传稳定(P>0.05)。

注:相同的小写字母表示差异性不显著(P>0.05)。
2.5 响应面试验
2.5.1 单因素试验结果
SIase酶活与蔗糖质量浓度的关系如图5A所示。温度30 ℃、pH 7.0、Na2HPO4·12H2O质量浓度2.5 g/L,发酵培养10 h条件下,蔗糖质量浓度80 g/L时,SIase酶活达到最高25.34 U/mL,较优化前(14.75 U/mL)提高了71.8%。而当蔗糖质量浓度继续增大至120 g/L时,酶活显著下降至20.18 U/mL(P<0.05),可能是由于蔗糖浓度过高会影响游离细胞的活性,因此选择80 g/L蔗糖作为最佳碳源浓度。
SIase酶活与Na2HPO4·12H2O质量浓度的关系如图5B所示。温度30 ℃、pH 7.0、蔗糖质量浓度40 g/L,发酵培养10 h条件下,SIase酶活随Na2HPO4·12H2O质量浓度的增大呈先上升后下降的趋势,当Na2HPO4·12H2O质量浓度为2.5 g/L时,SIase酶活最大为19.81 U/mL。
SIase酶活与培养时间的关系如图5C所示。温度30 ℃、pH 7.0、蔗糖质量浓度40 g/L、Na2HPO4·12H2O质量浓度2.5 g/L条件下,随着培养时间的增长,SIase酶活在12 h时达到最高(22.76 U/mL),超过12 h酶活逐渐下降,可能是由于种子培养缩短了菌株的延滞期,并在发酵培养12 h后向稳定期过渡,使酶活不再上升。
SIase酶活与培养基pH值的关系如图5D所示,SIase酶活随pH值的增大而增大,pH 6.0时酶活达到最大18.20 U/mL,pH值超过6.0时酶活迅速下降,这与Zhang等[24]优化工程菌株YarrowialipolyticaJD培养基的结果一致。这可能是由于SIase虽属酸性酶,但其最适pH值为弱酸性,多在5.5~6.0之间[25]。

注:不同的小写字母表示差异性显著(P<0.05)。
2.5.2 响应面设计与结果
根据2.5.1结果选择蔗糖质量浓度、Na2HPO4·12H2O质量浓度及培养时间3个因素进行响应面试验设计,得到DXL-13产SIase的最佳培养条件。试验因素与水平见表1,试验结果见表2。

表1 响应面试验设计因素与水平
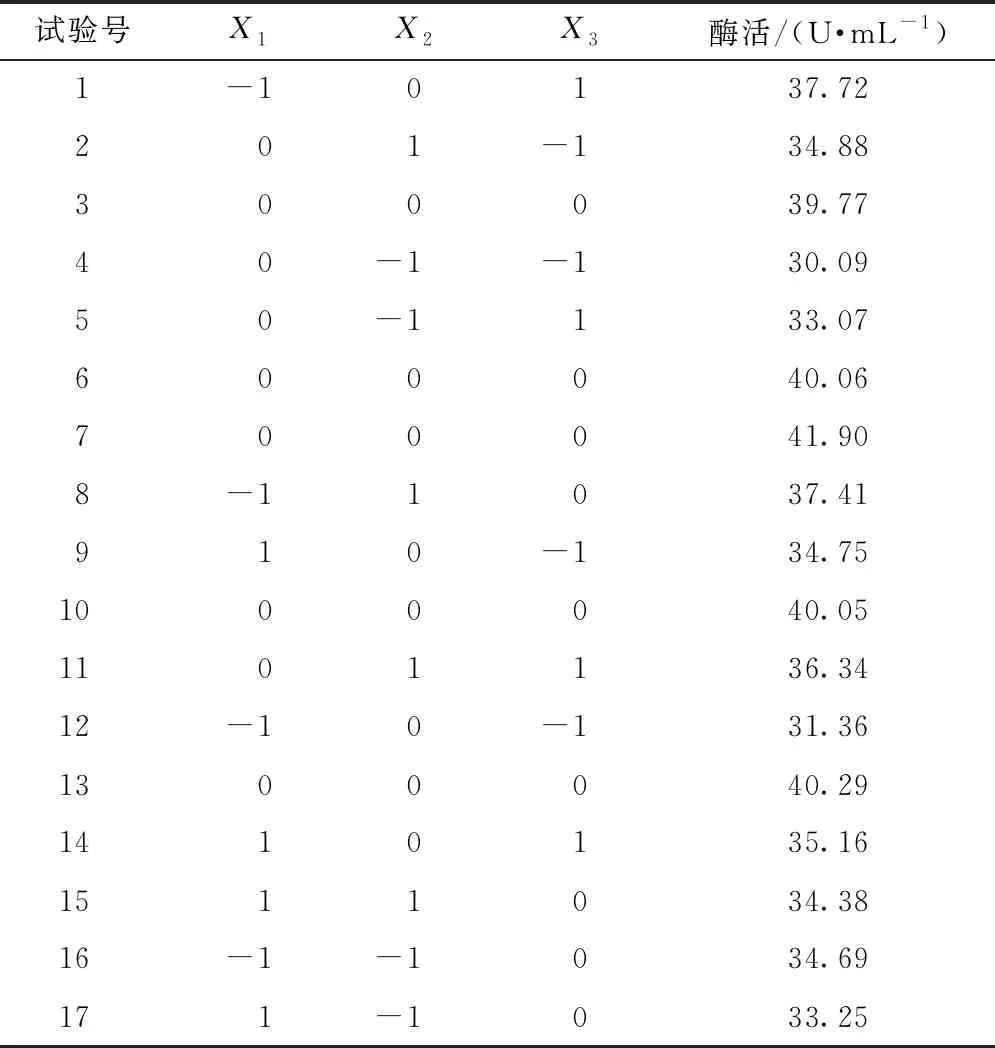
表2 响应面试验设计及结果
进行回归分析后,获得拟合方程:
Y=40.52-0.45X1+1.49X2+1.40X3-0.40X1X2-1.49X1X3-0.38X2X3-2.22X12-3.37X22-3.56X32。
由表3可知,置信水平为95%的变量说明对SIase酶活有显著影响。其中模型P<0.01,说明模型极显著,且失拟项P>0.05为不显著;R2=0.951 8,表明模型拟合效果好,预测值与试验值之间具有良好的相关性且误差小,因此可用于DXL-13菌株优化SIase酶活发酵条件的预测。3个因素中X2、X3对SIase酶活影响显著,X1无显著性。3个因素对SIase酶活的影响顺序为X2>X3>X1,且X1和X3之间的交互作用显著。

表3 响应面二次模型方差分析
2.6 模型验证
优化得到的最优因素组合是蔗糖质量浓度76.02 g/L,Na2HPO4·12H2O质量浓度2.72 g/L,培养时间12.45 h,此时SIase酶活为40.89 U/mL。综合实际情况,将条件修订为蔗糖质量浓度76 g/L,Na2HPO4·12H2O质量浓度2.7 g/L,培养时间12.5 h。为了验证模型的准确性,在此条件下进行3次平行试验,结果分别为41.73、40.54、41.15 U/mL,平均值为41.14 U/mL,与预测值无显著差异(P>0.05),相对误差小于5%(0.61%),所以响应面优化得到的条件参数准确可靠。
3 结论
通过常压室温等离子体生物诱变技术有效诱变ErwiniarhaponticiYS-1,获得一株SIase酶活提高10.01倍的DXL-13(14.75 U/mL),且菌体絮凝去除率达85.62%。发酵液黏度显著降低,细胞与絮凝剂结合作用增强,更易分离产物。此外,通过对DXL-13产SIase的发酵培养条件进行响应面优化,得到最优发酵培养条件:蔗糖质量浓度76 g/L,Na2HPO4·12H2O质量浓度2.7 g/L,培养时间12.5 h,pH 6.0。得到SIase酶活为41.14 U/mL,比优化前DXL-13酶活(14.75 U/mL)提高了1.79倍,比原始菌株YS-1酶活提高了29.70倍。

