外泌体介导白血病发展进程研究概况
★ 朱大诚 吴慧婷(江西中医药大学 南昌 330004)
白血病属于造血系统恶性增殖性疾病,根据法、美、英协作组分型标准,可将其分成急性髓系白血病(AML)、急性淋巴细胞白血病(ALL)、慢性粒细胞白血病(CML)、慢性淋巴细胞白血病(CLL)四大类。由于造血干细胞在不同阶段出现失控性增殖、凋亡受阻等导致除骨髓外其他组织被大量克隆性白血病细胞累积、浸润,引起出血、贫血、感染和不同程度的肝、脾、淋巴结肿大等一系列临床表现,严重者还可引发继发性的败血症、高尿酸血症等。自2010年起,在我国因癌症死亡排序中白血病位于前十位,至2017年白血病次均总费用持续增长,年均增长速度约4%[1];放眼全球,2015年因癌症导致死亡,白血病占据一半以上[2-3]。目前,临床上治疗白血病方法还是以造血干细胞移植、化疗为主,使患者不仅处于被动状态,还要承受巨大的经济负担和治疗带来的副作用。以上一串串触目惊心的数字无不提醒广大医务工作者,寻找高新、潜在的治疗白血病手段迫在眉睫。
外泌体研究问鼎诺贝尔医学奖,主要原因是其分布广泛,并参与多种生物学功能,如代谢性疾病、神经系统疾病、肿瘤生长发展、血管新生等方面。最早发现外泌体是在免疫反应和抵抗癌症中起到了细胞间通讯的作用,根据外泌体种类、数目、大小和内含物可对不同肿瘤做出初步诊断。国内外学者研究表明,外泌体可通过促进白血病细胞增殖、辅助免疫逃逸、抑制白血病细胞自噬、促血管新生等促进白血病的发生,在治疗方面,外泌体能直接靶向造血干细胞、监测白血病复发和耐药状态,还可作为药物载体和疫苗免疫增强剂发挥治疗白血病的作用[4-6]。基于此,本文主要以外泌体介导白血病的发病机制及诊断治疗为切入点,从上述几个方面对外泌体介导白血病发展进程展开讨论。与同类综述不同之处在于,本文搜集文献较新、内容上完整度更高、更全面,写作初衷希望医务工作者能通过阅读本文从机制上规避白血病病人肿瘤细胞或体液中的外泌体给临床治疗过程中带来的负面影响,并开拓外泌体在抗肿瘤研究中的新思路。
1 外泌体概述
1.1 外泌体的形成
1983年外泌体首次在绵羊网织红细胞培养上清液中被发现,它是由活细胞分泌的直径在40~100 nm且具有脂质双分子层结构的膜性囊泡。外泌体在人体中的分布十分广泛,在血液、脊髓液、唾液、尿液等体液中都有其存在。外泌体膜上可以携带脂质、核酸、蛋白质等生物活性物质,并将其传递给受体细胞,从而改变细胞的生理或病理功能,故外泌体又被称为细胞间的信使[7]。外泌体的合成与分泌(见图1):首先由细胞膜内陷形成内体(A),并转运所需的跨膜蛋白、内吞体分选转运复合体、凋亡相关基因-2受体蛋白等,将一些泛素化“货物”以出芽形式形成一个个小囊泡,小囊泡再汇聚成大型多泡体(MVBs)(B),MVBs可直接与细胞膜融合,将小囊泡释放到细胞外(C),这些被释放的小囊泡即为外泌体。
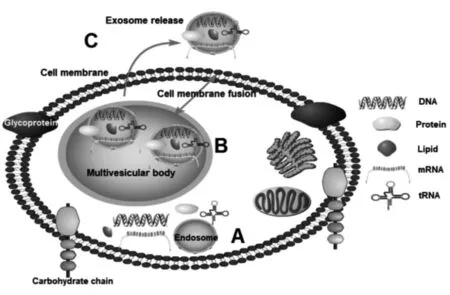
图1 外泌体的合成与分泌
1.2 外泌体的特征
在外泌体被发现后的十年间,其被科学家误认为是细胞排泄出的“垃圾”产物,直至1996年在抗原提呈细胞(APC)分泌的外泌体中发现,其可以刺激T细胞体外增殖和诱导体内抗肿瘤免疫反应。外泌体之所以能掀起科研的热潮,和它携带的各种膜标志物、活性蛋白、核酸等多种生物信息来完成细胞间通讯密不可分,在机体癌症的发生和进展中发挥着类似“顺丰快递”的作用,这也正是外泌体的特色所在。
外泌体中携带亲本细胞来源的丰富的蛋白质、DNA、mRNA、microRNA、磷脂等重要生物信息成分,主要通过三种方式参与细胞RNA转运、免疫应答等生理及病理过程。一是在细胞基质中,外泌体膜蛋白可以被具有特异性蛋白酶剪切,剪切下来的碎片作为配体与受体结合,使受体接收“新的”生物学信号。二是亲本细胞蛋白可以直接与靶细胞膜蛋白结合,从而激活靶细胞细胞内的信号通路。三是外泌体膜可以直接与靶细胞膜融合,释放非特异性的蛋白质、非编码RNA、核酸等[8-9]。通过ExoCarta数据库发现,目前构成外泌体总共包括41 860种蛋白质、3 408种mRNA、2 838种microRNA,其中蛋白质的种类和含量决定了外泌体亲本细胞的来源。主要常见的有组织相容性复合体(MHC)、热休克蛋白(HSP70、HSP90等)、跨膜蛋白(CD63、CD9、CD81等)、合成MVBs的蛋白质(ALIX、TSG101等)等[10-11]。根据外泌体所含蛋白质种类的不同可以将外泌体进行鉴定与分离,换句话说,以上蛋白或分子可作为外泌体的特殊标志物,为外泌体发挥细胞间信号转递、抗原呈递、免疫治疗等作用带来了可靠保障。
2 外泌体介导白血病发生机制
通过比较外泌体的分子成分时发现,来自肿瘤细胞的外泌体和正常细胞的外泌体的核酸与蛋白质组分存在明显区别[12]。是什么原因导致这种差异?经研究发现,这是因为外泌体与促白血病细胞增殖、帮助其躲避免疫应答、抑制白血病细胞自噬及促血管内皮细胞生长等恶性生物学行为有关(见图2)。为此,以下将围绕外泌体是如何巧妙地通过这四个经典途径介导白血病的发生展开简要阐述。

图2 外泌体介导白血病机制
2.1 促进白血病细胞增殖
肿瘤细胞的恶性增殖是癌症的基本特征。肿瘤来源的外泌体对亲本细胞有促增殖、抗凋亡的作用。通过miRNA阵列显示,miR-3613-3p是癌相关成纤维细胞(CAFs)外泌体中的miRNA,通过下调CAFs外泌体中miR-3613-3p可靶向调控细胞因子信号转导抑制因子2(SOCS2)表达,从而抑制乳腺癌细胞的增殖和转移,但miRNA在CAFs外泌体中的作用和分子机制仍不清楚[13]。CLL细胞来源的外泌体富含miR-202-3p,miR-202-3p的靶基因通过Gli-Hedgehog信号通路以增加Fused抑制蛋白表达,从而辅助肿瘤细胞的生存和增殖[14]。经实时荧光定量PCR(qRT-PCR)和蛋白印迹(WB)实验分析显示,LAMA84细胞来源的外泌体通过可激活受体细胞 ERK、NF-kB和 Akt 信号通路,使抗凋亡分子BCL-w、BCL-xl和survivin的mRNA和蛋白水平升高,及使促凋亡分子BAD、BAX和PUMA降低,以便刺激白血病细胞的增殖[15]。Circ_0009910是一种新型的白血病相关环状RNA,在HL-60和MOLM-13细胞外泌体中circ_0009910呈现上调趋势,若阻断circ_0009910可抑制HL-60和MOLM-13细胞的增殖和细胞周期进程,同时伴有较低的B细胞淋巴瘤Bax蛋白增加[16]。另外,外泌体对儿童急性淋巴细胞白血病(PALL)细胞的增殖也有一定影响,通过分离PALL患者血清中的外泌体,发现PALL-Exo中的miR-181a呈现过表达情况,并能通过调控增殖基因(PCNA、Ki-67)等诱导白血病B细胞系的细胞发生增殖,换句话说,外泌体miR-181a抑制剂可能是治疗PALL的新靶点(见图2)[17]。
2.2 实现免疫逃逸
肿瘤免疫逃逸是指肿瘤细胞通过各种机制逃避来自机体免疫系统识别及攻击,从而达到在机体内增殖和生存的目的。白血病来源的外泌体携带免疫抑制分子并将其传递给受体免疫细胞,主要通过抑制巨噬细胞、Treg细胞、NK细胞等免疫细胞功能,实现免疫抑制和降低抗肿瘤免疫应答,从而帮助白血病细胞逃避机体免疫细胞识别。Hong C S等[18]开发了小鼠AML PDX模型,发现完全移植的AML PDX小鼠产生的外泌体特征与捐赠细胞用于移植的AML患者血浆中分离的外泌体相似,移植白血病细胞产生携带人类白血病相关抗原的外泌体,AML衍生的外泌体携带免疫抑制蛋白传递给受体免疫细胞,抑制其功能。研究证实,用K562来源的外泌体处理人骨髓间充质干细胞(BMSCs)和小鼠巨噬细胞,结果表明外泌体处理BMSCs导致NO产量增加和ROS产量减少,以及巨噬细胞中IL-10过表达和iNOS转录水平的下调,调节巨噬细胞的氧化还原电位,引导巨噬细胞向肿瘤相关巨噬细胞极化,从而影响骨髓生态位,创造对肿瘤有利的微环境[19]。有研究发现,将CLL来源的外泌体或hY4单独转移到单核细胞可促进IL-6、CCL2、PD-L1的表达(见图2),从而驱动TLR信号有助于肿瘤细胞躲避免疫攻击,导致病情发展迅猛[20]。虽然BAG6的外泌体自身就存在缺陷,但在CLL晚期患者血浆中可溶性BAG6 水平明显升高,这可能与其促进白血病细胞参加免疫逃逸相关[21]。
2.3 抑制自噬
自噬几乎存在于所有真核生物中,适度的自噬有利于清除损伤的细胞器和出现错误折叠的蛋白质。在细胞、分子水平上,不仅丝状伪足可以作为外泌体内化的部位,使这些细胞突起的动态解构过程中内吞作用增强,而且自噬相关蛋白质复合物也能参与外泌体的发生,二者在机制上交互通信,在功能上相辅相成,对维持细胞适应性和稳态起着重要的作用。同K562比较,K562R(IMT)细胞中的外泌体释放PI3K/Akt/mTOR信号靶标和自噬活性显著增加,达沙替尼通过下调Akt/mTOR活性,下调beclin-1和Vps34的表达,从而防止外泌体释放和抑制自噬(见图2),促进对伊马替尼耐药的CML细胞发生凋亡[22]。自噬对白血病细胞常表现出双重性,但关于其与外泌体的相关研究还有待加强,未来就外泌体-自噬相互作用很有可能成为攻克白血病复发和耐药的新型策略[23]。
2.4 促血管新生
血管的新生能为癌细胞提供营养,也是癌症恶化的标志之一。有研究显示,AML细胞来源的外泌体含有血管内皮生长因子(VEGF)和VEGF受体的mRNA,可以诱导人脐静脉内皮细胞(HUVECs)表达VEGFR及促进HUVECs糖酵解,导致HUVECs增殖血管重构和获得化疗耐药性,这些发现可能有助于开发针对AML来源的外泌体新的治疗策略[24]。有学者发现,内皮细胞通过摄取CLL来源外泌体后,形成管腔样结构能力增强,其机制可能与外泌体富集miR-146a、miR-155、miR-150的调控相关[25]。CLL患者的细胞内氯离子通道蛋白1(CLIC1)显著增加,并在CLL细胞分泌的外泌体中显著富集,外泌体通过转移CLIC1来调控ITGβ1-MAPK /ERK信号,加速HUVECs转移和血管生成,提示CLIC1可能是CLL外泌体在肿瘤微环境中的治疗靶点(见图2)[26]。还有研究表明,CML细胞来源的外泌体可直接与内皮细胞相互作用,促进血管新生[27]。
3 分子标志物参与白血病靶向诊断
现有白血病诊断方法不利于其早期诊断,存在误诊率高、重复性低的现象。同健康人比较,白血病患者血清中含有大量外泌体,并携带亲本细胞来源的特异性的致病信息分子,如microRNA受外泌体表面膜保护,具备较好的稳定性,因此可作为理想的分子标志物,用于白血病的靶向诊断和预后。田淼等[28]采用solexa法对7例 AML 患者和7 例健康对照者血浆外泌体中 miRNAs进行测序,发现2个新miRNAs和211个已知的差异表达miRNAs, 其 中 miR-155-5p、miR-335-5p、xxxm0038-5p及miR-451a差异显著,通过对上述4种miRNA进行富集分析和靶基因预测,发现AML 患者血浆中外泌体 miRNA特异性明显,这一发现对进一步研发AML白血病标记物诊断和无创诊断方法有深远的意义。刘静茹等[29]对提取THP-1和HL-60细胞中外泌体,并对HL-60外泌体进行鉴定,通过流式细胞术发现其中存在特异性抗原分子CD81及CD63,该方法能够快速、简便地为白血病早期诊断提供依据。AML的生物标记物FLT3、NPM1、MMP9、IGF-IR和 CXCR4及 涉 及 白 血病复发的mRNA同时出现在AML外泌体中[30]。Moloudizargari M[31]发现在白血病患者血清中分泌更多的外泌体,其中miR-155、miR-17-5p、miR-1246和Let-7b等作为非侵入性生物标志物呈现高稳定性和特异性表达。吕云飞[32]通过qRT-PCR检测到AML患者外周血外泌体含量明显增高,其中Let-7b、miR-660、miR-532高表达的患者总生存期和无事件生存期相对更长。Xu Y C等[33]通过纳米跟踪、深度RNA测序等技术,找到BMSCs外泌体对AML细胞的影响及其潜在的miRNA介导机制,在KG-1a细胞中,BMSCs来源的外泌体可能通过hsa-miR-124-5p作用,促进细胞凋亡及抑制周期进程,这些发现突出了白血病来源的外泌体在细胞表达中的贡献,及其作为生物标志物和治疗策略靶标的潜在价值。
4 外泌体在白血病治疗中的作用
4.1 药物递送
因外泌体具有脂质双分子结构,其中的miRNA可受其保护,不易被RNase水解,具有靶向性强、生物兼容性、高稳定性、以及能跨越血脑屏障等独特优势,因此外泌体能作为较理想的药物递送载体[34]。迄今为止,外泌体作为药物载体所载运的“货物”主要包括基因类药物(siRNA、mRNAs及非编码RNA等)、抗癌类药物(紫杉醇、阿霉素)和增强免疫等等。Bellavia D等[35]利用HEK293T 细胞来表达与IL-3片段融合的外泌体蛋白Lamp2b,搭载伊马替尼的IL3-Lamp2b外泌体能够靶向作用于CML细胞并抑制体内、外癌细胞增殖。Altanerova U等[36]研究提出,将氧化铁纳米颗粒标记MSC后,其可以释放含有氧化铁的外泌体,当肿瘤细胞内吞该外泌体时,外部交变磁场诱导热疗后, 能发挥消融肿瘤细胞的作用。另外,关于植物外泌体的研究也在不断深入,特别是在中医药抗肿瘤方面,如在人类血液中能检测到吃过植物食物的miRNA,古言药食同源,也许就能达到异曲同工之妙;再有通过NCBI GEO数据库证实健康人体组织RNAseq原始数据样本和黄芩、半枝莲、柴胡等中药外泌体中miRNA确实可以进行跨界转运,以此发挥抗炎、抗肿瘤等多种作用,这一发现对于利用携带miRNA 中药外泌体治疗肿瘤来说也是一个新的契机[37-39]。如,外泌体能作为姜黄素载体,通过外泌体将姜黄素递送至肿瘤细胞中以促癌细胞毒性,抑制肿瘤细胞生长,显著增加姜黄素生物利用度,为开发新型抗癌药物提供依据[40-41]。
4.2 免疫疗法
外泌体好似一把双刃剑,在白血病发病机制中起着负面作用,但在治疗白血病中又蕴含巨大潜能,如外泌体已应用于白血病的疫苗接种和作为白血病有效免疫治疗剂。Yao Y等[42]基于树突状细胞(DC)摄取白血病细胞来源的外泌体(LEX)携带有亲本的抗原,将L1210 白血病细胞植入DBA/2小鼠中,并分别给予L1210 白血病细胞分泌的外泌体(LEXL1210)、组成DC/LEXL1210复合体,通过分离免疫小鼠T细胞,发现来自经LEXL1210与DC/LEXL1210免疫小鼠的T细胞对 L1210 细胞具有杀伤活性且后者更强。Huang F等[43]发现慢病毒shRNA能沉默亲本白血病细胞中TGF-β1的表达,与未修饰LEX相比,LEXTGF-β1si免疫能更有效地促进CD4+T细胞增殖和Th1型细胞因子的分泌,刺激更强的特异性细胞毒性淋巴细胞(CTL)应答和NK细胞毒作用,对小鼠免疫接种LEXTGF-β1si后,能抑制肿瘤生长和延长其生存期,提示外泌体免疫疫苗在免疫治疗白血病方面具有很大的潜力。Hus I等[44]在2008年证实了针对CLL的自体DC疫苗接种的潜在效果,结果显示外周血中白血病细胞和Tregs的数量降低,且对其他恶性血液病的研究也表现出类似的作用。还有,外泌体在MSC中也发挥免疫抑制作用,注射MSC来源外泌体是有效的移植物宿主反应(GvHD)治疗方法,能够减少外周血单个核细胞分泌细胞因子TNF-α、IFN-γ 和 IL-1β[45]。
5 小结与展望
综上,本文以外泌体为主线,扼要阐明了其参与白血病的发生与发展,从机制引入,到作为生物标志物参与到白血病靶向诊断,最后落足于药物递送和疫苗免疫疗法。如前文所述,外泌体血管内皮细胞对外泌体摄取能力过强、白血病来源的外泌体通过“蒙骗”和“伪装”手法助力肿瘤细胞躲避免疫应答,为癌细胞创造更安全的增殖环境等,这些也能作为科研学者找到新的抗癌研究的切入点。
伴随外泌体在科研圈崭露头角,对其诸多研究还有待继续深入,就像Thery所说,现在对于外泌体的认识,就好比20世纪中后期对于免疫的认识,只知道B细胞能产生抗体,但无法识别与捕获[46]。的确,现阶段关于外泌体与血液肿瘤的研究脚步逐渐放缓,其原因主要有三。一是外泌体“表型”界定问题:尽管外泌体分离、纯化方法多样,但蛋白质种类繁多,某些生物黏液效率低、聚合物无法上下兼容等问题给外泌体分离带来了阻碍,外加鉴定手段及条件受限,更是难上加难;二是外泌体机制问题:如外泌体携带各的种蛋白质和核酸是如何释放和摄取的等微观机制给人以犹抱琵琶半遮面之感,同时关于外泌体-自噬交互通信,MVBs运输中多种媒介物的异质性和同一性等问题也不甚明了,另外如何大量生产外泌体作为药物载体,并提高装载效率也值得思考和研究;三对于外泌体应用问题:白血病细胞中携带大量外泌体,不同种类的外泌体作为口服或瘤内注射尚没有使用次数和剂量标准[47],量-时-效关系十分模糊,以及充当生物标志物还形成详尽的分析以及鲜明的规律。
外泌体的研究领域涉及了中医药学、肿瘤学、微生物学、再生医学等主要学科,诸多学科与外泌体的交叉探索,呈现出百花齐放的外泌体研究领域。“欲穷千里目,更上一层楼”,借此机会笔者寄希望于学术界同仁对于外泌体的研究,如致力于提高外泌体作为纳米级药物载体装载率、利用转基因小鼠实验补充荧光示踪捕捉外泌体路径、外泌体对受体细胞的靶向调控和开发疫苗等方面的研究,为外泌体未来能广泛应用于临床实践提供科学依据和借鉴。

