两种镉积累型小麦根际微生物群落结构及功能多样性
孙乐妮,吴兵兵,徐志豪,李泽龙,张胜全,杨恩东,周佳慧
1 安徽农业大学生命科学学院,合肥 230036 2 北京市农林科学院北京杂交小麦工程技术研究中心,北京 100097
随着工业化的发展,矿山开采、燃煤发电和工业废水排放等大量工业活动,导致土壤重金属污染日益严重,直接或间接地影响了土壤质量[1]。2014年,国家发布的《全国土壤污染状况调查公报》显示,我国土壤总体污染较为严重,主要受到了Cd、Cr、Pb和Cu等重金属污染[2]。重金属镉毒性较大,迁移性强,对于农作物的生长发育有毒害作用,进而通过食物链直接或间接影响人体健康。长期食用含Cd的食物,会导致人体代谢异常,钙及磷元素缺失,危害人体肺和肝等重要器官,影响身体健康。
小麦是世界上最主要的粮食作物之一,在世界农业生产中占据重要地位。农田重金属污染对小麦安全生产已产生潜在危害,一些地区小麦籽粒重金属含量存在超过中国国家食品安全标准(GB2762—2017)现象[3—4]。研究者们发现不同小麦品种耐受重金属及吸收积累重金属能力存在差异[5—8]。利用小麦吸收积累重金属在不同品种间的差异性,筛选用于作物安全生产的低积累型品种,是应对农田重金属污染的解决策略之一[9]。
根际微生物作为土壤-植物生态系统的重要连接载体,不仅参与土壤物质循环、保持土壤肥力,而且对土壤中重金属的迁移、转化以及植物生长发育、对环境的适应性起重要作用。接种根际微生物Streptomycespactum和Pseudomonasaeruginosa能通过活化或钝化土壤重金属,改变重金属的生物有效性,提高或降低小麦对重金属的吸收[10—11]。接种微生物也能调节小麦生理生化特性,改善对不良环境的抗氧化胁迫能力[12—13]。由此可见,小麦根际微生物菌群在提高或阻控小麦吸收重金属、增强环境适应性方面发挥重要作用,有必要加强小麦根际微生物菌群研究,以加深对微生物-小麦相互作用机制的理解。小麦根际微生物群落结构虽已见报道,但相关研究仅限于单一品种或重金属胁迫对单一品种根际微生物的研究[14—16]。随着作物品种在安全生产中重要作用的充分体现,不同积累型作物重金属吸收富集能力、亚细胞分布、根际化学特点比较已见报道[7,17—18],但重金属高低不同积累型小麦根际微生物群落结构与功能研究鲜见报道。本研究采用菌株分离培养技术结合 Biolog微平板技术分析两种不同镉积累型小麦根际微生物群落结构与功能多样性差异,研究结果有利于深入理解镉低积累型小麦根际微生物菌群特征,为在中低污染土壤中利用微生物调控小麦安全生产提供理论指导。
1 材料与方法
1.1 试验材料
重金属Cd污染土壤采自安徽庐江岳山矿区周边农田,非污染土壤采自安徽农业大学农萃园农田。小麦品种为镉高积累型冀 5265(JI5265)和镉低积累型济麦22(JM22)[8]。
LB 培养基:蛋白胨10 g,酵母粉5 g,NaCl10 g,蒸馏水1000 mL,琼脂20 g,pH 7.2。重金属抗性细菌筛选固体培养基:分别配制重金属母液和 LB 培养基,单独灭菌后,取不同量重金属母液加入到 LB 培养基中,得到不同浓度梯度的重金属抗性固体培养基。脲酶培养基[19]:蛋白胨1 g,葡萄糖1 g,氯化钠5 g,磷酸二氢钾2 g,酚红0.012 g,2%尿素,蒸馏水1000 mL,琼脂20 g,pH 7.0。其中,尿素水溶后过滤除菌加入灭菌后的培养基。
1.2 小麦盆栽试验
将土壤风干过筛后分别装入盆中(h18 cm×Φ26 cm),每盆装土3.0 kg。盆栽试验设置4个处理:污染土济麦22(CJM)、污染土冀 5265(CJI)、非污染土济麦22(NJM)和非污染土冀 5265(NJI),每个处理设置3个重复,共12盆。每盆播种12粒小麦种子,各盆随机放置于室外。待小麦长至分蘖期,采收小麦,收集根际1—2 mm范围内的根际土,用于根际土壤微生物分析。
1.3 根际可培养细菌分离及数量测定
取小麦根际土壤各1 g,分别加入到装有99 mL无菌蒸馏水的三角瓶中,放置于28℃摇床内振荡30 min。取样做十倍梯度系列稀释,得到10-2,10-3,10-4,10-5土壤悬液,分别取100 μL稀释液涂布在不含Cd2+和含Cd2+浓度为25 mg/L(CdCl2)的LB固体平板上,置于28℃生化培养箱中培养72 h后对平板上菌落进行计数,并计算每克土壤中具有抗Cd细菌数量和总细菌数量。挑取高稀释度平板上的优势菌落进行多次划线分离纯化,并将菌种保存于-80℃备用。
1.4 菌株16S rDNA序列分析
对分离菌株参照《DNA-EZ Reagents V All-DNA-Fast-Out》试剂盒说明书提取细菌基因组DNA,保存于-80℃冰箱。PCR反应参考文献[20]方法进行。正向引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物为1492R:5′-TACGGCTACCTTGTTACGACTT-3′,以细菌总DNA为模板进行PCR扩增。扩增体系(50 μL):10× buffer 5 μL,25 mM MgCl23 μL,上游引物27F和下游引物1492R各2 μL,2.5 mM dNTP 1 μL,Taq DNA polymerase 1 μL,模板DNA 1 μL,ddH2O补足至50 μL。取2 μL PCR产物于1%琼脂糖凝胶电泳检测。扩增产物送上海生工进行测序。将序列提交NCBI(https://www.ncbi.nlm.nih.gov)进行Blast比对,确定物种信息。序列用 BLAST程序 与 GenBank 数据库中的典型菌株序列进行比对分析,选取相似性较高的典型菌株 16S rDNA 序列,经 Clustal X1.83 进行自动排序比对后,用MEGA7.0 软件 Neighbor-joining 法构建系统发育树。
1.5 根际优势可培养细菌生物学特性
菌株脲酶活性测定:将目标菌株划线接种到脲酶培养基上,28℃培养48 h后观察现象,若菌苔周围培养基变红,则该菌株产脲酶活性为阳性[19]。菌株的镉抗性测定:将菌种接种到不同重金属浓度的固体培养基上(重金属终浓度如下:Cd2+50、100、200 mg/L),28℃培养3—5 d,观察菌株是否能够生长,若能生长,则该菌株对重金属镉有抗性[21]。
1.6 Biolog-Eco 微平板分析
利用Biolog-Eco微平板法评价根际土壤微生物的功能多样性。将10-3根际土壤稀释液接种Biolog-Eco生态测试板,每孔接种150 μL,每个样品三个重复,加盖置于 25℃的培养箱中保湿避光培养8 d,定时用酶标仪读取590 nm吸光值。
Biolog-Eco微平板法测定的每孔平均颜色变化率(average well color development,AWCD)是土壤微生物代谢活性的重要指标。土壤微生物群落功能多样性指数采用Shannon-Wiener 指数(H)、Mc Intosh 指数(U)、Simpson指数(D)和Pielou 指数(J)。
H=-∑PilnPi
J=H/lnS
式中,Pi为第i孔的相对吸光值与整个微平板所有相对吸光值总和的比值(Ci-R)/∑(Ci-R);S为被利用的碳源总数,即Ci-R>0的孔的数目;ni为第i孔的相对吸光值,即(Ci-R);Ci为第i个非对照孔的吸光值;R为对照孔的吸光值;n为培养基碳源种类数31。
1.7 数据处理
数据采用Microsoft Excel Office 2019进行处理并作图;采用SPSS17.0进行数据单因素方差分析,Duncan 检验方法进行数据差异显著性分析(P<0.05 差异显著)。采用Canoco for Windows 5.0软件,利用培养120 h AWCD值对不同土壤中小麦根际微生物碳源代谢多样性进行主成分分析(PCA)。
2 结果与分析
2.1 根际可培养细菌数量
不同小麦品种根际细菌数量如表1所示。污染土壤和非污染土壤中济麦22根际总细菌数量分别是冀5265的6.4倍和1.57倍。污染土中济麦22抗Cd细菌数量最高,为8.25×106cfu/g,占总细菌数的51%。污染土壤中济麦22根际总细菌数量和抗Cd细菌数量均显著高于冀5265(P<0.05),而两者于非污染土壤中无显著差异。对不同土壤而言,污染土中济麦22根际总细菌数量、抗性细菌数量以及抗性细菌比例均显著高于非污染土;污染土中冀5265根际抗性细菌数量以及抗性细菌比例均高于非污染土。镉污染土壤中抗性细菌数量以及抗性细菌比例均明显高于非污染土壤。

表1 不同土壤栽培下小麦根际细菌数量Table 1 The number of rhizosphere bacteria in wheat under different soil cultivation
2.2 根际优势可培养细菌鉴定及生物学特性
采用稀释涂布平板法分离获得小麦根际优势细菌总计34株(表2),经鉴定属于4个菌门、9个属,产脲酶细菌14株,占总细菌数41.2%,镉抗性细菌(200 mg/L)7株,以邻接法构建的系统发育树如图1。研究发现,污染土济麦22的根际细菌鉴定为Actinobacteria 门Arthrobacterspp.(4株)、Pseudarthrobacterspp.(2株)、Paenarthrobactersp.(1株)和Firmicutes门Bacillusaerophilus(1株)、Bacillusmegaterium(1株)和Bacillussp.(1株),其中产脲酶菌株7株,镉抗性细菌5株;污染土冀5265小麦根际细菌为Actinobacteria 门Streptomycesspp.(3株)、Microbacteriummarinum(1株)、Pseudarthrobactersp.(1株)以及Alphaproteobacteria门Agrobacteriumspp.(2株)和Firmicutes门Bacillussp.(1株),其中产脲酶菌株2株,镉抗性细菌2株;非污染土济麦22的根际细菌为Bacillusaerophilus(4株)、Bacillussp.(1株)、Agrobacteriumspp.(2株)、Ensiferadhaerens(1株),产脲酶菌株4株;非污染土冀5265小麦根际细菌为Bacillusaerophilus(4株)、Bacillussp.(1株)、Agrobacteriumspp.(2株)和Pantoeadispersa(1株),产脲酶菌株1株。
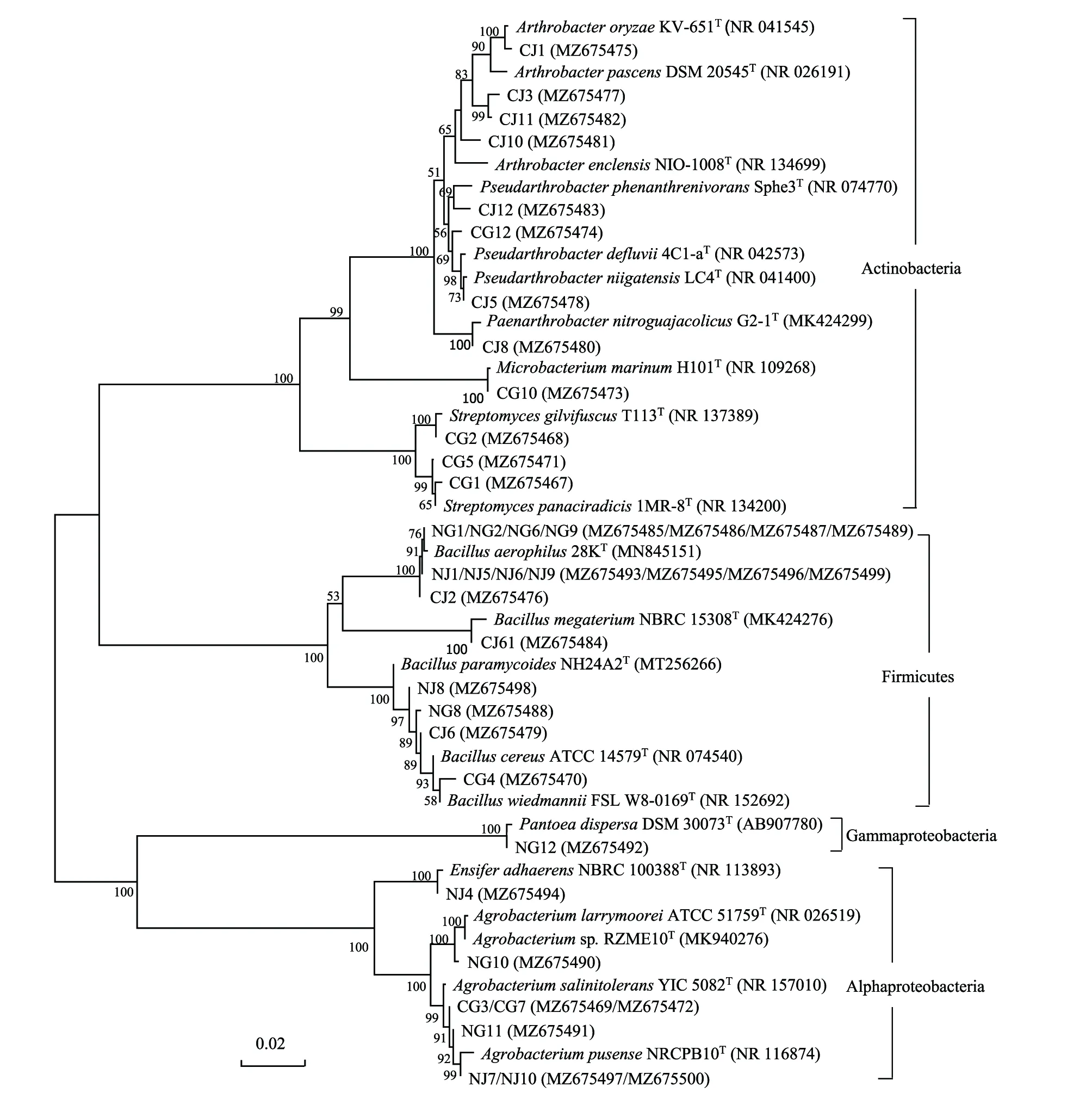
图1 小麦根际细菌16S rRNA 基因系统发育树Fig.1 Neighbor-Joining tree shows the phylogenetic relationships of wheat rhizobacteria based on 16S rRNA gene sequences分支点数字为 Bootstrap 值,代表分类单位被聚在一起的几率;比例尺显示水平线的长度,代表碱基替换数;括号里的内容为GenBank 登录号
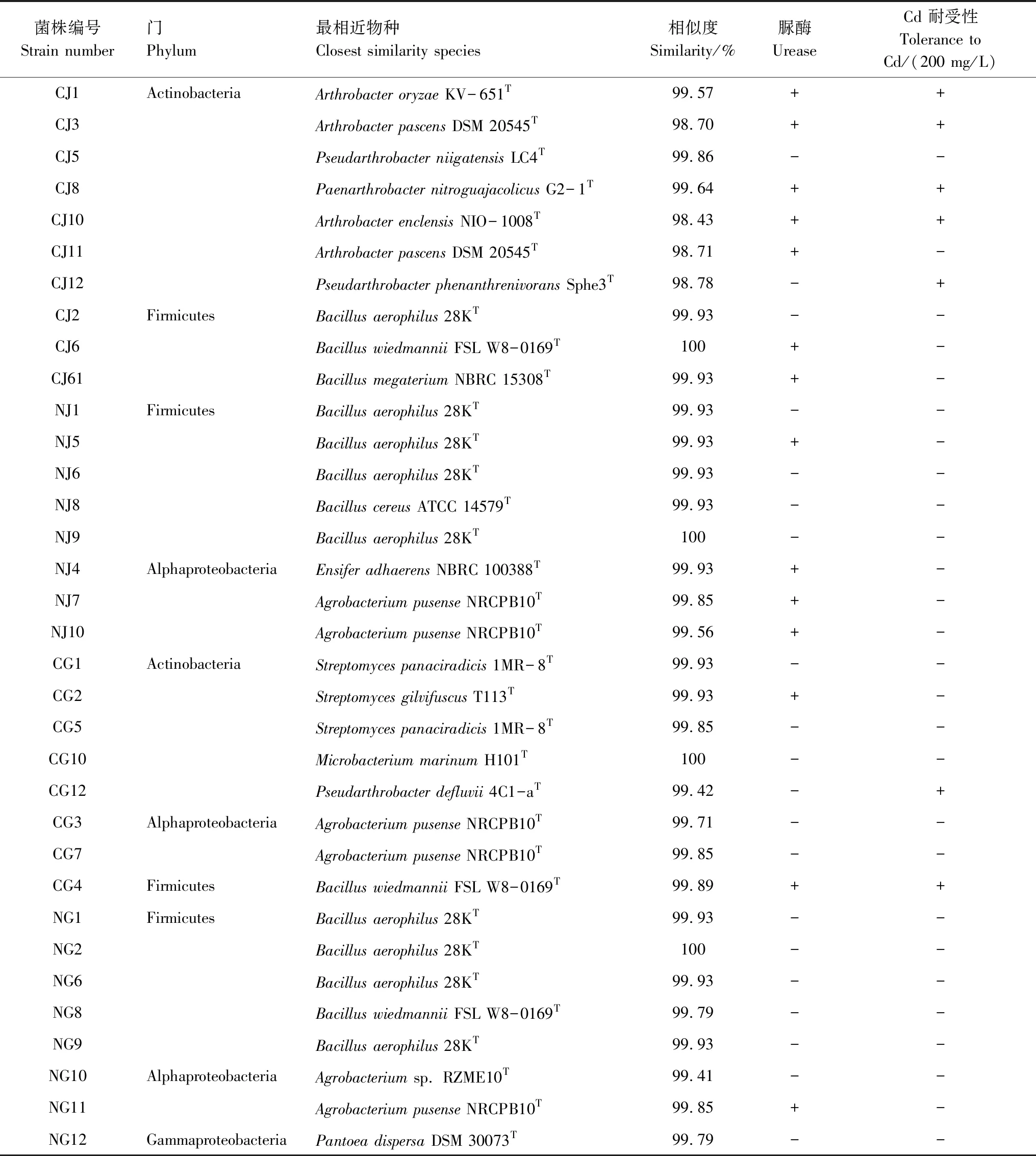
表2 分离菌株的鉴定及生物学特性Table 2 Identification and biological characteristics of isolated strains
小麦根际微生物优势菌存在品种间和土壤间差异。污染土中济麦22根际细菌以放线菌门节杆菌属(Arthrobacter)和厚璧菌门芽孢杆菌属(Bacillus)为主,冀5265根际优势菌以放线菌门链霉菌属(Streptomyces)为主,污染土中两者根际优势菌群差异较大,而非污染土中两者根际优势菌群较相似。污染胁迫使小麦根际优势菌发生变化,但都以放线菌门为主。污染土中济麦、冀麦及非污染土中济麦、冀麦根际细菌产脲酶比例分别为70%、25%、50%、12.5%。济麦根际产脲酶细菌比例高于冀麦,污染土小麦根际产脲酶细菌比例高于非污染土根际。污染土根际细菌中38.9%(7株)菌株耐受200 mg/L Cd,而非污染土根际细菌菌株均不耐受200 mg/L Cd。污染土济麦根际与冀麦根际耐受200 mg/L Cd的菌株分别占50%和25%。根际产脲酶细菌和重金属抗性细菌受小麦品种和土壤污染程度影响。
2.3 小麦根际微生物群落碳源代谢利用能力分析
2.3.1碳源代谢活性动力学分析
平均颜色变化率(AWCD)表示土壤微生物群落对31种碳源的利用能力和代谢活性变化,体现了土壤微生物群落生理功能多样性。由图2可知,不同土壤栽培的小麦根际微生物AWCD值随着培养时间的延长而逐渐升高。24 h之前AWCD值几乎保持不变,表明碳源没有被微生物利用。在24—120 h之间AWCD值增长速率较快,表明碳源被快速利用,微生物代谢活性明显增强。120 h以后增长速率减缓并于144 h后趋于稳定。对于小麦品种济麦22,24 —120 h污染土壤AWCD值高于非污染土壤,而144 h以后非污染土AWCD值高于污染土。济麦22的污染土壤AWCD值与非污染土壤有显著差异(P<0.05),表明同一种小麦,根际微生物组成会受栽培土壤影响。在整个培养过程中,冀5265的污染土与非污染土AWCD值无显著差异,说明这种小麦的两种根际土壤微生物碳源代谢能力几乎相同,几乎不受土壤类型影响。污染土壤和非污染土壤中济麦22 AWCD值均显著大于冀5265,表明济麦22根际微生物对碳源的利用能力大于冀5265,济麦22根际微生物代谢活性更强。
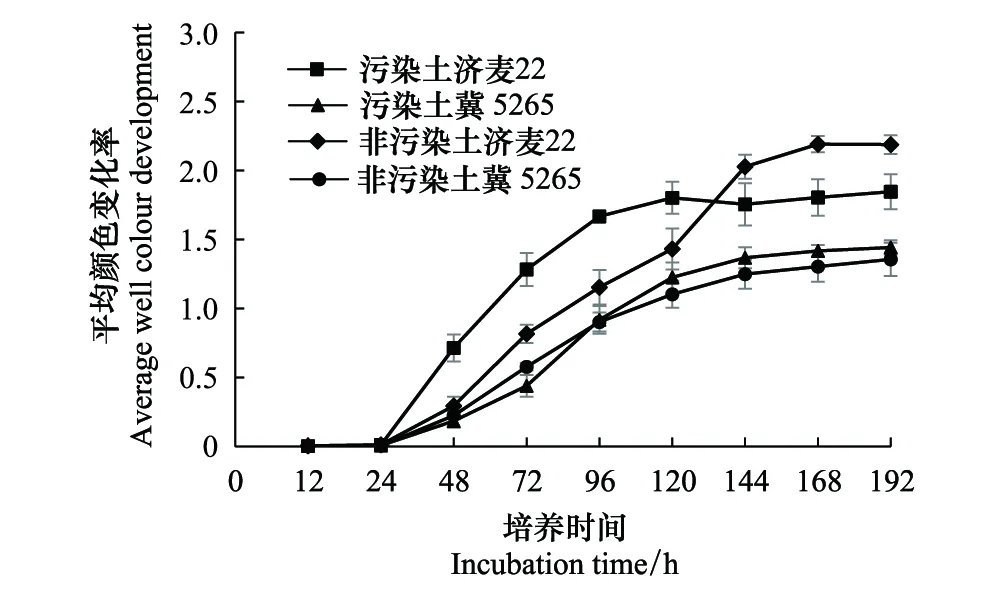
图2 不同土壤栽培下不同小麦根际微生物群落平均颜色变化率AWCD随时间的动态变化Fig.2 Dynamics of AWCD of different wheat rhizosphere microorganisms in different soils
2.3.2碳源类型利用特征
将Biolog-Eco板31种碳源分为6大类,根据120 h 测定的31个孔AWCD值进行碳源利用分析。由图3可知,污染土壤栽培的济麦22根际微生物对碳水化合物类、氨基酸类、羧酸类、多聚物类、酚酸类、胺类6类碳源的利用强度均很高,且都显著高于污染土壤中冀5265(P<0.05),其中,对胺类化合物的利用差异极显著(P<0.001)。非污染土中济麦22仅对羧酸类碳源利用强度显著高于冀5265,而其它碳源间无显著差异,说明非污染土壤中济麦22根际微生物菌群与冀5265较相近。对于济麦22,污染土壤中对各类碳源利用强度均高于非污染土壤,且在氨基酸类、酚酸类、多聚物类和胺类这4大类碳源上存在显著差异(P<0.05)。冀5265在污染土壤中对酚酸类利用强度与非污染土壤存在差异,其他各类碳源利用强度与非污染土壤无差异。同一品种小麦根际微生物对不同碳源的利用程度不同,对碳源利用水平总体上较高的是碳水化合物类、氨基酸类、羧酸类和多聚类。仅污染土壤中济麦22根际微生物对胺类有较高利用,而冀5265对胺类化合物利用基本趋于零。根际微生物对碳源利用能力不同可以反映根际微生物群落结构不同。
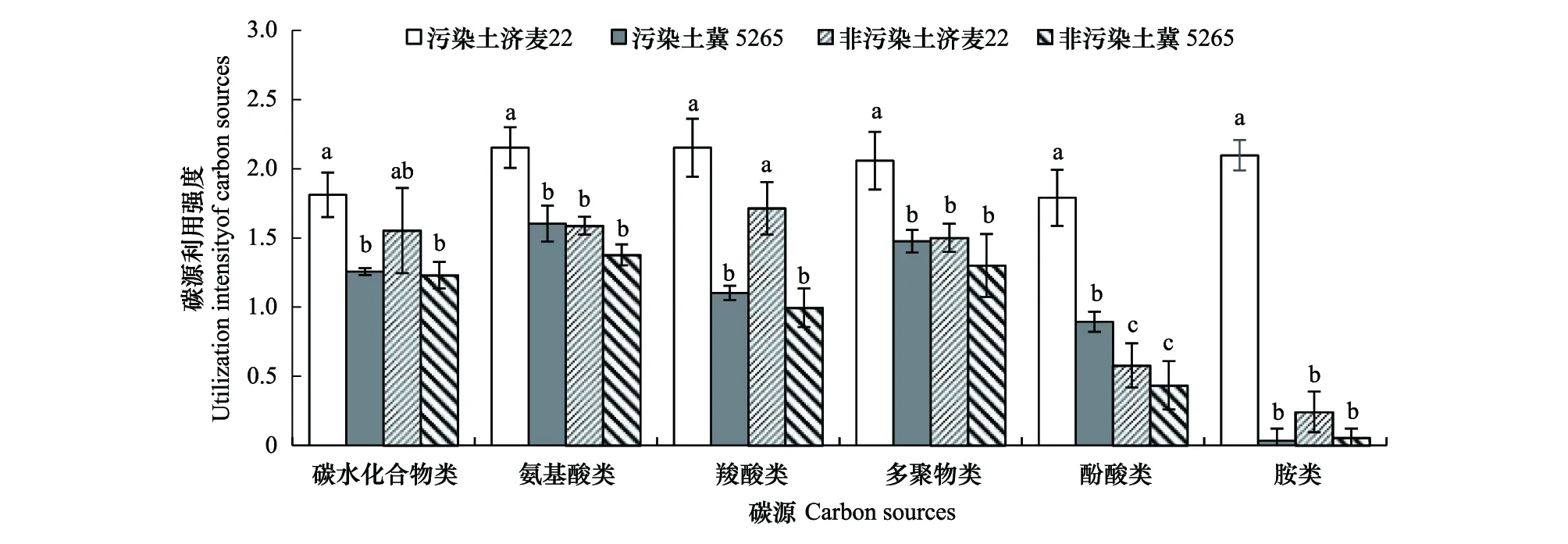
图3 不同土壤栽培下小麦根际微生物对六类碳源利用强度Fig.3 Utilization intensities of six types of carbon sources by wheat rhizosphere microorganisms under different soil cultivation同列不同小写字母表示在0.05水平上差异显著
2.3.3根际微生物群落代谢功能多样性指数
Mc Intosh 指数(U)用于描述基于群落物种多维空间上Euclidian距离的多样性指数,Simpson指数(D)用于评估某些常见物种的优势度,Shannon-Wiener 指数(H)和Pielou指数(J)分别用于评估微生物群落的物种丰富度和物种均匀度。由表3可知,在两种土壤中济麦22的根际微生物Mc Intosh 指数、Shannon-Wiener 指数、Simpson指数均显著高于冀5265(P<0.05),表明小麦根际微生物物种丰富度和优势度受到不同积累型小麦品种影响。济麦22的Mc Intosh 指数、Shannon-Wiener 指数、Simpson指数均表现为污染土壤明显高于非污染土壤,而冀5265则无显著差异。Pielou指数在各处理间无显著差异,说明不同积累型小麦根际微生物均一性相似。冀5265根际微生物的Mc Intosh 指数(U)、Shannon-Wiener 指数(H)、Simpson指数(D)、Pielou指数(J)均为最小,表明非污染土壤栽培的冀5265根际微生物均匀度和丰富度最小。
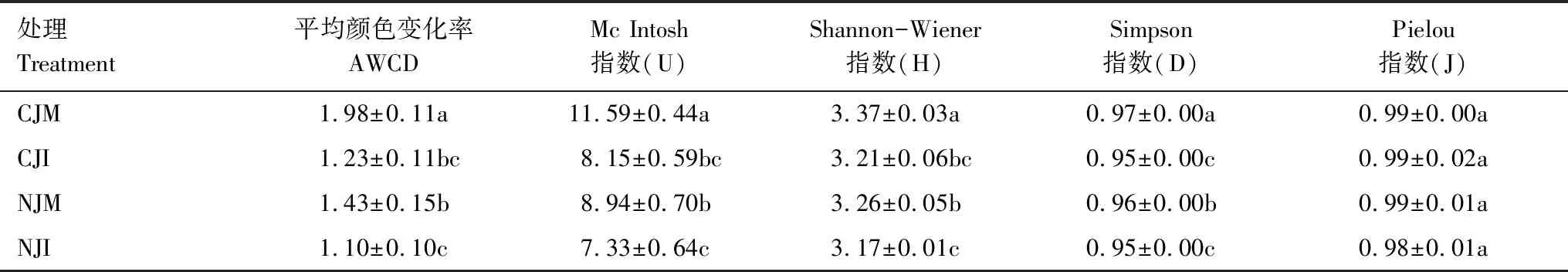
表3 不同土壤栽培下不同小麦根际微生物120 h AWCD和多样性指数Table 3 120 h AWCD and diversity index of wheat rhizosphere microorganism under different soil cultivation
2.4 根际微生物碳源利用主成分分析
为了进一步明确不同小麦根际微生物群落功能和结构的差异,研究选取120 h各处理根际微生物对31种碳源的AWCD数据进行主成分分析。由图4可知,第一主成分(PC1)贡献率为37.85%,第二主成分(PC2)贡献率为15.53%。四组处理中,CJI和NJI点阵主要集中于一三侧象限,CJM和NJM点阵主要分布于右侧象限,表明小麦品种明显影响菌群结构。NJM和NJI点阵主要集中于第一象限,相距较近,表明在非污染土中济麦22与冀5265菌群碳源代谢相似、菌群较相近;污染土壤中CJM与CJI分别偏离NJM和NJI点阵,表明污染土壤两种小麦根际微生物菌群与非污染相比均发生变化。
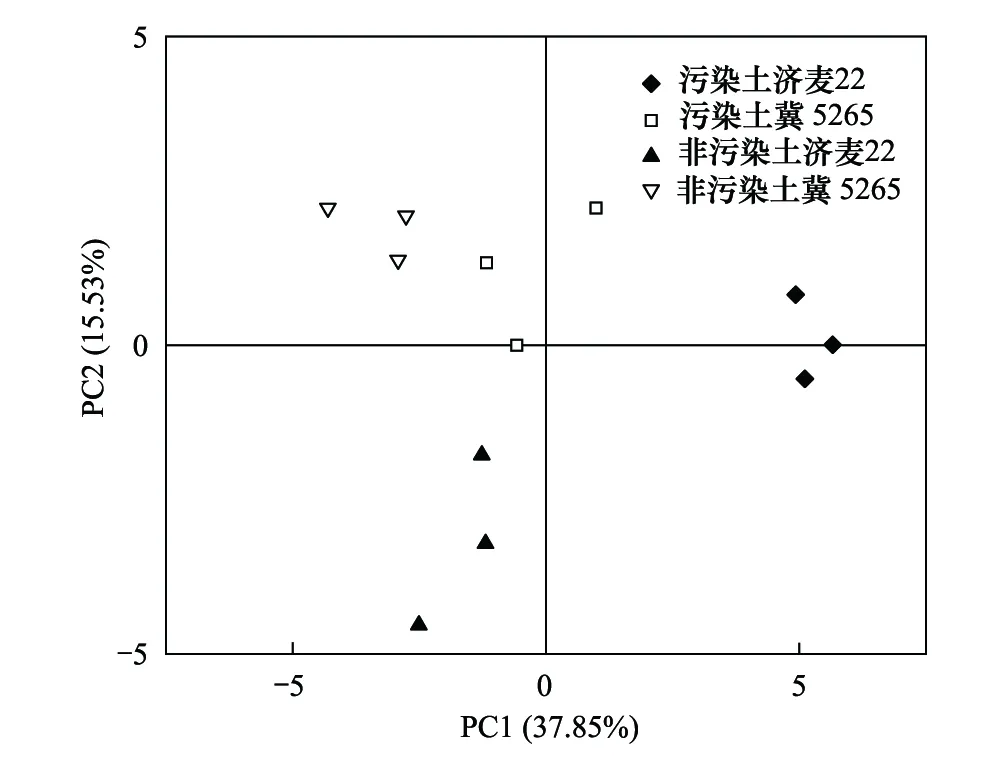
图4 基于小麦根际微生物碳源利用的主成分分析 Fig.4 Principal components analysis (PCA) based on carbon source utilization of rhizosphere microorganism in wheat
3 讨论
土壤微生物是土壤生态系统中物质转化的重要驱动力,对植物生长发育具有重要作用。重金属污染对根际微生物的影响是复杂的,它会打破植物根际原有的微生物物种生态平衡,一方面会使不适应重金属的物种数量减少,另一方面会使适应生长的微生物种类数量增多[22—23]。本研究发现污染土壤中低积累型济麦22根际总细菌数量、抗Cd细菌数量显著高于非污染土壤济麦22和污染土壤高积累型冀5265,同时济麦22 的AWCD值高于冀5265,这表明污染土壤中低积累型小麦根际细菌数量多、代谢活性更强,重金属污染刺激了济麦22根际细菌数量增长。产生这一结果的原因可能是,一方面重金属对根际微生物物种的选择性刺激或抑制作用,另一方面高低不同积累型小麦根系分泌物种类和数量存在差异[18],导致了明显不同的根际效应。低积累型济麦22根际微生物的转变可能更有利于该小麦适应重金属污染环境。龚玉莲等[24]研究发现高低镉积累蕹菜根际微生物群落结构和功能差异显著,低积累型蕹菜QLQ根际微生物群落代谢活性明显高于高积累型蕹菜T308,这与本研究结果相一致,但其根际细菌数量却低于高积累型蕹菜。本研究关于细菌数量结果与蕹菜不完全一致,这可能是由于不同植物种类根际效应不同,对重金属的吸收、耐受性以及对根际化学环境的敏感程度不同。
根际微生物菌群多样性指数也表现出济麦22明显高于冀5265,表明低积累型小麦根际微生物群落在物种丰富度和优势度上存在明显优势。16S rDNA序列分析表明,污染土壤中两种小麦品种根际优势细菌群落组成也存在较多品种间差异。这些结果均表明两种不同积累型小麦品种根际微生物菌群多样性和组成存在差异,这与Zhu等[25]利用磷脂脂肪酸技术分析发现7种杂交水稻品种根际特异性微生物群落存在差异结果相一致。同一土壤中高低积累型小麦根际微生物代谢活性、多样性、组成及数量等差异可能与植物根系分泌物有关[26]。根系分泌物为微生物生长提供重要的营养来源,对根际定殖微生物种类具有选择作用。不同生态型植物及重金属胁迫使根系分泌物组成和数量会存在差异[27—28],这种差异会吸引不同的根际微生物聚集于植物根际[29-31]。根系分泌物-微生物-重金属三者间存在复杂的相互作用关系。
通过对可培养优势菌群16S rDNA序列分析,发现污染土壤中济麦22与冀5265根际优势菌物种差异较大,主要表现为济麦22以放线菌门的Arthrobacter和厚璧菌门Bacillus为主,冀5265根际优势菌以放线菌门Streptomyces为主,但非污染土壤中二者差异较小。根际微生物对植物根际环境变化较为敏感,在特定的胁迫环境中植物会招募能够缓解植物自身胁迫压力的特定微生物种群聚集于根际[32—33]。本研究发现在遭受重金属胁迫后两种小麦根际优势菌群分别发生改变,但都以放线菌门为主,这与邵宗圆等[34]研究相一致。Arthrobactersp.能吸附重金属,减少环境中重金属生物有效性[35]。Bacillussp.能提高小麦抗氧化防御系统,减轻重金属胁迫产生的氧化损伤[36],并能减少植物对重金属的吸收积累[37]。Ali 等[10]发现接种Streptomycessp.能增强小麦对重金属的吸收积累。Arthrobacter[38—39],Bacillus[40—41],Streptomyces[42]等菌都是重金属污染土壤及耐性植物根际的优势菌群,这些细菌对调节植物耐受重金属及吸收积累重金属具有重要作用。Bacillus和Streptomyces分别能通过产生内生芽孢和孢子增强对外界不良环境的耐受性。本研究中重金属胁迫使两种小麦分别招募这些特定的微生物类群,可能对帮助其应对重金属胁迫具有重要作用。

3结论
(1)土壤污染胁迫促使不同积累型小麦根际抗性细菌数量及所占比例提高,低积累型济麦22根际抗性细菌数量高于高积累型冀5265。
(2)土壤污染胁迫使小麦根际优势菌群发生改变,济麦22根际优势菌以Arthrobactersp.和Bacillussp.为主,冀5265以Streptomycessp.为主,而非污染土中两者根际优势菌群较相似。
(3)低积累型小麦在污染土壤胁迫下根际会聚集大量产脲酶细菌和重金属抗性细菌,可能与小麦低量吸收积累重金属及其耐受性有关。
(4)两种不同积累型小麦品种的根际微生物群落功能多样性存在显著差异,低积累型小麦的根际微生物代谢活性较强。

