双氢青蒿素对铜绿假单胞菌感染的角膜上皮细胞的清除作用与机制
汪孝军,喻福娟,阿 智,肖崇雅
(阿坝藏族羌族自治州人民医院眼科,四川 阿坝藏族羌族自治州,624000)
角膜炎是导致发展中国家患者失明的主要原因之一[1]。铜绿假单胞菌(P.aeruginosa)是角膜炎的一种主要革兰氏阴性致病菌,其发病迅速并可导致严重的视力损害[1-2]。铜绿假单胞菌能侵入多种哺乳动物细胞内进行复制[3-6]。有研究[4]显示,在实验性铜绿假单胞菌感染角膜炎动物模型中,即使眼内已无细菌生长,但眼内仍存在炎症反应,提示已灭活或崩解的细菌及其成分也存在一定的致炎作用。双氢青蒿素(Dihydroartemisinin,DHA)已被广泛地应用于葡萄膜炎的治疗研究[7],目前已被证实可以促进癌细胞的自噬[8],而细胞自噬在清除病原体中起着重要作用[9]。因此,本研究旨在探讨DHA能否通过诱导细胞自噬促进铜绿假单胞菌的清除,最终用于铜绿假单胞菌角膜炎的治疗。
1 材料和方法
1.1 实验动物
选用50只6~8周龄(20~24 g)雌性SPF级野生型C57BL6J小鼠[北京维通利华实验动物技术有限公司,实验动物许可证:SCXK(京)2019-0009],动物治疗符合ARVO在眼科和视力研究中使用动物声明和《实验动物护理和使用指南》,所有程序都经过动物保护和使用委员会的批准。
1.2 主要材料及仪器
人角膜上皮细胞系HCEC和CP-H128(武汉普诺赛生命科技有限公司);人角膜上皮细胞完全培养基(CM-H128,武汉普诺赛生命科技有限公司);铜绿假单胞菌(分离自本院收治的铜绿假单胞菌角膜炎患者的角膜刮片样本,根据角膜刮片形态学、生长特征和16s rDNA序列分析鉴定为铜绿假单胞菌,保存在-80 ℃);LB培养基(北京索莱宝科技有限公司);氯喹(CQ)、雷帕霉素、3-甲基腺嘌呤(3-MA,美国Sigma公司)。抗体:微管相关蛋白1轻链3(LC3)、P62、核因子kappaB(NF-κB)、NF-κB抑制因子α(IκBα)、p-IκBα、Lamin B、β-actin抗体(英国Abcam公司);羊抗兔HRP二抗(美国Invitrogen公司);TRIzol(美国Life Technologies公司)。Zeiss Axio Scope A1型荧光显微镜(德国Zeiss公司);7500型实时荧光定量PCR系统(美国Applied Biosystems公司)。
1.3 菌液的制备
采集细菌菌落,在37 ℃的胰蛋白酶大豆肉汤(TSB)中不断摇动培养过夜。次日,将20 μL含有铜绿假单胞菌的TSB转移到4 mL新鲜培养基中,在OD 600 nm<1的条件下培养4 h。测定TSB细菌浓度后,将细菌洗涤复苏,然后感染小鼠角膜或置于沸水浴中5 min,产生热灭活铜绿假单胞菌,用不含生长因子和抗生素的基本培养基培养。
1.4 细胞处理和分组
将融合培养的HCEC细胞在CM-H128培养基中饥饿过夜,随后,用热灭活铜绿假单胞菌(MOI=1:100)感染达到指定时间(0.5、1、2、3、4、5 h)。将铜绿假单胞菌感染5 h后的HCEC细胞分为空白组、CQ组(5 μmol·L-1CQ预处理30 min,加入生理盐水培养24 h)、不同浓度DHA组(生理盐水预处理30 min,分别加入10、20、40 μmol·L-1DHA培养24 h)、DHA+CQ组(5 μmol·L-1CQ预处理30 min,加入40 μmol·L-1DHA培养24 h),观察DHA诱导HECE细胞自噬的剂量-反应曲线及DHA对HCEC细胞自噬的影响。
1.5 Western Blot法检测细胞自噬相关蛋白表达
收集HCEC细胞(1×107个),使用RIPA裂解缓冲液提取总蛋白,离心获取上清,用BC法检测蛋白浓度。每个样本取40 μg总蛋白,进行体积分数10% SDS-PAGE电泳,随后电转移至硝化纤维素膜上。用含体积分数5%脱脂牛奶的BSA封闭液封闭4 h,随后使用TBST清洗5 min×3次,最后将膜与一抗4 ℃孵育过夜。次日,与辣根过氧化物酶结合的山羊抗兔IgG共孵育2 h。用ECL发光液进行蛋白条带可视化。
1.6 免疫荧光法分析细胞LC3表达
HCEC细胞(1×105mL-1)感染铜绿假单胞菌1 h后,用体积分数4% PFA固定,体积分数0.3% Triton X-100通透,体积分数5% BSA封闭。用兔抗LC3B抗体孵育1 h,然后用Alexa Fluor®488荧光抗兔IgG孵育。使用Dako荧光封片剂将盖玻片封固在显微镜载玻片上。置于荧光显微镜下观察。定量检测每个样品中LC3阳性细胞数并计算阳性细胞占总细胞数的比例,每个样品至少计数100个细胞。
1.7 分离细胞核与细胞质
收集HCEC细胞(1×107个),用预冷的PBS洗涤2次并重悬于500 mL缓冲液A(含有10 mmol·L-1HEPES,pH=7.9、1.5 mmol·L-1MgCl2、10 mmol·L-1KCl、0.5 mmol·L-1DTT、0.5 mmol·L-1PMSF、1 mg·mL-1亮抑酶肽、1 mg·mL-1抑肽酶和1 mg·mL-1胃酶抑素A)中。使细胞在冰上孵育15 min,然后用12.5 mL体积分数10% Nonidet P-40温和裂解,并在4 ℃下以2000 r·min-1离心10 min。收集上清液并用作细胞质提取物。将沉淀物(含有核)重新悬浮在40 mL缓冲液C(20 mmol·L-1HEPES,pH=7.9、1.5 mmol·L-1MgCl2、450 mmol·L-1NaCl、体积分数25%甘油、0.2 mmol·L-1EDTA、0.5 mmol·L-1DTT、0.5 mmol·L-1PMSF、1 mg·mL-1亮抑酶肽、1 mg·mL-1抑肽酶和1 mg·mL-1胃酶抑素A)中,在4 ℃搅拌30 min,核碎片以2000 r·min-1离心15 min。上清液即为核提取物。将胞核和胞质样本分别进行Western Blot法检测NF-κB蛋白和LC3蛋白表达,分组与处理方法同“1.4”。
1.8 实验动物分组及处理
根据体重和随机数字表法将C57BL6J小鼠分为6组:假手术组、模型组、CQ组、雷帕霉素组、3-MA组、DHA组,除模型组(n=25)外,其余各组均5只。腹腔注射0.3 mL戊巴比妥钠(体积分数0.06%)进行全身麻醉,随后使用盐酸丙美卡因滴眼液(苏州天龙制药有限公司,批号:20190104,规格:每支10 mL)进行角膜局部麻醉。使用1 mL注射器针头,在显微镜下将小鼠角膜上皮划3条1 mm损伤。随后将小鼠平放置鼠笼,除假手术组外,其余5组小鼠在眼表滴加10 μL铜绿假单胞菌菌液(107个·mL-1,悬浮于生理盐水)。于处理后24 h用手持裂隙灯观察,如果血管充血、角膜混浊或者积脓即为造模成功。CQ组、雷帕霉素组、3-MA组、DHA组分别于术前1 d起每日用CQ(30 μmol·L-1)、雷帕霉素(3 μmol·L-1)、3-MA(3 mmol·L-1)、DHA(40 μmol·L-1)每日点眼6次。假手术组和模型组用等体积生理盐水代替。
1.9 角膜组织铜绿假单胞菌载菌量检测
24 h后,使用断颈法处死小鼠,将小鼠眼球取下,并在体式显微镜下沿角巩膜缘将角膜剪下。使用含有TissueLyser的生理盐水(100 μL)清洗剪下的小鼠角膜后,将角膜放入盛有1 mL胰蛋白酶工作液的离心管中,使用眼科剪在管中持续剪切10 min。将原液分别稀释10、100、103、104、105、106、107倍,取每种浓度梯度的菌液10 μL,涂布于LB培养皿中(每个浓度梯度设置3组重复),置于37 ℃培养箱进行培养。次日计数形成的菌落数,依据稀释梯度计数角膜载菌量,以菌落形成单位(CFU)表示。
1.10 统计学方法

2 结果
2.1 铜绿假单胞菌处理HCEC细胞后细胞自噬活性变化
将热灭活铜绿假单胞菌(MOI=1:100)感染HCEC细胞不同时间后,经Western Blot法检测自噬标记物 LC3蛋白。结果显示在感染后1 h即可观测到LC3蛋白表达显著增加[(0.83±0.09)比(0.50±0.07),P<0.05],随着感染时间的延长,LC3II/LC3I蛋白比值逐渐增加(2 h:0.87±0.12;3 h:0.90±0.09;4 h:1.09±0.14;5 h:1.34±0.15,P<0.05,见图1A)。此外,以雷帕霉素(10 nmol·L-1)处理后5 h的HCEC细胞作为阳性对照,经免疫荧光结果显示,HCEC与铜绿假单胞菌共培养(MOI=1:100)5 h后,细胞内LC3表达显著增加(图1B)。因此选择铜绿假单胞菌作用5 h用于后续细胞实验。
2.2 DHA诱导HCEC细胞中自噬相关蛋白表达
经Western Blot法检测,随着DHA作用浓度(10、20、40 μmol·L-1)的增加,LC3B-II/LC3B-I蛋白表达比值逐渐升高(空白组:0.01±0.00;DHA 10 μmol·L-1:0.12±0.02;DHA 20 μmol·L-1:0.30±0.06;DHA 40 μmol·L-1:0.58±0.10),同时P62蛋白表达水平逐渐降低(空白组:0.89±0.10;DHA 10 μmol·L-1:0.77±0.12;DHA 20 μmol·L-1:0.50±0.06;DHA 40 μmol·L-1:0.18±0.04),与空白组比较,差异有统计学意义(P<0.05,见图2A)。此外,与空白组(0.01±0.00)相比,DHA组LC3B-II/LC3B-I蛋白表达比值(0.60±0.05)显著升高,CQ组LC3B-II/LC3B-I蛋白表达比值(0.26±0.04)显著降低(P<0.05),而DHA+CQ共同处理导致LC3B-II/LC3B-I蛋白表达比值(0.50±0.02)显著低于DHA组(P<0.05),说明DHA 诱导的自噬是功能性的,而不是阻断自噬通量而导致的LC3堆积,见图2B。
2.3 DHA通过抑制NF-κB活性促进HCEC细胞自噬
随着DHA作用浓度(10、20、40 μmol·L-1)的增加,导致总蛋白中IκBα蛋白表达量以剂量依赖性方式显著增加(空白组:0.33±0.03;DHA 10 μmol·L-1:0.15±0.03;DHA 20 μmol·L-1:0.36±0.04;DHA 40 μmol·L-1:0.88±0.07,P<0.05),而p-IκBα蛋白表达量则显著降低(空白组:0.95±0.08;DHA 10 μmol·L-1:0.40±0.02;DHA 20 μmol·L-1:0.27±0.02;DHA 40 μmol·L-1:0.08±0.01,P<0.05,见图3A)。NF-κB激活需要RelA/p65亚基转位到细胞核中,因此本研究采用Western Blot法检测了DHA对胞质和胞核中RelA/p65分布的影响。结果表明,DHA处理有效地上调了细胞质RelA/p65蛋白表达水平(空白组:0.22±0.01;DHA 10 μmol·L-1:0.30±0.03;DHA 20 μmol·L-1:0.47±0.05;DHA 40 μmol·L-1:0.69±0.06,P<0.05)并下调核RelA/p65蛋白表达水平(空白组:4.02±0.17;DHA 10 μmol·L-1:0.37±0.05;DHA 20 μmol·L-1:0.40±0.07;DHA 40 μmol·L-1:0.32±0.07,P<0.05,见图3B)。然而在总细胞提取物中并没有检测到总RelA/p65蛋白水平的变化(空白组:1.80±0.22;DHA 10 μmol·L-1:1.78±0.25;DHA 20 μmol·L-1:1.69±0.22;DHA 40 μmol·L-1:1.65±0.18,P>0.05,见图3A),这表明DHA阻止了RelA/p65入核,而不是抑制RelA/p65蛋白合成。此外,为进一步证实DHA通过抑制NF-κB活性以促进HCEC细胞自噬,本研究用TNF-α(100 ng·mL-1)对HCEC细胞进行预处理。结果显示,DHA(40 μmol·L-1)处理可显著诱导HCEC细胞中LC3转化,LC3B-II/LC3-I蛋白比值较空白组显著增加(0.92±0.08比0.17±0.01,P<0.05);而在DHA和TNF-α共同处理后,HCEC中LC3B-II/LC3-I蛋白比值则低于DHA组(0.40±0.05比0.92±0.08,P<0.05,见图3C)。表明激活NF-κB可抑制DHA对角膜上皮细胞的自噬促进作用。
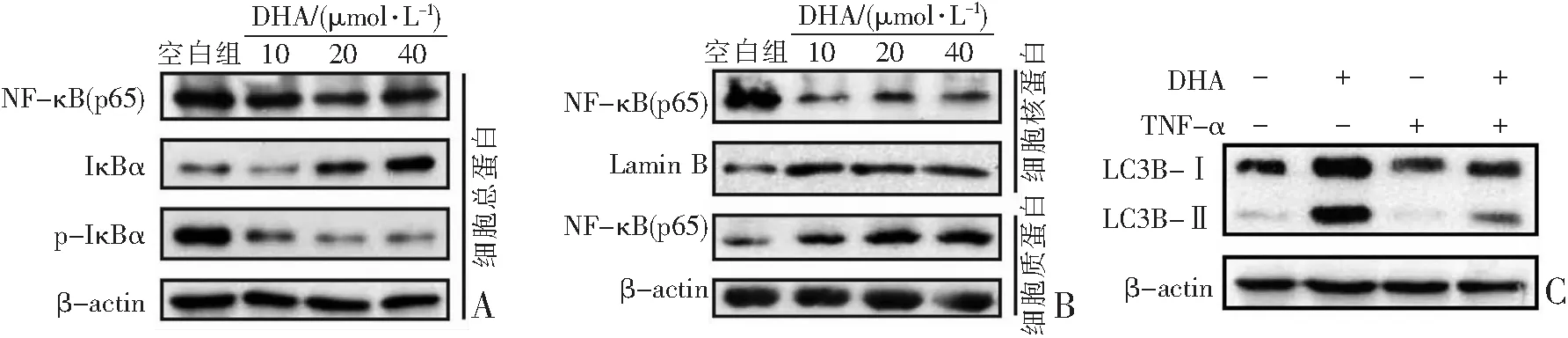
A:总蛋白样本中NF-κB(p65)蛋白、IκBα蛋白、p-IκBα(Ser32/36)蛋白表达;B:胞核和胞质蛋白样本NF-κB(p65)蛋白表达;C:总蛋白样本中LC3蛋白表达。
2.4 各组小鼠角膜组织铜绿假单胞菌载菌量比较
在建模24 h后,检测各组小鼠的角膜载菌量。结果显示,与假手术组(0.75×106CFU)相比,CQ组和3-MA组小鼠角膜载菌量分别增加至(1.05±0.12)×106CFU和(0.98±0.12)×106CFU(P<0.05);而雷帕霉素组和DHA组小鼠角膜载菌量分别为(0.78±0.09)×106CFU和(0.74±0.10)×106CFU,与假手术组相比,差异无统计学意义(P>0.05,见图4)。
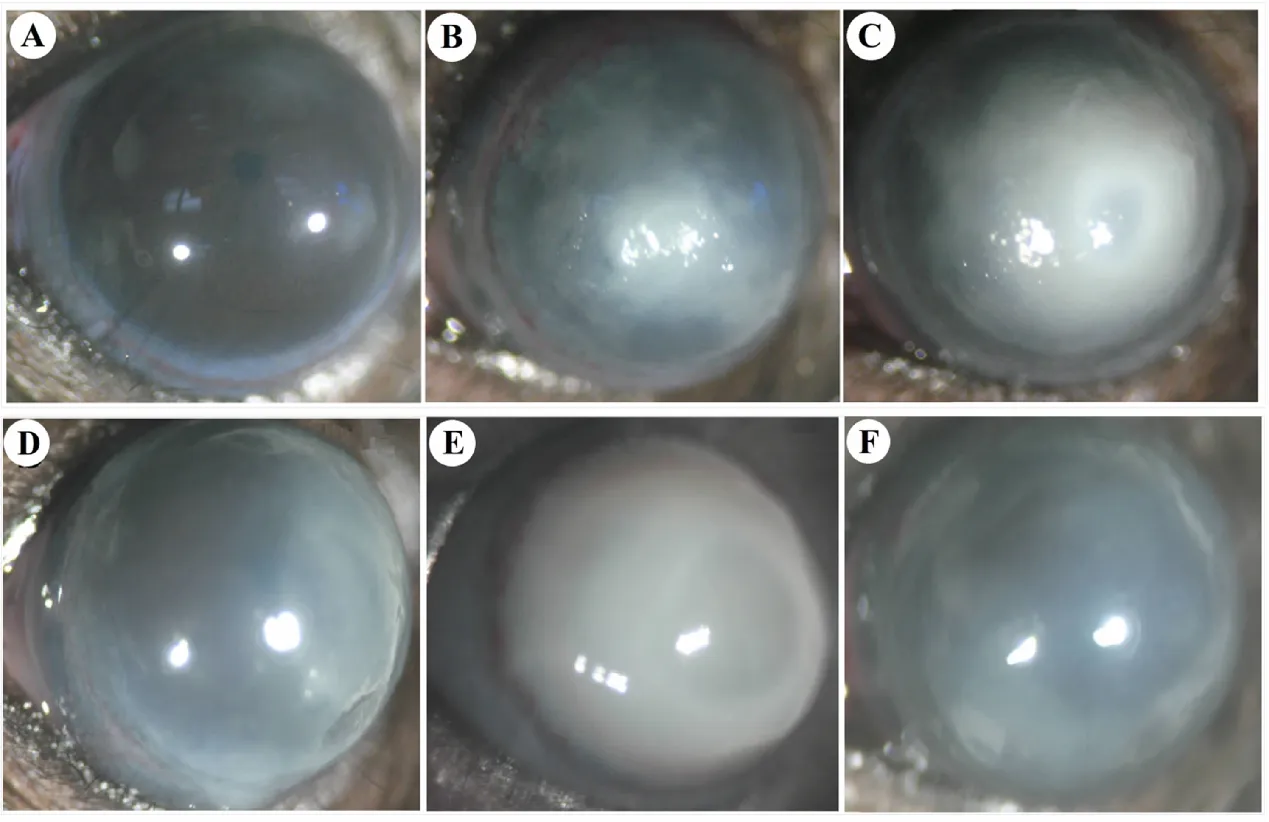
A:假手术组;B:模型组;C:CQ组;D:雷帕霉素组;E:3-MA组;F:DHA组。图4 各组小鼠角膜组织铜绿假单胞菌载菌量比较
3 讨论
目前,临床上针对铜绿假单胞菌角膜炎的治疗通常为经验性治疗,主要依赖广谱抗生素,但其治疗效果往往差强人意[10]。目前,青蒿素及其相关衍生物在眼科的应用受到了日益增加的关注[7,11]。本研究旨在探讨DHA在保护角膜免受铜绿假单胞菌感染中的作用,结果显示DHA可以显著降低铜绿假单胞菌角膜炎小鼠的角膜载菌量,同时体外HCEC细胞实验也证实,DHA能够增加热灭活铜绿假单胞菌感染的角膜上皮细胞的总体自噬水平。说明DHA对于人角膜上皮细胞有一定的抗铜绿假单胞菌感染作用。
无血管的角膜组织具有2种特殊功能,即形成保护性屏障和作为视觉系统的主要屈光元件[3,6]。在正常情况下,角膜对感染有明显的抵抗力。然而,当上皮屏障被突破(通常发生在配戴隐形眼镜期间)或免疫功能受损(如糖尿病患者)时,机会致病菌(如铜绿假单胞菌)便会进入复层上皮,最终侵入基质,引致感染性角膜炎,导致角膜浑浊。铜绿假单胞菌是引起细菌性角膜炎的革兰氏阴性致病菌,特别是在长时间接触镜片的隐形眼镜使用者中十分常见,如果没有得到及时和适当的治疗,可能会导致严重的视力下降甚至失明。铜绿假单胞菌已被证明可在多种细胞内侵袭和复制,并合成多种有害外毒素。其中,外毒素S和T是具有腺苷二磷酸核糖基转移酶(ADPRT)和谷胱甘肽酶激活蛋白活性的双功能毒素;外毒素U是一种磷脂酶,能使宿主细胞迅速溶解;而外毒素Y是一种分泌型腺苷酸环化酶;Ⅲ型蛋白分泌与急性肺部感染等疾病死亡率有关。有研究[10]证实,在角膜炎中,外毒素S、T的ADPRT活性能够介导对宿主免疫反应的破坏,以促进细菌的生存和角膜疾病的发展。自噬是一种正常的细胞分解代谢过程,特点是细胞内形成被称为自噬体的双膜细胞器,自噬体吞噬细胞质成分在与溶酶体融合后被降解。自噬过程在清除细胞内病原体中起主要作用[10,12]。然而,一些病原体会设法逃避自噬降解,甚至利用自噬过程为自身的复制提供帮助[13]。因此,自噬的最终效果往往对感染性疾病的预后具有重要的影响。铜绿假单胞菌已被证明可激活肺泡巨噬细胞和肥大细胞中的自噬[14-15]。近些年也有研究[2]证实,铜绿假单胞菌可以激活角膜上皮细胞的自噬。本试验证明了角膜上皮细胞自噬对抵抗铜绿假单胞菌感染可以起到帮助作用,同时也发现DHA降低角膜载菌量的效果优于雷帕霉素。考虑到人类使用青蒿素这一中药及其衍生物已有很长时间,其生物安全性已得到了充分的证实,因此DHA有望作为治疗铜绿假单胞菌角膜炎的辅助用药。
NF-κB被广泛认为是肿瘤生长的调节剂,因为它具有抑制细胞程序性死亡途径的功能,可以降低肿瘤细胞对凋亡敏感性,促进细胞生长[16-17]。NF-κB抗细胞凋亡功能所涉及机制的研究表明,它的激活可以保护细胞免受TNF-α和其他刺激物诱导的细胞凋亡级联反应[18]。此外,角膜上皮细胞中一些抗凋亡基因,包括Bcl-2家族成员,已被证明可被NF-κB激活以及其他证据亦表明NF-κB还对p53的功能具有拮抗作用[19]。因此,NF-κB常被用作新型预防和治疗疾病的靶点。而JEOK等[20]也证实铜绿假单胞菌基因DNAK可通过TLR4依赖的NF-κB信号通路刺激Pentraxin 3蛋白的产生,进而触发宿主的免疫防御反应。WANG等[21]的研究表明,在人皮肤鳞状细胞癌细胞中DHA可以通过抑制NF-κB以促进自噬。于是笔者提出假说:DHA通过抑制NF-κB以促进HCEC细胞自噬,最终提升HCEC细胞对铜绿假单胞菌的清除能力。
本研究证明了DHA通过提升角膜上皮细胞自噬活性,促进其对铜绿假单胞菌的清除作用;此外也进一步揭示了DHA通过抑制RelA/p65核易位以及IκBα磷酸化和降解,导致NF-κB失活,进而增强HCEC细胞的自噬活性,这可能是DHA促进人角膜上皮细胞中铜绿假单胞菌清除的作用机制之一。以自噬为基础的辅助疗法有希望成为治疗感染性角膜炎的方案之一,而本研究为DHA应用于铜绿假单胞菌角膜炎的治疗提供了理论基础。然而该结论尚需要进行体内研究以阐明DHA的安全性和有效性。

