小分子靶向抗肿瘤药物的临床应用与注意事项
李莉霞 刘艳 顾芬芬 陈霁晖 王冉冉 陈伦 金磊 张健


通信作者:张健,教授,主任药师,博士生导师。上海交通大学医学院附属新华医院临床药学部主任,上海交通大学医学院临床药学创新研究院院长。现任中华医学会临床药学专科分会常委、国家卫健委合理用药专家委员会临床药学组副组长、国家卫健委儿童用药专家委员会委员、中国药品监督管理研究会药品使用监管研究专委会副主委、中国医学装备协会理事、中国医学装备协会药学装备分会副会长,上海市医学会临床药学专科分会主任委员、上海市药学会医院药学专委会副主任委员、中华医学会/上海市医学会医疗事故鉴定专家;重庆医科大学、上海中医药大学客座教授;《中国药房》杂志主编、上海采编中心主任;《中国临床药学杂志》、《药学服务与研究》、《中国药业》杂志副主编;IJCP杂志、AJHP杂志编委等学术职务。获得第四届“国之名医·优秀风范"称号。多次获得上海市医学、药学科技奖。研究方向为老年常见病多重用药风险管控及药物精准治疗,中药作用机制研究及平台建设等。主持国家科技部重点研发计划主动健康和老龄化科技应对重点专项、上海市科委等各类课题20余项,发表SCI、统计源期刊近百篇,编写专著20余部。
摘要:小分子靶向抗肿瘤药物在临床上得到广泛应用,并取得了一定的疗效,但在使用过程中出现了不同程度毒副反应。降低用药风险、提高患者用药依从性、保证临床疗效,是医务人员关心的问题。本文归纳不同作用靶点的小分子靶向抗肿瘤药物的临床应用规范、用药注意事项、药物相互作用及用药监护要点,总结药物的作用特点、用药风险点及防治措施,为小分子靶向抗肿瘤药物的安全、有效、精准使用提供用药支持。
关键词:抗肿瘤药物 小分子靶向药物 临床应用― 药学监护 注意事项
中图分类号:R979.1;R730.5文献标志码:A文章编号:1006-1533(2022)S2-0022-12
引用本文―李莉霞,刘艳,顾芬芬,等.小分子靶向抗肿瘤药物的临床应用与注意事项[J.上海医药,2022,43(S2);22-33.
Clinical application and precautions of small molecule targetedanti-tumor drugs
LI Lixia,LIU Yan,GUFenfen, CHEN Jihui,WANG Ranran,CHEN Lun,JINLei,ZHANG Jian
(Department of Pharmacy , Xinhua Hospital,Shanghai Jiao Tong University School of Medicine,Shanghai 200092,China)
ABSTRACT Small molecule targeted antitumor drugs are widely used in clinical practice and have achieved certainefficacy, but there are different degrees of antoxic side effects in the process of use.Reducing medication risk,improvingpatients' medication compliance and ensuring clinical efficacy are the concerns of the medical stafs.This paper generalized theclinical application specifications,medication attentions,drug interactions and medication monitoring points according to thedifferent action targets of small molecule targeted antitumor agents, and summarized the characteristics of drug action,drugrisks and prevention measures,so as to provide medical support for guaranteeing the safe ,effective and accurate use of smalmolecule targeted antitumor drugs.
KEY WORDS antitumor drugs; small molecule targeted drugs; clinical applications; pharmaceutical cares; precautions
目前分子靶向治疗已成为肿瘤治疗的重要策略,能高效并选择性地殺伤肿瘤细胞取得一定的临床疗效,且减少对正常组织的损伤,在当前肿瘤的临床药物治疗中发挥重要作用。目前常用的小分子靶向抗肿瘤药物,根据作用靶点分类,包括表皮生长因子受体(epidermalgrowth factor receptor,EGFR)抑制剂、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)抑制剂、间质上皮转化因子(mesenchymal epithelial transition factor,MET)抑制剂、神经营养性酪氨酸受体激酶(neurotrophic tyrosine receptor kinase,NTRK)抑制剂、鼠类肉瘤滤过性病毒致癌基因同源体B1(v-rafmurinesarcoma viral oncogene homolog B1,BRAF)抑制剂、 MEK抑制剂、人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)抑制剂、周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)4/6抑制剂、多腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂、抗血管多激酶抑制剂、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂、组蛋白去乙酰化酶(histonedeacetylases,HDAC)抑制剂、ABL-BCR抑制剂和血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)C-kit抑制剂、BTK抑制剂、Janus相关激酶(Janus kinase,JAK)抑制剂等。随着小分子靶向抗肿瘤药物在临床上的广泛应用,毒副作用等临床应用问题也逐渐凸显出来,大多数患者在用药期间出现了不同程度的毒副反应,小分子靶向抗肿瘤药物的用药风险和安全性的问题需要临床密切关注。常见的问题:如吉非替尼、厄洛替尼等易发生脓包性皮疹,伊马替尼、索拉非尼等引起剂量依赖性腹泻,部分药物与通过肝药酶CYP3A4等代谢的药物联合使用,影响药物疗效等。另外,口服制剂其吸收往往受到多种因素的影响,其中较为常见的就是食物和抑酸药物,抑酸药物影响了小分子靶向药物溶解和吸收(2]等。本文通过临床药学的视角,总结不同作用机制和靶点的小分子靶向抗肿瘤药物的临床应用特点,了解药物的毒副作用和用药风险,制定常用药物的监护要点。将靶向治疗与个体化治疗结合起来,为不同的患者量体裁衣,为安全有效的靶向治疗积累更多的经验。
1常用小分子靶向抗肿瘤药物临床应用
1.1 EGFR-酪氨酸激酶抑制剂(tyrosine kinase in- hibitors,TKls)的临床应用
表达EGFR已成为非小细胞肺癌(non-small cell lung cancer,NSCLC)的重要治疗靶点,目前已开发出多种靶向的小分子TKIs,EGFR-TKIs现已开发至第四代,并改写了EGFR阳性NSCLC患者的诊疗指南。不同的第一代药物之间疗效没有显著差异,第二代药物比第一代药物疗效更佳,但是与第一代药物比较,第二代药物≥3级不良事件(adverse events,AEs)更多3-5]。第三代TKIs奥希替尼、阿美替尼能够克服部分第一、二代EGFR-TKIs的耐药性,且血脑屏障(blood-brain barrier,BBB)穿透能力更强,抗中枢神经系统(central nervous system,CNS)转移灶活性更高[6-8]。常用EGFR-TKIs类药物的临床应用、用法用量、药物代谢等方面略有不同,见表1。
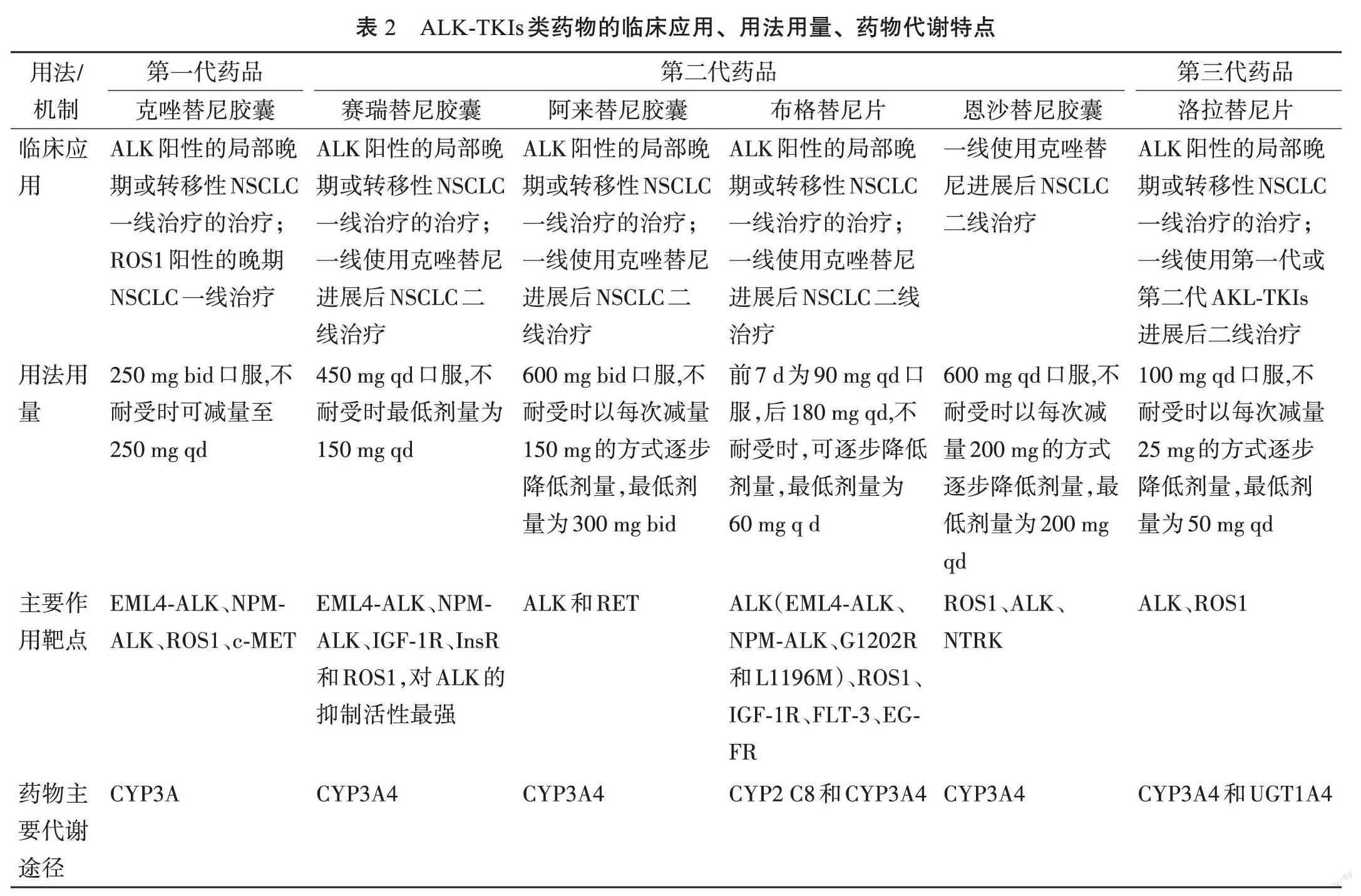
1.2 ALK-TKIs的临床应用
AKL抑制剂发展到目前已有三代药物在国内上市,其中包括第一代的克唑替尼,第二代的塞瑞替尼、阿来替尼、恩沙替尼以及布格替尼,第三代的洛拉替尼。其中除恩沙替尼外,其余5个药品均已获批ALK融合阳性患者晚期一线治疗适应证,临床应用证实具有非常良好的客观缓解率(objective response rate,ORR)及无进展生存期(progression-free survival,PFS)值[9-10]。克唑替尼是第一个被批准用于治疗NSCLC的ALK抑制剂,可显著提高患者的PFS,但使用一定时间后会出现一定的耐药进展的情况。
此后,第二代ALK抑制剂相继上市,在克服克唑替尼耐药后二线治疗也取得不错的ORR及PFS值[12-13]。第三代AKL抑制剂洛拉替尼可克服ALKG1202R耐药突变,针对其他耐药突变以及第三代洛拉替尼突变耐药的第四代ALK-TKIs药物也正在研发中,如NVL-655、TPX-0131等。目前上市的三代ALK-TKIs 类药物的临床应用、用法用量、药物代谢等方面略有不同,见表2。
1.3 MET抑制剂
MET基因编码合成作为受体酪氨酸激酶家族成员的细胞间质上皮转化因子(cellular mesenchymal epithelial transitionfactor,c-MET),c-MET与肝细胞生长因子(hepatocyte growth factor,HGF)结合,调控细胞生长与增殖。c-MET通路表达异常或调节异常时促进肿瘤细胞的增殖与转移。根据结构特征及与激酶的结合方式,小分子c-MET抑制剂又可以分为三类:I型为ATP竞争性抑制剂,以克唑替尼、卡马替尼、沃利替尼、替泊替尼为代表;II型为ATP竞争性多靶点抑制剂,以卡博替尼、梅沙替尼、Glasatinib为代表;II型为非ATP竞争性抑制剂,代表性化合物是Tivantinib。卡马替尼是首款获得FDA批准用于治疗非小细胞肺癌的MET抑制剂药物。赛沃替尼可选择性地抑制MET激酶的磷酸化,对存在MET14号外显子跳变的肿瘤细胞增殖有明显的抑制作用,为我国首个获批的可特异性靶向MET激酶的小分子抑制剂,用于经含铂化疗后疾病进展或不耐受标准含铂化疗的、具有MET外显子14跳变的局部晚期或转移性NSCLC成人患者。药物的临床应用及用法用量见表3。
1.4转染期间重排(rearranged during transfection, RET)抑制剂:普拉替尼
RET原癌基因编码作为受体酪氨酸激酶亚家族成员之一的跨膜蛋白RET。第一代RET抑制剂是具有RET活性的第一代多激酶抑制剂,这类药物不是RET特異性抑制剂,包含索拉非尼、瑞戈非尼、舒尼替尼。第二代选择性RET突变抑制剂,包含Selpercatinib、普拉替尼等。第三代改良型RET突变抑制剂,可通过新的靶向通路抑制RET融合,减少突变的发生,包含TPX-0046、BOS172738、SL-1001等。
普拉替尼是目前国内唯一获批的单靶点RET抑制剂[15]。国内批准适应证用于既往接受过含铂化疗的RET基因融合阳性的局部晚期或NSCLC成人患者的治疗,也用于需要系统性治疗的晚期或转移性RET突变型甲状腺髓样癌成人和12岁及以上儿童患者的治疗,以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌成人和12岁及以上儿童患者的治疗。推荐剂量为每天400mg,直至疾病进展或出现无法耐受的毒性。空腹口服。如出现不良反应,应根据患者的耐受性,以每次减量100mg的方式逐步降低剂量,首次减量至300mg,每天1次。第二次减量至200mg,每天1次。第三次减量至100mg,每天1次。如果患者第三次减量仍不能耐受应永久停用。
1.5 HDAC抑制剂:西达本胺
组蛋白乙酰化酶(histone acetylase,HAT)及HDAC 之间的动态平衡控制着染色质的结构和基因表达。HDAC抑制剂可以抑制肿瘤细胞的生长,促进肿瘤细胞凋亡6],目前已上市的药物包括西达本胺、伏立诺他等。
西达本胺是我国自主研发合成的首个选择性HDAC口服抑制剂。在临床应用中,西达本胺也表现出较好的耐受性、安全性,对多种恶性肿瘤均具有显著的疗效[1]。适应证为既往至少接受过一次全身化疗的复发或难治的外周T细胞淋巴瘤患者;联合芳香化酶抑制剂用于激素受体(hormone receptor,HR)阳性、HER2阴性、绝经后、经内分泌治疗复发或进展的局部晚期转移性乳腺癌患者。推荐一次30mg口服给药,每周2次,2次服药间隔不应少于3d。如疾病未进展或未出现无法耐受的毒性,建议持续服药。
1.6 mTOR抑制剂:依维莫司
mTOR作为PI3K/Akt下游的一种重要的丝氨酸/苏氨酸蛋白激酶,通过激活核糖体激酶调节肿瘤细胞的增殖、存活和侵袭转移[18],此类药物包括雷帕霉素的衍生物依维莫司、坦罗莫司等。依维莫司可抑制mTOR靶蛋白的合成,还可抑制低氧诱导因子(hypoxia-inducible factor, HIF-1)的表达和降低血管内皮生长因子(vascularendothelial growth factor,VEGF)的表达,具有抑制肿瘤[07-61]细胞生长、肿瘤细胞代谢及肿瘤血管生成的作用0适应证包括晚期肾细胞癌(renal cell carcinoma,RCC)、进展期胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor,pNET)、非功能性胃肠道或肺源神经内分泌肿瘤(neuroendocrine tumor,NET)、结节性硬化症相关的室管膜下巨细胞星形细胞瘤(subependymal giant cell astrocytoma with tuberous sclerosis complex,TSC-SEGA)和肾血管平滑肌脂肪瘤(tuberous sclerosis complex- associated renal angiomyolipomas,TSC-AML)。推荐一次10mg,每日1次,每日同一时间口服给药(TSC-SEGA初始剂量为一次4.5mg/㎡,每日1次口服)。
1.7抗血管多激酶抑制剂的临床应用:索拉菲尼、安罗替尼和瑞格菲尼
多激酶抑制剂作用靶点众多,可直接作用于VEGF受体,阻断VEGF通路,抑制肿瘤血管生成,目前临床广泛使用的包括索拉菲尼、安罗替尼、瑞格菲尼等。索拉菲尼是一种口服的多激酶抑制剂,一方面通过抑制RAF/MEK途径直接抑制肿瘤生长,另一方面通过抑制VEGF受体和PDGFR途径,阻断肿瘤新生血管的形成,抑制肿瘤生长(21。瑞格非尼是一种新型口服多激酶抑制剂,同样阻断促进肿瘤生长的多种激酶,其与索拉菲尼结构类似(22]。安罗替尼是我国自主研发的多激酶抑制剂,具有抗肿瘤血管生成和抑制肿瘤细胞生长的作用,因其具有不良反应小、靶点明确及安全性高等优点,在多种恶性肿瘤中显示出了良好的临床疗效。
1.8 CDK4/6抑制剂的临床应用
CDK4/6抑制剂高效精准地抑制乳腺癌细胞中CDK4和CDK6激酶的活性,阻断Rb蛋白磷酸化,从而阻滞细胞周期从G1期到S期的进程而抑制肿瘤细胞增殖。FDA已经批准了3种选择性CDK4/6抑制剂:哌柏西利、瑞博西尼和阿贝西利。CDK4/6抑制剂的临床应用:辅助内分泌治疗期间复发或辅助内分泌治疗结束1年内复发的HR阳性HER2阴性晚期乳腺癌患者,均可考虑使用CDK4/6抑制剂联合氟维司群或CDK4/6抑制剂联合芳香化酶抑制药治疗;辅助内分泌治疗结束1年后复发或初诊即为转移性HR阳性HER2阴性乳腺癌患者,可考虑CDK4/6抑制剂联合芳香化酶抑制药治疗。不同的CDK4/6抑制剂的用法用量、注意事项及药物代谢特点见表5。
1.9 HER2抑制剂的临床应用
目前已经开发的HER2靶向TKIs有拉帕替尼、奈拉替尼、妥卡替尼和吡咯替尼。HER2靶向药物耐药分为内在性和获得性耐药性。其中L755S是最常见的获得性激活突变,在转移性肿瘤中更为常见。L755S对阿帕替尼、妥卡替尼具有交叉耐药性但可能对奈拉替尼敏感。不同的HER2-TKI针对HER2和EGFR家族的不同受体,因此每一种药物都有独特的作用机制、用法用量和药物代谢特点,常用HER2-TKIs药物的临床应用、用法用量、作用机制、批准适应证及药物代谢特点见表6。
1.10 TKIs的临床应用:伊马替尼和尼洛替尼
TKIs主要通过抑制Bcr-Abl融合蛋白而发挥抗白血病作用。目前,临床上最常用的针对Bcr-Abl融合基因的TKIs包括第一代药物伊马替尼和第二代药物尼洛替尼。伊马替尼是一种口服多激酶抑制剂,在体内外均可抑制Bcr-Abl酪氨酸激酶,可特异性抑制Bcr-Abl阳性细胞系细胞、费城染色体阳性的慢性髓性白血病(Philadelphiachromosome-positive chronic myeloid leukemia,Ph CML)和费城染色体阳性的急性淋巴细胞白血病(Philadelphiachromosome-positiveacute lymphoblasticleukemia, Ph+ALL)患者新鲜细胞的增殖,并诱导其凋亡,抑制胃肠道间质瘤(gastrointestinal stroma tumor,GIST)细胞的增殖,并诱导其凋亡。尼洛替尼可与ABL蛋白的非活性激酶结构域结合并使其稳定,在体外可抑制Bcr-Abl介導的鼠类白血病细胞株和来自PhCML患者的人白血病细胞株的增殖,体内可使鼠类Bcr-Abl异种移植模型的肿瘤减小[24]。
1.11 JAK抑制剂:芦可替尼
芦可替尼为JAK家族JAK1和JAK2的选择性抑制药,可抑制细胞因子依赖的恶性血液肿瘤细胞模型或表达JAK2V617突变蛋白的非细胞因子依赖的Ba/F3细胞的JAK-STAT信号转导和细胞增殖,IC30为80~320 nmol/L。该药在国内被批准用于治疗中、高危原发性骨髓纤维化(myelofibrosis,MF),真性红细胞增多症(primary polycythemia vera,PPV)继发的MF(PPV-MF)或原发性血小板增多症继发的MF(post-essential thrombocythemia myelofibrosis,PET-MF)相关的脾肿大或疾病相关症状。初始剂量5~20mg,每日2次,具体剂量根据血小板计数决定。最大剂量一次25mg,每日2次(25-26]。
1.12蛋白酶抑制剂:硼替佐米
硼替佐米为哺乳动物细胞中26S蛋白酶体糜蛋白酶样活性的可逆性抑制药。26S蛋白酶体为一种大的蛋白质复合体,可降解被泛素化的蛋白质。泛素蛋白酶体通道对调节特异蛋白在细胞内的浓度起重要作用,以维持细胞内稳态。蛋白水解可影响细胞内多级信号级联反应,破坏正常稳态机制,从而导致细胞死亡。而对26S蛋白酶体的抑制可阻止此靶向蛋白水解。体外试验表明,硼替佐米对多种类型的癌细胞具有细胞毒性。临床前体内肿瘤模型试验证明,硼替佐米可延缓肿瘤(包括多发性骨髓瘤)生长。目前国内批准用于治疗多发性骨髓瘤和套细胞淋巴瘤。皮下注射或者静脉注射,一次1.3mg/㎡,每周1~2次。具体剂量和疗程根据疾病状态和患者的耐受程度调整。
1.13 NTRK抑制剂:拉罗替尼
原肌球蛋白受体激酶(tropomyosin receptor kinase, TRK)A、B和C是由基因NTRK1、NTRK2和NTRK3编码的,可以产生组成激活的嵌合TRK融合蛋白,该蛋白可作为致癌驱动因子,促进肿瘤细胞系中的细胞增殖和生存。拉罗替尼在中国上市,是TRKA、TRKB、TRKC的抑制剂。拉罗替尼获FDA批准用于具有下列所有特征的晚期肿瘤:携带NTRK基因融合,不存在已知的获得性耐药突变,并且没有其他满意的替代疗法(或治疗后进展)。成人和儿童体表面积(body surface area, BSA)>1.0㎡的患者,每日口服2次,每次100mg;儿童BSA≤1.0㎡,每日2次口服100mg/㎡。用水整片吞服,不要咀嚼或压碎胶囊;口服液借助口服注射器吞下,口服液须放在冰箱中冷藏保存。
1.14 BRAF抑制剂:达拉非尼
BRAF原癌基因属于RAF基因家族,作为RAF-MEK-ERK信号转导通路中的重要成员,介导RAS与促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)相结合,调节肿瘤细胞增殖、分化和凋亡。肺腺癌中,BRAF突变大约有2%,主要突变类型是V600E,突变率高达50%,主要在女性吸烟群体中出现[27]。达拉非尼是一种口服BRAF抑制剂,可以与曲美替尼联合用于治疗转移性NSCLC。推荐一次150mg,每日2次,在餐前至少1h前或餐后至少2h后服用。
1.15 MEK抑制剂:曲美替尼
曲美替尼是一种促分裂原活化细胞外信号调节激酶1(MEK1)和MEK2激动和活性的可逆抑制剂,能够抑制BRAF V600突变阳性的黑色素瘤细胞在体内和体外的生长。美国FDA于2017年6月批准达拉非尼+曲美替尼组合疗法用于治疗肿瘤携带BRAF V600E突变的NSCLC。此批准基于一项II期临床试验(BRF113928)结果,该研究结果显示,36名未曾接受過治疗的患者总体缓解率(overall response rate,ORR)达到61%,57名曾接受过化疗的患者ORR达到63%,中位缓解持续时间为12.6个月[28)。推荐2mg每日1次口服,单药或与达拉非尼联合治疗,直至出现疾病进展或不可耐受的毒性反应。服用方法同达拉非尼。
1.16 PARP抑制剂的临床应用
PARP抑制剂通过抑制PARP途径的肿瘤细胞DNA损伤的修复,形成“合成致死”效应,导致肿瘤细胞死亡,从而达到杀灭肿瘤细胞的目的,PARPs已成为癌症治疗的新靶点。PARP抑制剂已被批准用于BRCA突变的卵巢癌和乳腺癌的治疗。不同PARP抑制剂的药理学特性有所不同,其对应的用法用量及注意事项见表8。
2小分子靶向抗肿瘤药物使用药学监护及注意事项
2.1常见的用药风险与防治措施
2.1.1消化系统不良反应监护及其处理
腹泻是EGFR-TKIs类发生频率最高的不良反应,其中以阿法替尼的发生率最高,厄洛替尼其次。腹泻也是ALK-TKIs和HER2-TKIs类药物常见的不良反应。阿贝西利最常见的不良反应也是腹泻。恶心是PARP抑制剂最常见的胃肠道不良反应,其他常见的有便秘、呕吐和腹泻。
防治措施:对于1~2级的腹泻可继续治疗,同时予以洛哌丁胺、益生菌和思密达药物对症处理。若2级腹泻持续超过48h或发生3级腹泻,则应暂停使用药物治疗,继续使用洛哌丁胺、益生菌和思密达治疗,可加用可待因(30mg bid),若患者的中性粒细胞增加,则考虑给予预防性抗生素治疗(29],并口服或静脉补充电解质和液体,以免出现脱水。对于3~4级恶心和/或呕吐,建议停药,直至药物不良反应缓解至≤1级,然后降低药物剂量并重启治疗(30-32]。恶心对症治疗时可以参照细胞毒性药物化疗引起的胃肠道不良反应使用胃肠动力药、5-羟色胺受体拮抗剂等止吐药物,必要时在睡前30~60min服用止吐药物。
2.1.2肝功能损害监护及其处理
药物性肝损伤是EGFR-TKIs类药物常见的不良反应,其中以吉非替尼发生率最高。MET-TKI抑制剂在接受≥400mg剂量的患者中,常见肝毒性,大多数为1~2级。西达本胺可以引起肝功能指标异常。瑞博西尼的3~4级肝毒性反应发生率略>10%,阿贝西利的3~4级肝毒性发生率为3.8%~6.4%。
防治措施:轻度肝酶异常,可选用双环醇、甘草酸制剂、水飞蓟素等药物保肝治疗,若为胆汁淤积型肝损,可选用熊去氧胆酸、腺苷蛋氨酸对症处理治疗[33]。若为中重度肝损,或伴逐渐加重的临床症状则应暂停用药,及时就医。在服用西达本胺前,如果γ-GGT、ALT或AST>正常上限2.5倍,建议暂缓用药,待相关指标降至正常值时再进行首次药物服用。
2.1.3皮肤不良反应监护及处理
EGFR药物对皮肤生理学有多种作用,抑制EGFR的活性会引起多种皮肤不良反应。MET-TKIs在接受≥400mg剂量的患者中,易出现过敏反应。皮肤反应是多激酶抑制剂治疗后最常见的毒性反应,其中手足皮肤反应最常见。在接受索拉非尼或舒尼替尼治疗的患者中皮肤过敏发生率为9%~62%。HER2-TKIs用药期间也容易出现出现手足综合征。
防治措施:发生痤疮可涂抹红霉素软膏、克林霉素凝胶对症处理,伴有甲沟炎可考虑使用联苯苄唑乳膏、特比萘芬乳膏]。伴有瘙痒时可口服左西替利嗪、氯雷他定、苯海拉明等治疗,重度瘙痒时可服用加巴喷丁、普瑞巴林等。对于轻中度皮肤不良反应,无需调整靶向药物的剂量或中断治疗而影响抗癌效果;对重度不良反应,应系统用药对症处理而改善症状,必要时减量或暂停抗肿瘤靶向治疗。所有用药患者都应加强皮肤护理,保持皮肤清洁。
2.1.4口腔黏膜炎及其处理
EGFR-TKIs类药物在治疗中可引起药物相关口腔黏膜炎等不良反应,其中阿法替尼、奥希替尼、吉非替尼所致口腔黏膜炎发生率较高。依维莫司所致口腔炎,其发生机制和临床表现不同于传统的化疗相关黏膜炎,主要表现为口腔内黏膜破溃、疼痛,用药第1周迅速出现,大多数4~5d自行痊愈。
防治措施:因此日常生活中应保持口腔清洁,餐后使用4%碳酸氢钠含漱剂或0.12%氯己定含漱剂,之后可使用0.1%曲安奈德口内膏涂布于溃疡处,3次/d,促进愈合[34]。中重度可局部使用利多卡因、糖皮质激素等[35]。严重致影响进食时,需要暂时停药处理,恢复后再从较低剂量开始使用。
2.1.5血液系不良反应及处理
ALK-TKIs引发贫血是相对比较常见的不良反应,但多以轻症为主。塞瑞替尼贫血的总体发生率为15%。HDAC抑制剂西达本胺血液学不良反应多发生在首次服药后6周内,主要包括血小板计数降低、白细胞计数降低、血红蛋白浓度降低等。中性粒细胞减少是CDK4/6抑制剂最常见的不良反应类型,其中哌柏西利和瑞博西尼中性粒细胞减少的比例最高。血液学不良反应也是PARP抑制剂常见的不良反应。
防治措施:贫血可使用促红细胞生成治疗和补充铁剂等,具体的处理措施可参考《中国肿瘤化疗相关贫血诊治专家共识》中关于贫血的具体治疗措]。出现1~2级血液学不良反应(血小板计数≥50x10°/L,中性粒细胞计数≥1.0x10°L)时,建议继续用药,维持原剂量,并密切临床观察随访和进行实验室检查,必要时可给予粒细胞集落刺激因子。当出现≥3级血液学不良反应(血小板计数<50x10°/L,中性粒细胞计数<1.0x10°/L)时,应暂停用药,进行对症处理,包括给予促血小板生成素和粒细胞利落刺激因子,待相关血液学不良反应缓解至用药条件后可以恢复从较小的剂量开始使用。
2.1.6神经系统不良反应及处理
视力障碍是ALK-TKIs特有的不良反应,如克唑替尼,主要表现为视觉减退、视力模糊、飞蚊症、畏光和复视。阿来替尼也有报道3%患者存在轻度视觉不良反应。硼替佐米治疗会导致周围神经病变,主要是感觉障碍,表现为麻木,疼痛或脚或手有灼热感。
防治措施:一般来说,视觉障碍多表现为短暂性的,对患者的日常生活影响较小或没有影响,因此一般不需要特殊的處理。如果视觉障碍持续存在或严重程度恶化,也应考虑视功能和/或神经学评估,暂停用药,必要时眼科专科就诊。对于已经存在或有周围神经病高风险的患者,可以考虑硼替佐米皮下给药,在硼替佐米治疗期间出现新的或恶化的周围神经病的患者可能需要降低剂量。
2.1.7心血管风险监护与处理
多激酶抑制剂有引起血压升高,QT间期延长的风险。TKIs有引起QT间期延长、缺血性心脏病、缺血性脑血管病、外周动脉疾病等风险。
防治措施:患有先天性长QT间期综合征的患者应避免使用。避免使用有延长QT间期风险的药物和强CYP3A4抑制剂。对于高龄、既往有心血管疾病或心血管不良事件高危因素的患者,治疗期间应密切监测心功能,定期进行心电图和血电解质的监测。对于出现任何级别的QT间期延长,并伴有尖端扭转性室性心动过速、多形性室性心动过速、严重心律失常症状或体征中的任何一种情况的患者建议停用。
2.2注意药物相互作用与影响
2.2.1注意与肝药酶代谢的药物相互作用
1)与CYP3A4药物相互作用。除阿法替尼外EGFR-TKIs药物、大部分的MET-TKIs、CDK4/6抑制剂主要被肝药酶CYP3A4代谢,奈拉替尼、吡咯替尼、安罗替尼、普拉替尼、瑞格非尼、依维莫司、伊马替尼、尼洛替尼、拉帕替尼、达拉非尼、曲美替尼等也主要在肝脏经CYP3A4代谢,应避免与强效CYP3A4抑制药或诱导药合用,否则可出现严重的不良反应。芦可替尼与不同强度的细胞色素CYP3A4抑制药合用时,应对患者进行密切监测,并根据安全性和有效性对剂量进行调整。与强效细胞色素CYP3A4抑制药合用,可能增加硼替佐米毒性的发生风险,如须合用,应监测硼替佐米毒性的体征,并考虑减少剂量。
2)与P-糖蛋白(P-glycoprotein,P-gp)抑制剂、诱导剂相互作用。利托那韦(P-gp强抑制剂)会增加阿法替尼的暴露量、利福平(P-gp强诱导剂)可降低阿法替尼的暴露量。拉帕替尼与P-gp抑制药合用可能使拉帕替尼血药浓度升高,而拉帕替尼可抑制P-gp、CYP3A4、CYP2C8,故与地高辛(P-gp底物)、咪达唑仑(CYP3A4底物)、紫杉醇(CYP2C8底物和P-gp底物)等合用可使底物的血药浓度升高。奈拉替尼、吡咯替尼可抑制其他P-gp底物(如达比加群)的转运,P-gp底物(如地高辛、达比加群)与奈拉替尼、吡咯替尼合用可使底物的血药浓度升高,可能增加不良反应(包括心脏毒性)的发生风险。普拉替尼避免与强效的P-gp抑制剂或诱导剂联合使用。
2.2.2抑酸剂对药物吸收的影响
MET-TKI由于分子构型的原因,其体内吸收受胃酸pH值影响,使用质子泵抑制剂(proton pump inhibitors, PPIs)、H2受体拮抗剂、抗酸药等消化系统药物导致胃内pH值升高,很可能会降低此类药物的暴露,使吸收入患者体内的有效浓度降低,影响疗效。与PPIs、H2受体阻滞药、抗酸药合用可使奈拉替尼用药时的峰浓度(peakconcentration,C...)、曲线下面积(area under curve, AUC)、血药浓度降低,减弱奈拉替尼的活性,应避免奈拉替尼与PPIs合用,或者在给予H2受体拮抗药前至少2h或在给予H,受体拮抗药10h后服用奈拉替尼,或者在给予抗酸药3h后服用奈拉替尼。
2.2.3注意与免疫抑制药联用
依维莫司与其他免疫抑制药联用时感染的风险增加,合用时应谨慎,并考虑给予抗耶氏肺孢子虫肺炎的预防治疗。环孢素为CYP3A4及P-gp抑制药,依维莫司与标准剂量环孢素联用时可增加肾毒性,联用时应与减少环孢素剂量,且监测依维莫司和环孢素的血药浓度。
2.2.4其他
依维莫司与其他可引起血管神经性水肿的药物(如血管紧张素转换酶抑制药)合用可增加发生血管神经性水肿的风险,应避免合用,与口服降糖药合用可能出现低血糖症或高血糖症。合用时應密切监测血糖水平,并调整口服降糖药的剂量。
2.3用药期间注意事项
2.3.1注意饮食结构的调整
口服易引发腹泻的小分子靶向制剂,治疗期间应低脂低纤维饮食,忌食用咖啡因、酒精、奶制品、脂肪、纤维、橘子汁、葡萄汁以及辛辣食物,少食多餐。伊马替尼存在消化道不良反应,建议在进餐时用大量水送服。
2.3.2警惕药物与食物的影响,注意服药时间
葡萄柚汁为强效CYP3A4抑制剂,用药依维莫司、抗血管多激酶抑制剂等药物期间避免食用葡萄柚及其制品。食物会影响药效,不同的药物要注意用药时间,脂肪含量较高的食物增加吡咯替尼的疗效,建议在餐后30min内服药;食物会增强尼洛替尼药理作用,容易出现QT间期延长等副作用,用药前2h到用药后1h内避免进食;西达本胺餐后服药生物利用度高且对胃肠道刺激较小,建议餐后30min后服用;食物可增加奈拉替尼的吸收,建议在进餐时用药。
2.3.3皮肤防护和口腔护理
为减少皮肤不良反应的发生,服用药物时应注意日常皮肤护理、注意防晒,每天保持皮肤的清洁与湿润,温水洗浴后适当涂抹保湿乳霜,穿着宽松舒适的衣物。平时每天进餐后即刻口腔清洁,餐后漱口。
2.3.4需要定期体检和随访
用药初期每周检查全血细胞计数1次,4周后每2~4周检查1次,直至剂量稳定。肝功能损伤的病人在用药前6周内至少每1~2周检查1次全血细胞计数,如果肝功能和血细胞计数稳定,之后可能根据临床需要进行检查。用药后可能出现血脂升高,用药期间请定期检查血脂,定期检查肝功能、肾功能。
2.3.5注意生育影响与避孕措施
有生育能力的妇女请在用TKIs期间和停药后至少2周内,采取高效的避孕措施。男性患者用药期间也需采取有效避孕措施。生育能力的妇女用硼替佐米期间和用药结束后7个月内应采取有效的避孕措施,男性患者用药期间和用药结束后4个月内应采取有效的避孕措施。
2.3.6其他
用药期间需避免受伤,远离传染病人群,减少感染风险。用药期间避免接种活疫苗,避免与接种过活疫苗的人密切接触。不要擅自停药,日常服药期间如果漏服本品1次,应在患者记起后尽快服用,如果距离下次服药时间不足12h,则患者不应再服用漏服的药物。
参考文献
[1]WVillemsen A, Lubberman F, Tol J, et al. Effect of food and acid-reducing agents on the absorption of oral targeted thera- pies in solid tumors[J].Drug Discov Today,2016,21(6):962-976.
[2]ChuMP,HechtJR,SlamonD,etal.Association of proton pump inhibitors and capecitabine efficacy in advanced gas- troesophageal cancer: secondary analysis of the TRIO-013/ LOGiC randomized clinical trial[J]. JAMA Oncol,2017,3(6):767-773.
[3]Felip E, Hirsh V, Popat S, et al. Symptom and quality of life improvement in LUX-Lung 8,an open-label phase III study of second-line afatinib versus erlotinib in patients with ad- vanced squamous cell carcinoma of the lung after first-line platinum-based chemotherapy[J].Clin Lung Cancer,2018, 19(1):74-83.
[4]WuYL,Cheng Y, Zhou X, et al. Dacomitinib versus gefi- tinib as first-line treatmentfor patients with EGFR-mutation- positive non-small-cell lung cancer (ARCHER 1050): a ran- domised,open-label,phase 3 trial[J].Lancet Oncol,2017,18(11):1454-1466.
[5]Paz-Ares L, Tan EH, O'Byrne K, et al. Afatinib versus gefi- tinib in patients with EGFR mutation-positive advanced non- small-cell lung cancer: overall survival data from the phase II b LUX-Lung 7 trial[J].Ann Oncol,2017,28(2):270-277.
[6]Yang JCH, Ahn MJ, Kim DW, et al. Osimertinib in pretreat- ed T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component[J].J Clin On- col,2017,35(12):1288-1296.
[7]NieK,ZhangZ,ZhangC,etal.Osimertinib compared docetaxel-bevacizumab as third-line treatment in EGFR T790M mutated non-small-cell lung cancer[J].Lung Can- cer,2018,121:5-11.
[8]WangH,ZhangL,HuP,etal.Penetration of the blood-brain barrier by avitinib and its control of intra/extra-cranial dis- ease in non-small cell lung cancer harboring the T790M mu- tation[J].Lung Cancer,2018,122:1-6.
[9]Roberts PJ. Clinical use of crizotinib for thetreatment of non- small cell lung cancer[J].Biologics,2013,7:91-101.
[10] Lin JJ,Zhu VW, Schoenfeld AJ, et al. Brigatinib in patientswith alectinib-refractory ALK-positive NSCLC[J].J Thorac Oncol,2018,13(10):1530-1538.
[11]OuSH,J?nnePA,Bartlett CH, et al. Clinical benefit of con- tinuing ALK inhibition with crizotinib beyond initial disease progression in patients with advanced ALK<-positive NSCLC [J].Ann Oncol,2014,25(2):415-422.
[12] Yang Y,ZhouJ,ZhouJ,etal.Efficacy,safety,andbiomark-er analysis of ensartinib in crizotinib-resistant,ALK-positive non-small-cell lung cancer: a multicentre,phase 2 trial[J]. Lancet Respir Med,2020,8(1):45-53.
[13]ShawAT,KimTM,Crinò L, et al. Ceritinib versus chemo- therapy in patients with ALK-rearranged non-small-cell lung cancer previously given chemotherapy and crizotinib (AS- CEND-5):a randomised,controlled,open-label,phase 3 trial [J].Lancet Oncol,2017,18(7):874-886.
[14] Drilon A,Cappuzzo F, Ou SI, et al. Targeting MET in lung cancer:will expectations finally be MET?[J].J Thorac On- col,2017,12(1):15-26.
[15]GainorJF,CuriglianoG,KimDW,etal.Pralsetinib for RETfusion-positive non-small-cell lung cancer (ARROW): a multi-cohort,open-label,phase 1/2 study [J].Lancet Oncol, 2021,22(7):959-969.
[16]WittO,DeubzerHE,MildeT,et al. HDAC family:what are the cancer relevant targets?[J]Cancer Lett,2009,8;277(1):8-21.
[17]王晶,吳涛,白海.西达本胺在血液系统疾病中的应用研究进展[J].中国医刊,2021,56(12):1301-1303.
[18]DobashiY,WatanabeY,MiwaC,etal.Mammalian target of rapamycin:a central node of complex signaling cascades[J]. Int J Clin Exp Pathol,2011,4(5):476-495.
[19] Houghton PJ.Everolimus[J]. Clin Cancer Res, 2010,16(5):1368-1372.
[20] Hua H,KongQ,ZhangH,etal.Targeting mTOR for cancer therapy[J].J Hematol Oncol,2019,12(1):71.
[21] Di Marco V,De Vita F,Koskinas J, et al. Sorafenib: from lit- erature to clinical practice[J].Ann Oncol,2013,24(Suppl 2): ii30-ii37.
[22]Wilhelm SM, Dumas J, Adnane L, et al. Regorafenib (BAY 73-4506): a new oral multikinase inhibitor of angiogenic, stromal and oncogenic receptor tyrosine kinases with potent preclinical antitumor activity[J].Int J Cancer,2011,129(1):245-255.
[23] Shen G,ZhengF,Ren D, et al. Anlotinib: a novel multi-tar- geting tyrosine kinase inhibitor in clinical development[J].J Hematol Oncol,2018,19;11(1):120-131.
[24] Cohen P,CrossD,J?nne PA. Kinase drug discovery 20 years after imatinib: progress and future directions[J]. Nat Rev Drug Discov,2021,20(7):551-569.
[25]Vaddi K, SarlisNJ,Gupta V. Ruxolitinib, an oral JAKI andJAK2 inhibitor, in myelofibrosis[J].Expert Opin Pharmaco- ther,2012,13(16):2397-2407.
[26]KiladjianJJ,ZacheeP,Hino M, et al.Long-term efficacy and safety of ruxolitinib versus best available therapy in polycythaemia vera (RESPONSE):5-year follow up of aphase 3 study[J].Lancet Haematol,2020,7(3):e226-e237.
[27] Villaruz LC, Socinski MA,Abberbock S, et al. Clinicopatho- logic features and outcomes of patientswith lung adenocar- cinomas harboring BRAF mutations in the Lung Cancer Mu- tation Consortium[J].Cancer,2015,121:448-456.
[28]PlanchardD,Smit EF, Groen HJM,etal.Dabrafenib plus tra- metinib in patients with previously untreated BRAFVE-mu- tant metastatic non-small-cell lung cancer: an open-label, phase 2 trial[J].Lancet Oncol,2017,18(10):1307-1316.
[29] Califano R, Tariq N, Compton S. et al. Expert consensus on the management of adverse events from EGFR tyrosine ki- nase inhibitors in the UK[J].Drugs,2015,75(12):1335-1348.
[30] Pirker R, Pereira JR,Szczesna A, et al. Prognostic factors in patients with advanced non-small cell lung cancer:data from the phase III FLEX study[J].Lung Cancer,2012,77(2):376-382.
[31] Soda M, Choi YL, Enomoto M,et al. Identification of thetransforming EML4-ALK fusion gene in non-small-cell lung cancer[J].Nature,2007,448(7153):561-566.
[32]SequistLV,WaltmanBA,Dias-SantagataD,etal.Genotypic and histological evolution of lung cancers acquiring resis- tance to EGFR inhibitors[J].Sci Transl Med,2011,3(75):75ra26.
[33]中華医学会肝病学分会药物性肝病学组.药物性肝损伤诊治指南[J].临床肝胆病杂志,2015,31(11):1752-1769.
[34]LacoutureME,SchadendorfD,ChuCY,etal.Dermatologic adverse events associated with afatinib: an oral ErbB family blocker[J].Expert Rev Anticancer Ther,2013,13(6):721-728.
[35]AaproM,AndreF,Blackwell K, et al.. Adverse event man- agement in patients with advanced cancer receiving oral everolimus:focus on breast cancer[J].Ann Oncol,2014,25(4):763-773.
[36]史艳侠,邢镨元,张俊,等.中国肿瘤化疗相关贫血诊治专家共识(2019年版)[J].中国肿瘤临床,2019,46(17):869-875.
(收稿日期:2022-08-29)

