基于学科核心素养的元素化合物教学
毕占龙 蔡子华 房健

摘要:以“三酸抛光液”为情境,通过对素材进行分析,生成一系列学科问题,结合问题设计并进行实验验证浓度、温度、溶液酸碱性对硝酸根氧化性的影响,以及设计并验证铜与浓硝酸反应后溶液呈现绿色的原因。结合抛光液分析硝酸的用途及优缺点,使用的注意事项。通过实验探究、证据推理发展学生学科核心素养。
关键词:三酸抛光液;学科素养;硝酸;实验探究
文章编号:1008-0546(2022)10-0051-04中图分类号:G632.41文献标识码:B
一、教学内容分析
《普通高中化学课程标准(2017年版2020年修订)》强调在“教、学、评”一体化的背景下开展“素养为本”的教学,倡导在真实问题情境下的化学实验探究活动,激发学生的化学学习兴趣,促进教与学方式的转变,使每位学生的化学学科核心素养得到不同程度的发展。[1]本节课是人教版高中《化学》必修第二册第五章“化工生产中的重要非金属元素”第二节中“硝酸”的内容。硝酸是氮的重要化合物,是强氧化性物质的典型代表。其性质贯穿高中化学的始终,编排在离子反应、氧化还原反应规律以及元素周期律等理论内容后面,既要突出化学理论对元素学习的指导作用,也是帮助学生整理概念知识、总结方法模型、提升核心素养的重要素材。[2]通过设计浓度、温度、溶液酸碱性对硝酸根氧化性的影響等探究实验,提升学生科学探究能力。
二、教学目标
(1)能从价态角度分析硝酸具有强氧化性并初步判断还原产物。
(2)从微观和宏观相结合视角,结合实验验证硝酸根强氧化性受自身浓度及其他因素影响,学会从变化视角分析解决问题,树立基于证据的推理意识。
(3)能够基于铜与浓稀硝酸反应的实验现象,建立科学探究方法,树立科学探究意识。
(4)能从环保角度分析硝酸用途,具有绿色化学观念和可持续发展意识。
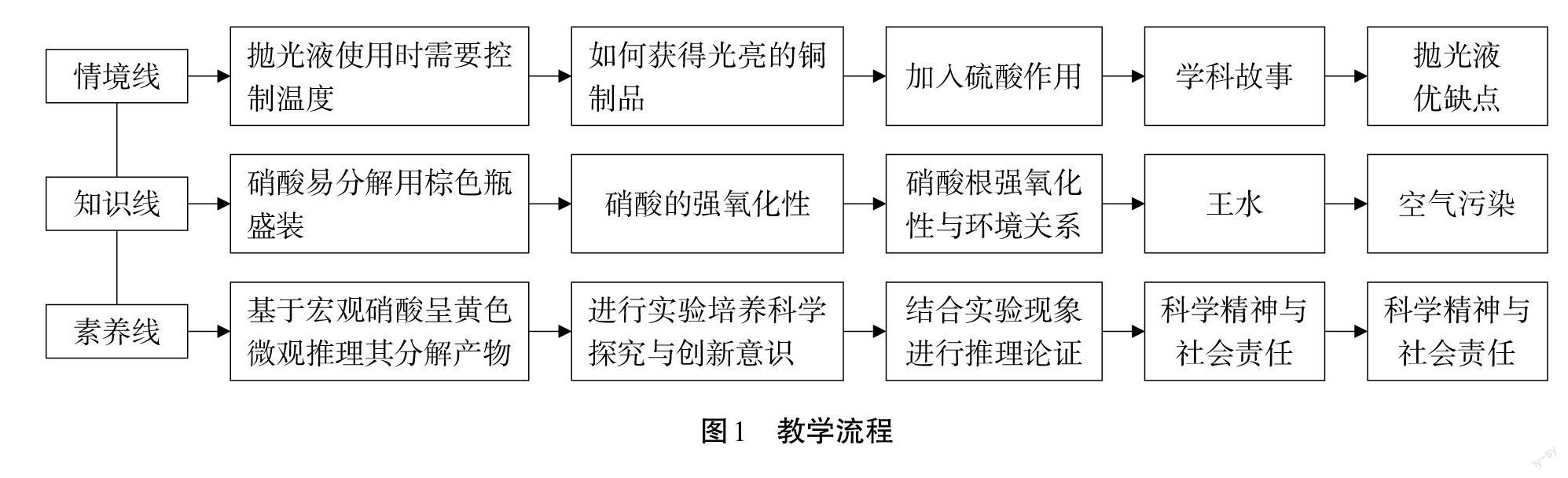
三、教学流程
见图1。
四、教学实录
【创设情境】(展示铜制品的“原件”与“新件”图片(见图2),一张图片是锈迹斑斑的“原件”,一张图片是“原件”经过处理后得到光亮平滑的“新件”)。铜制品用久之后表面凹凸不平色彩暗淡锈迹斑斑,不但影响美观程度更会影响其正常使用。同学们想知道用什么样的神奇药水可以让铜制品旧貌换新颜吗?
【学生】(对抛光液组成及工作原理充满好奇)很想知道。
【教师】让旧品换新颜的方法有很多,今天我们介绍一种化学抛光法——三酸抛光法。老师查阅文献得知三酸抛光液的组成(见图3),三酸抛光液中主要成分是硫酸、盐酸、硝酸,本节课我们重点学习三酸之一——硝酸的性质。
【板书】硝酸的性质
设计意图:真实的STSE内容,让学生感受到化学来源于生活,赞赏学科对生产生活的贡献,激发学生学习动力。
【实物展示】(展示硝酸,见图4)请同学们观察这三瓶硝酸,总结硝酸物理性质。分析久置的浓硝酸为什么会呈现黄色?应如何保存?
【学生1】硝酸是无色液体,打开瓶盖,有白雾出现,说明硝酸易挥发。需保存在棕色试剂瓶中说明硝酸见光易分解,而中间试剂瓶中硝酸为黄色,说明部分硝酸已经分解了。
【学生2】久置后的浓硝酸呈现黄色,说明硝酸分解生成NO2又溶解到硝酸中。
【学生3】生成NO2,说明N元素价态降低,H元素价态不能再升高,只能是O元素升价,生成O2,所以硝酸分解生成NO2、O2和H2O。
【师】同学们分析得很好,硝酸是无色有刺激性气味的液体,易挥发,见光或受热易分解,需要盛装棕色试剂瓶中密封保存,存放阴凉处。
【板书】1.物理性质
2.稳定性4HNO34NO2↑+O2↑+2H2O
【设计意图】通过观察到浓硝酸呈黄色的宏观现象,搜集证据从微观角度分析原因,发展学生宏微结合、证据推理意识。
【实验验证】硝酸与铜反应
【提出问题1】请同学们阅读铜制品抛光液简介(见图5),分析三酸抛光液中稀硫酸的作用是什么?你还能得出哪些结论?
【学生1】稀硫酸和盐酸的作用是除去铜表面的氧化膜,但不明白凹凸部分如何变光滑的;温度不能过高是防止硝酸分解;时间过长会有大量铜制品被腐蚀;纯铜不与稀盐酸、稀硫酸反应,一定是硝酸起到溶解部分铜的作用。
【证据推理】很好,如何推测铜与硝酸反应的产物呢?若铜与硝酸反应,体现硝酸的哪些性质?
【学生2】铜与硝酸的反应,铜是还原剂生成Cu(NO3)2,HNO3体现酸性,NO体现强氧化性,N化合价降低,可能生成NO2或者NO。
设计意图:结合三酸抛光液简介,推断稀硫酸的作用,硝酸可能有的化学性质,提升学生证据推理能力。根据氧化还原反应得失电子守恒思想论证产物,发展学生模型认知能力。
【板书】3.硝酸的强氧化性
【实验设计】同学们分析得非常好,让我们通过实验验证铜与硝酸反应的产物吧(见图6)。
1.实验用品:浓HNO3、稀HNO3、NaOH溶液、铜片、小药瓶、注射器。
2.实验汇报(见表1)
设计意图:能够基于实验现象,引导学生建立科学探究方法,树立科学探究意识,增强创新能力。
【提出问题2】通过实验我们能够得到哪些结论?还存在什么疑惑?
【学生反思】
甲:常温下,铜与浓稀硝酸均能发生反应,说明浓稀硝酸都有非常强的氧化性,可知抛光液中溶解凹凸不平铜的是硝酸。
乙:根据剧烈程度可知,浓HNO3的氧化性强于稀HNO3。
丙:两个反应的产物不同,浓HNO3生成NO2、稀HNO3生成NO。
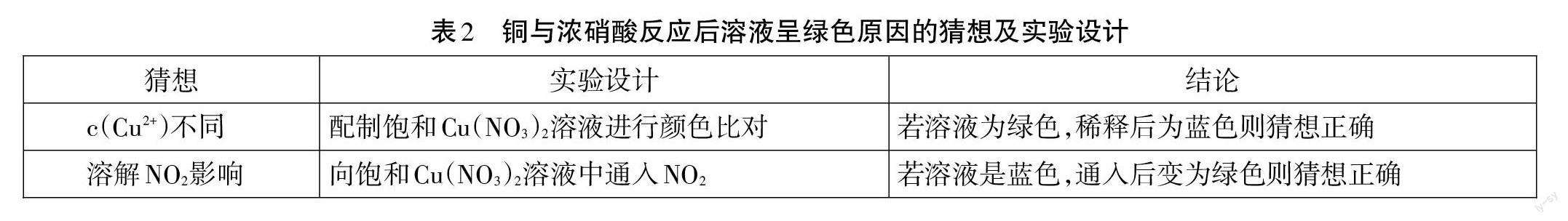
丁:Cu(NO3)2溶液是蓝色的,但是为什么Cu与浓HNO3反应后生成Cu(NO3)2溶液呈现的是绿色呢?
【教师追问】同学们说得非常好,HNO3的浓度影响还原产物中氮元素的价态,HNO3越稀,还原产物中氮元素的价态越低。Cu与浓HNO3反应后生成Cu(NO3)2溶液呈现的是绿色,同学们能提出猜想和验证方法吗?
【小组探究】小组设计探究铜与浓硝酸反应后溶液呈綠色原因(表2)。
【板书】
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
【提出问题3】书写并结合硝酸与铜反应的离子方程式,分析三酸抛光液中,再次分析稀硫酸起到的作用,如何设计实验验证呢?
【学生1】向含有稀Cu(NO3)2溶液中加入Cu片,没有观察到明显现象,滴入稀H2SO4,观察铜表面有气泡生成,无色气体遇空气变为红棕色,说明有NO生成。
【学生2】这就说明了NO在酸性条件下,具有很强的氧化性,可继续氧化金属Cu,在HNO3中加入稀H2SO4可提高NO的利用率。
【总结】同学们说得非常好,稀硫酸提供H+,强酸性条件可以增强NO的氧化性,加入稀硫酸可增强NO的利用率。
设计意图:通过实验设计,收集证据,证明NO在酸性条件下具有强氧化性,提升学生科学探究意识。
【提出问题4】硝酸具有非常强的氧化性,是所有的金属都能与硝酸反应吗?工业如何盛装与运输浓硝酸呢?
①工业硝酸盛装于。②加热条件下,铁与浓硝酸反应的化学方程式。
【板书】Fe、Al常温遇到浓硝酸,钝化
【学科故事】关于浓硝酸,还有一个爱国学科故事——丹麦物理学家玻尔用王水溶解诺贝尔金质奖章。
玻尔(见图7)是丹麦物理学家、诺贝尔奖章获得者。第二次世界大战期间,由于德军即将占领丹麦,玻尔被迫要离开自己的祖国。他坚信以后一定能返回祖国,决定把心爱的诺贝尔奖章留下。为了不使奖章落入德军手中,他把奖章溶解在一种溶液里,并存放在瓶子里。丹麦被德军占领后,纳粹分子闯进玻尔家中,但是连奖章的影子也没有发现。战后,玻尔从溶液中提取出金,又重新铸成了奖章。
【总结】玻尔是用什么溶液使金质奖章溶解的呢?这种溶液就是王水。是浓硝酸和浓盐酸体积比为1∶3的混合物。王水的氧化性比硝酸还要强,可以使金溶解。这位伟大的科学家不仅用他的知识和智慧保住了这枚金质奖章,而且还极大地藐视了敌人。同学们要学习玻尔这种热爱科研及热爱祖国精神,为祖国的发展贡献力量。
【板书】4.硝酸的用途
【提出问题5】硝酸是重要的化工原料,用于制化肥、农药、炸药、染料、金属钝化、金属抛光等。学完本节课,同学们思考三酸抛光液在处理铜制品过程中是否存在缺点呢?采取哪些措施可以避免?
【学生1】三酸抛光液可以使陈旧的铜制品焕然一新,但是在抛光过程中会生成污染空气的有毒气体。
【学生2】根据4NO+3O2+2H2O=4HNO3或4NO2+O2+2H2O=4HNO3反应,工作过程中向溶液中通入氧气,以氧化氮的氧化物,即可减少氮的氧化物污染,又可提高硝酸利用率。
【学生3】可以寻找一种物质,在溶液中既能吸收氮的氧化物达到处理污染的目的,又不影响抛光液工作。
【总结】同学们说得非常好,学习本节课,我们大家都可以为金属抛光工业建言献策了。化学给我们生产生活带来便利,同时也会存在一些问题,所以需要我们正确对待采用合理的方式运用化学知识助力生产生活,这样,我们的生活才能更加美好!
设计意图:增强环保意识,辩证看待问题,运用知识探讨趋利避害的方法,增强社会责任感。
五、教学反思
情境学习理论认为,学习的本质是学生参与真实的情境活动,与环境相互作用的过程,是形成实践探究能力的过程。所以学习的核心是参与,在参与相互作用中,对知识建立合理的解释和灵活的应用。
1.以真实问题情境为主线贯穿课堂。情境化问题是师生开启学习的切入点,是激发学生学习兴趣的关键点,是学生学科核心素养形成和发展的重要契合点。本课时以三酸抛光液将锈迹斑斑的“原件”变成光亮的“新件”为情境,给学生以美的感受,深切体会到化学在生产生活中起到的重要作用。而抛光液中蕴含的一系列化学问题激发学生强烈的想了解硝酸的求知欲,解决每个问题都是学生学科核心素养发展的过程。
2.充分发挥实验教学功能。实验是解决化学问题的直接手段。通过建构“提出问题—猜想假设—设计方案—收集证据—证明真伪—收获结论”的探究模型,在实践活动中,充分利用实验现象进行评价,发展学生科学探究、证据推理、宏微结合学科核心素养。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020.
[2]孙春姝.素养为本的化学实验教学设计——以《硝酸的强氧化性》为例[J].新教育,2020(8):5-7.

